
探讨床旁实时浓度监测氦气稀释法(RHe法)检测功能残气量的准确性、精度及重复性。
选择18例健康比格犬,利用静脉注射油酸制作急性呼吸窘迫综合征(ARDS)动物模型,在制作动物模型前后采用床旁RHe法及胸部CT扫描法检测功能残气量,实验过程中,实时监测实验动物呼吸、心率、血压等生命体征,选用Bland–Altman分析法及配对t检验进行统计学分析。
对于造模前健康肺,CT扫描法检测功能残气量(FRCCT)与床旁RHe法检测功能残气量(FRCRHe)呈线性相关,回归方程为FRCRHe=0.959×FRCCT+23.3(R2=0.89,P<0.000 1)。RHe法与CT法的偏倚为(6.3±27.6) ml (1.5%±7.1%), 95%可信区间为–47.7~60.3 ml;对于造模后ARDS肺,直线回归方程为FRCRHe=0.693×FRCCT+66.4(R2= 0.507,P<0.001)。RHe法与CT法的偏倚为(7.9±27.1) ml (4.5%±13.6%),95%可信区间为–45.3~61.1 ml。两次FRCRHe之间的差别在健康肺和ARDS肺分别为(–0.1%±5.8%)和(0.2%±9%)。
床旁RHe法用于检测健康及ARDS模型肺功能残气量均具有良好的准确性、精度及重复性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性呼吸窘迫综合征(ARDS)的显著呼吸力学特征为肺功能残气量(FRC)的急剧下降,其正是当代肺保护性通气策略的基础[1]。不恰当的机械通气可引起呼吸机所致肺损伤(VILI)[2],最新研究表明VILI发生取决于潮气量与FRC的比值即肺应变大小[3,4,5,6,7]。因此,准确的检测FRC是控制肺应变在合理范围、选择理想潮气量及减少VILI的重要手段[2]。胸部CT扫描及其定量分析技术是精确检测FRC的金标准方法[8,9,10],该法不能床旁进行,不能满足ARDS患者床旁CT扫描需求。氦气稀释曾被认为具有广泛的应用前景,但由于传统氦气稀释法需要复杂的外围装置而无法得到广泛应用[8]。近年诞生了简化的氦气稀释技术,并应用于气管插管的患者中[11,12]。但该法存在以下不足之处,需将患者与呼吸机脱离,挤压球囊的节律及幅度明显影响检测结果,且无法明确检测装置和肺之间氦气是否充分混合均匀,在将检测装置与气管插管相连接及分离的过程中可能存在漏气而影响检测的准确性。为改进该技术,本研究引入T型阀及具有实时浓度显示功能的氦气分析仪进行FRC的检测,以CT法检测的FRC(FRCCT)为参照标准,分析该实时浓度监测氦气稀释法(RHe法)检测FRC(FRCRHe)的准确性、精度及重复性。
选取18只体重10~14 kg成年比格犬作为研究对象,所有比格犬均购自广东省药理研究所。
油酸25 g (美国Sigma),丙泊酚(英国阿斯利康公司),苯磺酸阿曲溴铵粉针(上海恒瑞医药有限公司),咪达唑仑注射液(江苏恩华药业股份有限公司),盐酸氯胺酮注射液(福建古田药业有限公司),硫酸阿托品注射液1 ml: 0.5 mg (芜湖康奇制药有限公司),盐酸利多卡因注射液(常州康普药业有限公司);心电监护仪(深圳迈瑞),Evita 4呼吸机(德国德尔格公司), 128排CT(德国西门子),氦气浓度检测仪(美国C–squared公司),T形阀(美国HANS RUDOLPH公司)。
按前期研究成熟的麻醉及手术操作方式进行[13]。实验前肌肉注射氯胺酮100 mg、阿托品0.5 mg,麻醉诱导成功后称重,仰卧位固定于动物实验台。连接心电监护仪,双侧腹股沟备皮、消毒、利多卡因局部麻醉、动静脉植管,并连接动脉血压监测传感器。喉镜明示下插入7.5 mm气管插管,过程中必要时追加氯胺酮50 mg。气管插管成功后立即连接呼吸机。静脉注射2~10 mg·kg–1·h–1丙泊芬麻醉维持,顺阿曲库铵0.1~0.2 mg·kg–1·h–1维持肌松,麻醉诱导及操作期间,静滴0.9%生理盐水100 ml/h。随后,实验动物转移至CT室,胸部CT法及RHe法检测FRC,两次检测间至少5 min机械通气。实验动物无自主呼吸时,采用Evita 4呼吸机进行机械通气,造模前潮气量为10 ml/kg体重,造模后为8 ml/kg体重,其余参数设置如下:吸氧分数(FiO2) 50%,呼吸频率20~30次/min,依据动脉血二氧化碳分压(控制在35~45 mmHg之间,1 mmHg=0.133 kPa)适当调节,吸呼比1∶2,呼气末正压5 cmH2O(1 cmH2O=0.098 kPa)。
造模前后,实验犬仰卧位固定于CT机移动平台,呼吸机支持下、增大静脉麻醉药物速度、使用肌松药物,待充分麻醉、肌松后,将气管插管与呼吸回路撤离,立即行胸部CT扫描,尔后迅速将呼吸机与气管插管相连。CT软件版本syngo CT2008G,设置如下:剪切宽度:64 mm×2 mm×0.6 mm,层厚:2 mm及5 mm,重建间距:2 mm及5 mm,数据采集视场:180 mm,重建视场:180 mm,KVp:100,X线光管电流:110 mA,像素尺寸:0.32/0.32,采集矩阵:512×512。Lung CAD2.1肺功能分析软件(沈阳东软集团)对CT扫描图像进行肺分割及CT肺功能分析。每一个立体像素假设由肺组织及气体(–1 000 HU)两种成分组成。每一立体像素气体所占比率为气体体积/(气体体积+组织体积)=平均CT值/(气体CT值–组织CT值),肺组织密度与水密度接近(0 HU),故气体所占比率=像素密度/–1 000;组织比率=1–气体比份。每一立体像素中气体和组织的容积为气体或组织所占比份乘以立体像素的容积。充分镇静下,平静呼气末气道压力为0 cmH2O时各个像素中气体体积之和为FRC。
气囊内预先充500 ml含8.00%氦气的氦氧混合气体,阻断自主呼吸,呼气末旋转T型阀旋钮使气流方向转至氦气浓度检测系统,操作者规律的挤压气囊,以使气囊内气体和犬支气管肺内气体充分混合,用预先校正的氦气浓度检测仪实时监测气囊内氦气浓度,待氦气浓度稳定不变后记录,并旋转T型阀旋钮使气流与呼吸机相通。根据以下标准方程计算: FRCRHe(ml)=(Vb*Ci/Cf)–Vb (FRCRHe为氦气稀释法测得的FRC,Vb气囊内初始气体容积,Ci气囊内初始氦气浓度8.0%, Cf为稀释后气囊内氦气浓度)[11],至少5 min后,重复测量1次,取其平均值。
比格犬实验前体重为(12.1±1.2)kg。犬PaO2/FiO2为(476.5±54.2)mmHg,造模后PaO2/FiO2为(161.1±18.3) mmHg。造模前及造模后CT扫描耗时分别为(17.5±3.4) s和(16.7±2.8) s,且明显短于RHe法的(50.6±7.2) s和(44±6.3)s。检测过程中无氧合及血流动力学急剧下降情况(表1)。
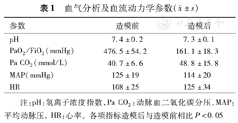
血气分析及血流动力学参数( ±s)
±s)
血气分析及血流动力学参数( ±s)
±s)
| 参数 | 造模前 | 造模后 |
|---|---|---|
| pH | 7.4±0.2 | 7.3±0.1 |
| PaO2 /FiO2 (mmHg) | 476.5±54.2 | 161.1±18.3 |
| Pa CO2 (mmol/L) | 40.7±6.6 | 48.8±15.8 |
| MAP(mmHg) | 125±19 | 114±20 |
| HR | 108±25 | 125±34 |
注:pH:氢离子浓度指数,Pa CO2:动脉血二氧化碳分压,MAP:平均动脉压,HR:心率。各项指标造模后与造模前相比P<0.05
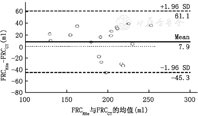
对于造模前健康肺FRCCT (414.1±78.7) ml与FRCRHe(420.4±80.3) ml相比差异无统计学意义(P=0.343),呈良好的线性关系。直线方程为FRCRHe=0.959 × FRCCT+23.3(R2= 0.89,P<0.000 1)。RHe法与CT法的偏倚为(6.3±27.6) ml (1.5%±7.1%),精度(1倍标准差)为27.6 ml (占CT法的6.7%),差异的95%可信区间为–47.7~60.3 ml (图1)。差异的绝对值占比(FRCRHe–FRCCT)/FRCCT为6.3%±3.5%。
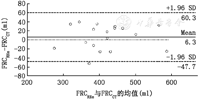

造模后ARDS肺的FRCCT (190.6±36.2) ml与FRCRHe (198.6±35.3) ml相比差异无统计学意义(P=0.232),亦呈良好的线性关系,直线方程为FRCRHe=0.693 × FRCCT+ 66.4(R2=0.507,P<0.001), RHe法与CT法的偏倚为(7.9±27.1) ml (4.5%±13.6%),精度(1倍标准差)为27.1 ml (占CT法的14.2%),差异的95%可信区间为–45.3~61.1 ml (图2)。差异的绝对值占比即(FRCRHe–FRCCT)/ FRCCT为13.3%±5.7%。

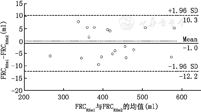
对于健康肺,RHe法两次测量的FRCRHe之间具有高度的一致性(R2=0.914, P<0.000 1),两次FRCRHe之间存在的偏倚为–0.1%±5.8%(–3.8±24.0) ml,差异的95%可信区间为–12.2%和10.3% (–51和43.3) ml(图3),重复性系数(2倍标准差)为48 ml (11.6%);对于ARDS肺,Rhe法两次测量的FRCRHe之间具有高度的一致性(R2=0.634, P<0.000 1)。两次FRCRHe之间存在的偏倚为0.2%±9% (3.9±22) ml,差异的95%可信区间为–17.4%和17.9% (–47.1 ml和39.3 ml) (图4)。重复性系数(2倍标准差)为44 ml(14.7%)。

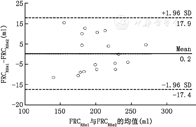

RHe法测FRC具有良好的准确性、精度及重复性,在健康肺RHe法的准确度为6.3 ml (占CT法的1.5%),精度为27.6 ml (占CT法的6.7%),重复系数为48 ml (11.6%);在ARDS肺RHe法的准确度为7.9 ml (占CT法的4.5%),精度为27.1ml (占CT法的14.2%),重复系数为44 ml (14.7%)。
随着ARDS、呼吸力学及机械通气相关研究的逐渐深入,以呼吸力学为导向的肺保护性通气越来越受到广大学者的重视,也是未来个体化通气的发展方向[19]。为此,监测FRC对于制定机械通气方案及治疗过程中及时调整机械参数具有重要意义[4,19]。目前检测FRC的金标准方法为胸部CT法[8,9,10],但目前床旁CT扫描的开展罕见,且反复多次CT扫描,具有较大剂量的射线辐射,不利于患者及相关人员的健康,反复搬运患者增加了患者的风险,该技术不能满足床旁监测FRC的需要。氦气稀释法克服了上述技术限制,Heldt等[20]率先开展了"盒中囊"技术,张春雨等[21]也用动物实验对其进行了探讨,该技术为床旁检测FRC技术开辟了新的发展方向,但其为氦气稀释法的最初形式,需要复杂的重复呼吸系统,呼吸机与麻醉机不同,本身并不配备重复呼吸回路,该技术的发展受到明显限制[8],加之该系统中并不配备氦气浓度分析仪,在检测氦气浓度时,需反复手工采样,减少了系统中氦气含量,增加了氦气泄漏的风险及概率,目前并未发展为成熟的床旁检测FRC技术。近年,Patroniti等[11,12]引入了"简化氦气稀释法",并应用于气管插管的患者中。但该法需将患者与呼吸机脱离,挤压球囊的节律及幅度明显影响检测结果,且无法明确检测装置和肺之间氦气是否充分混合均匀,在将检测装置与气管插管相连接及分离的过程中可能存在漏气而影响检测的准确性。为改进该技术,本研究中,引入T形阀用于手动控制气流方向,测量时将犬呼吸气流转向氦气浓度检测装置,反复挤压气囊,直至氦气浓度稳定不变,再转动T形阀使气流与呼吸机相通,过程中无需断开呼吸回路。避免了"简化氦气稀释法"因将氦气浓度检测装置与实验动物连接和分离过程中氦气的泄漏而影响检测准确性。另外,研究中采用具有高度准确性和灵敏度的氦气浓度检测仪,并能实时显示氦气浓度,避免了简易氦气稀释法通气次数(10个呼吸)不足及每次通气量不均一对于测量的影响。RHe法在测量过程中连续挤压气囊直至浓度显示稳定,使肺与气囊内气体更加充分混合[11,12],理论上挤压球囊的节律及幅度对于检测结果影响较小。这些改进避免了个体间差异较大的情况,使该法既能用于健康肺的大肺容积也能用于"婴儿肺"的小肺容积时FRC的测量。事实上,本研究中健康肺的大肺容积(414.1±78.7) ml FRC为"婴儿肺"的(190.6±36.2) ml小肺容积的两倍,但是,RHe法与CT法的偏倚分别仅为6.3 ml (占CT法的1.5%)和7.9 ml(占CT法的4.5%)。
当然还存在其他可能影响两种检测方法差异的因素。RHe法实质上仍是基于惰性气体稀释技术,RHe法测得的FRC包括诸如大气道、T性阀容积、其气管插管容积等死腔容积(约15 ml)而CT法不包含此部分容积,使FRCRHe整体偏大于FRCCT。另外,本研究中FRCRHe的测量在FRCCT之后,由于测量FRCCT时需将实验动物与呼吸机完全脱离,气道压降为0 cmH2O,肺一定程度上发生去复张,可能影响后续FRCRHe的测量,为减少这一影响,在测量FRCRHe之前,均首先按机械通气方案至少5 min,并在实验前反复演练操作流程,缩短CT扫描及实验动物窒息时间。在测量FRCCT时由于气管插管通向大气,FiO2为21%,而测量FRCRHe时FiO2 50%,理论上高FiO2可能使肺泡易发生闭陷,而引起FRC较测量FRCCT时变小,由于CT法和RHe法间隔时间较短,这一影响不明显。研究结果也表明RHe法与CT法的偏倚很小,两种方法间不存在明显的系统性误差。另外,气道分泌物在检测过程中影响细支气管的通畅性,本研究由于采用中度ARDS模型,肺损伤较重,严重的肺水肿引起气道内偏多的稀薄分泌物,可能一定程度上影响RHe法的准确性及重复性,研究中也发现,建模后ARDS模型肺FRCCT与FRCRHe及两次FRCRHe的相关性有降低趋势、差异的绝对值也存在增加趋势。为避免此影响,建议在检测前尽可能清除气道分泌物、通畅气道。
RHe法的精度无论在造模前健康肺还是造模后ARDS肺都是可以接受的,分别为6.7%和14.2%,且优于简化的氦气稀释法[11]和电阻抗法[22],并与氮气冲洗法相近[23]。不过,我们也发现RHe法的精度在ARDS肺及健康肺中是不同的,这可能与不同的病理生理状态有关。在测量FRC时,CT法通常认为是金标准[8,9,10],其通过测量肺的密度,假设肺由气体和肺组织两部分构成,从而计算出FRC[12],既可测出肺内可通气区域气体又能测出非通气区域所含气体体积。与之相反,所有氦气稀释法只能检测肺内可通气区域气体体积[8],因此受通气功能影响。对于健康肺不存在通气功能障碍,而在ARDS肺由于过多分泌物及痰液的存在而影响气道的通气功能。
RHe法测得FRC之间的差异在造模后ARDS肺约为–0.3%±8.1%,在造模前健康肺约为–0.7%±5.8%。重复系数与现存用于机械通气患者的方法接近[11,12,18]。另外,RHe法测量FRC的误差个体差异小,远小于简化氦气稀释法的35%[11]。
床旁RHe法的成功建立具有重要的临床意义。众所周知,VILI是机械通气的常见潜在不良反应,通常将过大潮气量引起的肺损伤称之为"容积伤",过高气道压引起的为"气压伤"[24]。"容积伤"和"气压伤"最终取决于非生理性肺应力(跨肺压)和肺应变(潮气量与FRC之比)[3,4,5,6,7],这表明FRC是肺保护性通气的基础。本研究意在建立具有良好准确性、精度及重复性的床旁检测FRC法,为床旁监测FRC,并及时调节潮气量控制肺应力和肺应变在一定的生理范围提供可能,从而优化呼吸力学导向的肺保护性通气方案[19]。另外,利用该技术准确的检测FRC可以辅助鉴别肺内型和肺外型ARDS,前者主要由重症肺炎等直接肺损伤因素所致,FRC等肺容积及肺顺应性明显降低,而后者主要由脓毒血症等全身性间接因素所致,以胸壁顺应性降低为主,FRC及肺顺应性往往大于肺内型ARDS,与二者的影像学表现不完全相同相一致[13]。因此,该技术对于不同病因、不同影像学表现的肺损伤具有一定的鉴别意义,但尚需进一步针对性的研究证实。
本研究存在一定的不足之处。测量过程中,不能维持呼气末正压,对于造模后ARDS肺可能存在一定的去复张;由于引入了T形阀,在测量FRC过程中,T形阀增加了通气死腔量,理论上存在一定程度的低通气风险;本研究采用同一动物健康和ARDS两种健康状态下进行研究,"患病"前不存在基础疾病,这与人类ARDS患者患病前可能存在COPD等各种基础病史不同,后者可能亦会影响氦气稀释的效果,因此在临床研究进行之前,尚不能将该法用于人ARDS患者。总之,无论是造模前健康动物还是造模后ARDS犬,床旁实时浓度监测氦气稀释法可以床旁便捷的进行FRC检测,且具有良好的准确性、精确性及重复性。但尚需临床验证其在人ARDS患者中的意义。


 ±s表示,FRCRHe与FRCCT的比较及两次FRCRHe之间的比较采用Bland–Altman法[
±s表示,FRCRHe与FRCCT的比较及两次FRCRHe之间的比较采用Bland–Altman法[
























