
研究不同狼疮抗凝物(LA)试验的临床诊断效能,为临床提供有价值的LA指标。
370份柠檬酸盐抗凝样本来自2014年9月至2015年3月就诊于北京协和医院的患者或体检者,分别通过改良蝰蛇毒磷脂时间法(dRVVT)、硅凝固时间法(SCT)、活化部分凝血活酶时间法APTT–Actin、APTT–Actin FSL和APTT–SS共5种方法及相应的1∶1混合试验、确证试验检测LA。由此推算每种方法1∶1混合试验计算值循环抗凝指数(ICA)、确证试验计算值纠正百分比(C)和标准化比值(NR)的参考范围(RI)/Cut–off值,进而研究每种方法决定的LA的临床诊断效能。
不同试验方法LA的RI/Cut–off值不同,dRVVT法的敏感度最高(70.3%~93.1%),APTT法最低(<55.0%)。APTT–SS法的敏感度(47.5%~53.5%)略高于APTT Actin法(32.7%~39.6%)和APTT–Actin FSL法(29.7%~36.6%)。dRVVT法的特异度为91%~100%,SCT法为80.6%~100%,APTT法为85.1%~98.5%。其中,SCT法确证试验的特异度均为100%。针对弱阳性LA结果,5种方法的敏感度均下降,但dRVVT法和SCT法的敏感度仍>50.0%,APTT–Actin法和APTT–Actin FSL法<16.0%。除APTT–SS法外,dRVVT法及SCT法的组合方案检测的LA与APS血栓形成均具有相关性(OR值:5.562~9.240,均P<0.05)。
实验室应根据LA具体试验方法建立RI/Cut–off值。dRVVT法是LA的最佳检测方法,与指南说明一致。APTT–SS法优于其他APTT法,dRVVT法及SCT法的组合方案检测的LA均与APS血栓形成相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
狼疮抗凝物(LA)是一组能与负电荷磷脂及磷脂蛋白质复合物相结合的lgG/IgM型免疫球蛋白。LA可作用于凝血酶原复合物(Xa、Va、Ca2+及磷脂)和Tenase复合体(Ⅸa、Ⅷa、Ca2+及磷脂),导致磷脂依赖的凝血试验时间延长[1]。LA持续存在常见于抗磷脂抗体综合征(APS)、系统性红斑狼疮(SLE)等自身免疫性疾病,与患者动静脉栓塞、病态妊娠等风险密切相关[2,3]。实验室基于LA在体外能延长磷脂依赖的不同途径的凝血试验时间来检测机体是否存在LA[4]。LA检测方法包括(1)筛选试验:磷脂依赖的凝血初筛试验延长,提示可能存在循环抑制物;(2)1∶1混合试验:证实凝血时间延长不是由凝血因子缺乏导致;(3)确证试验:证实循环抑制物的磷脂依赖性[5,6,7]。不同的LA检测分析方法和结果表示方式的参考范围(RI)/Cut–off值不同,其临床诊断效能也不同。2014年美国临床实验室标准化协会(CLSI)发布了第一版LA检测指南H60[7],指南中关于试验的流程和RI/Cut–off值的建立方法与国际血栓与止血协会(ISTH)2009指南未达成一致[5],但目前对两种指南的验证研究尚无报道。本实验拟通过研究5种不同的LA检测方法的临床诊断效能,以期为临床提供有价值的LA指标。
370份样本来源于2014年9月至2015年3月就诊于北京协和医院的患者或体检者,男160例,女210例,年龄1~87岁。其中,135名表观健康人用于RI/Cut–off值建立;146例APS、SLE、结缔组织病(CTD)等自身免疫疾病患者用以评价不同RI/Cut–off值敏感度,入选患者诊断符合国际分类标准,并处于疾病活动期,样本采集时未同时进行抗凝治疗;40例凝血因子缺乏(FD)患者(A型血友病26例,B型血友病8例,血管性血友病2例,其他凝血因子缺乏4例)及49例口服抗凝剂治疗(OAT)患者用于评价不同RI/Cut–off值特异度。OAT患者进行口服抗凝剂之前凝血筛选检测结果正常,所有入选者未进行肝素治疗。
入选对象抽取109 mmol/L柠檬酸盐抗凝静脉血2.7 ml,抗凝剂与样本比例为1∶9。样本采集后2 h内在室温下以1 500×g条件二次离心10 min,以保证乏血小板血浆中血小板计数<10×109/L。血浆于–80 ℃冻存,检测前37 ℃水浴15 min快速复融。
分别对每份样本进行活化部分凝血活酶时间法APTT–Actin、APTT–Actin FSL、APTT–SS,改良蝰蛇毒磷脂时间法(dRVVT)和硅凝固时间法(SCT)筛选试验检测。APTT–Actin和APTT–Actin FSL试剂激活剂为鞣花酸,APTT–SS激活剂为二氧化硅。
1∶1混合试验由等体积患者血浆与正常血浆混合均匀,未经孵育前进行APTT–Actin、APTT–Actin FSL、APTT–SS、dRVVT和SCT检测。试验结果以循环抗凝物指数(ICA)表示,ICA=(1∶1混合试验凝血时间–正常血浆凝血时间)/筛选试验凝血时间×100%。正常血浆(NPP)由40名表观健康人柠檬酸盐抗凝样本二次离心后血浆混匀获得。
dRVVT和SCT法同时进行确证试验检测,检测结果以纠正百分比(C)和标准化比值(NR)表示。纠正百分比(C)=(筛选试验比值–确证试验比值)/筛选试验比值×100%,筛选试验比值=患者筛选试验凝血时间/NPP均值,确证试验比值=患者确证试验凝血时间/NPP均值。标准化比值(NR)=筛选试验比值/确证试验比值。
APTT–Actin和APTT–Actin FSL检测在Sysmex CA7 000全自动凝血分析仪上进行,APTT–SS、dRVVT和SCT检测在ACL TOP 700全自动凝血分析仪上进行。检测当日所有检测项目的质控在控后,进行试验样本的检测。检测方法见表1。
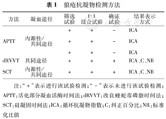
狼疮抗凝物检测方法
狼疮抗凝物检测方法
| 方法 | 凝血途径 | 筛选试验 | 1∶1混合试验 | 确证试验 | 结果表示方式 |
|---|---|---|---|---|---|
| + | + | – | ICA | ||
| APTT | 内源性/共同途径 | + | + | – | ICA |
| + | + | – | ICA | ||
| dRVVT | 共同途径 | + | + | + | ICA、C、NR |
| SCT | 内源性/共同途径 | + | + | + | ICA、C、NR |
注:"+"表示进行该试验检测;"–"表示未进行该试验检测;APTT:活化部分凝血活酶时间法;dRVVT:改良蝰蛇毒磷脂时间法;SCT:硅凝固时间法;ICA:循环抗凝物指数;C:纠正百分比;NR:标准化比值
5种LA检测方法不同结果表示方式的RI/Cut–off值、敏感度、特异度、阳性似然比、阴性似然比和准确度结果见表2。不同试验方法的LARI/Cut–off值不同。5种方法中,dRVVT法的敏感度最高,SCT法的敏感度次之。3种APTT法的敏感度均<55.0%。在APTT法中,APTT–SS法的敏感度略高于APTT–Actin法和APTT–Actin FSL法。dRVVT法的特异度为91%~100%,SCT法为80.6%~100%,APTT法为85.1%~98.5%。其中,SCT法确证试验的特异度均为100%。APTT–Actin法的ICA阳性似然比最小,而阴性似然比最大。以第97.5百分位数为RI/Cut–off值,dRVVT法C和NR准确度最高为95.8%。
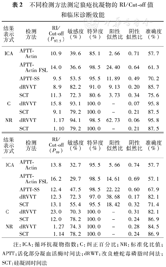
不同检测方法测定狼疮抗凝物的RI/Cut–off值和临床诊断效能
不同检测方法测定狼疮抗凝物的RI/Cut–off值和临床诊断效能
| 结果表示方式 | 检测方法 | RI/Cut–off(P97.5) | 敏感度(%) | 特异度(%) | 阳性似然比 | 阴性似然比 | 准确度(%) | RI/Cut–off(P99) | 敏感度(%) | 特异度(%) | 阳性似然比 | 阴性似然比 | 准确度(%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ICA | APTT–Actin | 10.9 | 39.6 | 85.1 | 2.66 | 0.71 | 57.7 | 13.8 | 32.7 | 95.5 | 5.66 | 0.74 | 57.7 |
| APTT–Actin FSL | 14.0 | 36.6 | 98.5 | 24.40 | 0.64 | 61.3 | 16.2 | 29.7 | 98.5 | 14.61 | 0.69 | 57.1 | |
| APTT–SS | 9.5 | 53.5 | 95.5 | 11.89 | 0.49 | 70.2 | 12.4 | 47.5 | 98.5 | 22.22 | 0.60 | 67.9 | |
| dRVVT | 8.9 | 82.2 | 91.0 | 9.13 | 0.20 | 85.7 | 12.3 | 72.3 | 97.0 | 38.68 | 0.17 | 82.1 | |
| SCT | 11.3 | 72.3 | 80.6 | 3.73 | 0.34 | 75.6 | 13.1 | 55.4 | 95.5 | 18.42 | 0.32 | 71.4 | |
| C | dRVVT | 15.8 | 93.1 | 100.0 | – | 0.07 | 95.8 | 23.0 | 70.3 | 100.0 | – | 0.31 | 82.1 |
| SCT | 9.1 | 79.2 | 100.0 | – | 0.21 | 87.5 | 12.0 | 78.2 | 100.0 | – | 0.24 | 86.9 | |
| NR | dRVVT | 1.17 | 94.1 | 98.5 | 62.73 | 0.06 | 95.8 | 1.27 | 74.3 | 100.0 | – | 0.28 | 84.5 |
| SCT | 1.10 | 79.2 | 100.0 | – | 0.21 | 87.5 | 1.14 | 78.2 | 100.0 | – | 0.24 | 86.9 |
注:ICA:循环抗凝物指数;C:纠正百分比;NR:标准化比值;APTT:活化部分凝血活酶时间法;dRWT:改良蝰蛇毒磷脂时间法;SCT:硅凝固时间法
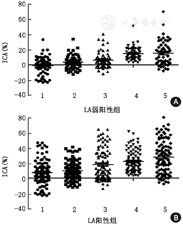
以dRVVT标准化比值结果1.17~1.50为弱阳性判断标准[6],分析59份LA弱阳性样本不同检测方法1∶1混合试验的敏感度,结果见图1。以第97.5百分位数为RI/Cut–off值,dRVVT法、SCT法的敏感度分别为71.2%和54.2%,APTT–SS法、APTT–Actin法和APTT–Actin FSL法的敏感度分别为30.5%、15.3%和15.3%。以第99百分位数为RI/Cut–off值,dRVVT法、SCT法、APTT–SS法、APTT–Actin法和APTT–Actin FSL法的敏感度分别为54.2%、52.5%、23.7%、11.9%和11.9%。

作为筛查指标,LA的阳性检出率具有重要的临床价值。根据如上检测结果,选择dRVVT法、SCT法和APTT–SS共3种方法,当筛选试验阳性后,进行1∶1混合试验(ICA)和(或)确证试验(NR)分析,1∶1混合试验和(或)确证试验标准化比值阳性后视为LA阳性。各种组合方案检测的疾病LA阳性率见表3。dRVVT标准化比值及其组合在APS中阳性率最高,APTT–SS在各疾病组中均具有较高阳性率,APTT–SS 1∶1混合试验在APS和SLE的LA阳性率降低。APTT–SS和1∶1混合试验在FD中阳性率分别为92.5%和7.5%。在OAT患者中,除外SCT标准化比值,其余试验及组合具有较高阳性率。SCT在FD和HS中阳性率为0。
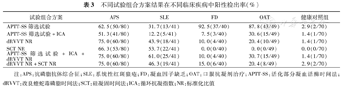
不同试验组合方案结果在不同临床疾病中阳性检出率(%)
不同试验组合方案结果在不同临床疾病中阳性检出率(%)
| 试验组合方案 | APS | SLE | FD | OAT | 健康对照组 |
|---|---|---|---|---|---|
| APTT–SS筛选试验 | 62.5(50/80) | 31.7(13/41) | 92.5(37/40) | 87.8(43/49) | 2.9(2/70) |
| APTT–SS筛选试验+ICA | 51.3(41/80) | 12.2(5/41) | 7.5(3/40) | 30.6(15/49) | 1.4(1/70) |
| dRVVT NR | 75.0(60/80) | 43.9(18/41) | 10.0(4/40) | 20.4(10/49) | 1.4(1/70) |
| SCT NR | 66.3(53/80) | 53.7(22/41) | 0.0(0/40) | 0.0(0/49) | 0.0(0/70) |
| APTT–SS筛选试验+ICA+dRVVT NR | 75.0(60/80) | 61.0(25/41) | 10.0(4/40) | 30.7(15/49) | 1.4(1/70) |
| dRVVT NR+SCT NR | 75.0(60/80) | 46.3(19/41) | 15.0(6/40) | 20.4(8/49) | 2.9(2/70) |
注:APS:抗磷脂抗体综合征;SLE:系统性红斑狼疮;FD:凝血因子缺乏;OAT:口服抗凝剂治疗;APTT–SS:活化部分凝血活酶时间法;dRVVT:改良蝰蛇毒磷脂时间法;SCT:硅凝固时间法;ICA:循环抗凝指数;NR:标准化比值
选择dRVVT法、SCT法和APTT–SS,每种方法按照传统的三步流程即筛选试验(凝固时间)+1∶1混合试验(ICA)+确证试验,以及两步流程NR检测LA,分析LA与APS血栓形成的相关性。如表4所示,dRVVT法及SCT法以NR检测所得LA与血栓形成相关性最大,比值比(OR值)分别为9.240和6.364,P值分别为0.021和0.016;其次为dRVVT法、SCT法的传统三步流程。而APTT–SS法的筛选试验+1∶1混合试验(ICA)方案检测的LA与APS血栓形成无相关性(P>0.05)。
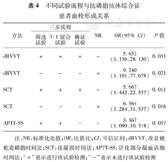
不同试验流程与抗磷脂抗体综合征患者血栓形成关系
不同试验流程与抗磷脂抗体综合征患者血栓形成关系
| 方法 | 三步流程 | NR | OR(95% CI) | P值 | ||
|---|---|---|---|---|---|---|
| 筛选试验 | 1∶1混合试验 | 确证试验 | ||||
| dRVVT | + | + | + | – | 5.652(1.136,28.130) | 0.031 |
| dRVVT | – | – | – | + | 9.240(1.101,77.678) | 0.021 |
| SCT | + | + | + | – | 5.667(1.442,22.557) | 0.011 |
| SCT | – | – | – | + | 6.364(1.284,31.537) | 0.016 |
| APTT–SS | + | + | – | – | 3.367(1.099,10.318) | 0.057 |
注:NR:标准化比值;OR:比值比;CI:可信区间;dRVVT:改良蝰蛇毒磷脂时间法;SCT:硅凝固时间法;APTT–SS:活化部分凝血活酶时间法;"+"表示进行该试验检测;"–"表示未进行该试验检测
狼疮抗凝物检测对APS等自身免疫疾病的诊断、预后及治疗监测有着极其重要的作用[8]。各国际指南对LA检测的样本准备、检测方法选择、RI/Cut–off值的建立和结果解释进行了详细说明[4,5,9]。3种指南均推荐对LA进行2种不同凝血途径的方法进行检测,澳大利亚皇家病理学院和美国病理学家协会室间质评统计结果显示,APTT和dRVVT法是国际上最常用的2种检测方法[6]。本研究评估了APTT法、dRVVT法和SCT法不同RI/Cut–off值的临床诊断效能,并对指南中不一致的内容进行了验证。
如指南和文献报道所示,不同LA检测方法的RI/Cut–off值不同,LA检测结果受仪器种类、试剂成分及结果表示方式等影响,实验室应对每种LA检测方法建立本实验室的RI/Cut–off值,包括ICA、C、比值等计算结果[10,11]。目前,各指南在RI/Cut–off值的设立上尚未达成一致。ISTH 2009指南以健康人群第99百分位数为RI/Cut–off值,英国血液学标准委员会(BCSH)2012指南和CLSI 2014(H60)指南以第97.5百分位数为RI/Cut–off值。因LA检测尚无标准方法,本研究以根据检测方法说明书自建的dRVVT法和SCT法标准化比值RI/Cut–off值为LA检测阳性判断标准,对不同检测方法及两种RI/Cut–off值设定方式的临床诊断效能进行了评估。本研究中,APTT–Actin FSL法ICA参考范围RI/Cut–off值(第99百分位数)(16.2%)与文献报道一致(16.8%)[12],dRVVT和SCT方法ICA结果略低于文献报道[13],其余试验方法RI/Cut–off值未见文献报道。结果显示,以第97.5百分位数为RI/Cut–off值,dRVVT法C和NR准确度最高,为95.8%。
APTT试剂中激活剂种类、磷脂类型和浓度与LA检测的敏感度有关[11]。既往认为以硅或高凝土为激活剂的APTT试剂灵敏度高于鞣花酸,ISTH 2009明确说明应使用硅为激活剂的APTT试剂;Kumano等[14]曾报道鞣花酸具有和硅一样的LA检测敏感度。本次试验中3种APTT试剂灵敏度均<55.0%,APTT–Actin FSL的ICA敏感度与文献报道一致[15]。但二氧化硅为激活剂的APTT SS法敏感度和准确度略高于APTT–Actin法和APTT–Actin FSL法。
目前LA强弱判断暂无明确标准,一般以标准化比值1.2~1.5为弱阳性,1.5~2.0为阳性,>2.0为强阳性[6]。本研究发现,在dRVVT标准化比值<1.50的阳性样本中,APTT法敏感度均下降,两种以鞣花酸为激活剂的APTT方法的1∶1混合试验的灵敏度均<16.0%,这也是各种APTT方法1∶1混合试验总体敏感度均不高的原因。1∶1混合试验在APS和SLE疾病组中的检出率低于其他试验或组合,提示稀释效应可导致1∶1混合试验出现假阴性结果。
关于1∶1混合试验的应用指南和文献报道不一致[16,17],ISTH 2009版和BCSH 2012版指南中检测顺序为筛选试验–1∶1混合试验–确证试验;但BCSH 2012版指出因稀释效应可导致弱阳性LA检测结果出现假阴性,因此即使1∶1混合试验结果阴性,筛选试验和确证试验检测结果提示阳性时仍然判断检测结果为阳性[18]。而CLSI 2014(H60)指南建议LA检测流程为筛选–确证–1∶1混合试验,只有在筛选试验和确证试验结果难以解释时再进行1∶1混合试验。本试验结果与CLSI 2014(H60)指南说明一致。以第97.5百分位数为RI/Cut–off值,dRVVT法C和NR准确度最高;dRVVT法NR及其组合在APS中阳性率最高;dRVVT法和SCT法NR与血栓形成OR值大于其他试验方案。SCT法NR在FD、OAT和HS中阳性检出率为0,与其特异度为100%结果一致,可作为LA检测的排除试验。标准化比值的临床诊断效能优于传统三步流程。但APTT 1∶1混合试验可以有效区分APTT检测结果延长是否由于凝血因子缺乏导致,仍具有重要的临床意义。目前国内实验室1∶1混合试验的操作流程和报告方式不统一,大部分实验室未报告正常血浆结果,不利于临床进行结果解释,1∶1混合试验在LA检测中的应用仍需进一步研究和规范。
调查显示,大约1/3患者在进行LA检测时已经进行抗凝治疗[19],肝素、维生素K拮抗剂、直接凝血酶抑制剂(DTI)等抗凝治疗药物可使LA检测产生假阳性结果[20,21,22]。ISTH 2009版指南推荐患者INR<1.5时可直接检测LA,INR在1.5~3.0时则需进行1∶1混合试验以消除因子缺乏带来的影响[4]。凝血酶时间(TT)可帮助临床判断筛选试验和确证试验时间延长是否由于肝素过量或DTI所引起[23]。此外,大班蛇毒凝血时间(TSVT)和蛇静脉酶时间(ET)可作为LA的备选检测方法[24]。而部分商业化dRVVT试剂盒中含有肝素中和成分,能在一定程度上减少样本中肝素(0.8~1.0 U/ml)的影响。感染,肿瘤和药物治疗均可导致LA的一过性存在[25,26,27],治疗结束或疾病好转后,LA可恢复阴性。患者初次检测后,应在12周之后复查。此时,实验室与临床建立及时有效的沟通机制,对患者检测结果的正确解释是非常必要的。同时,在评估患者血栓风险时,需全面考虑狼疮抗凝物检测结果和其他抗磷脂抗体的结果[28,29]。



























