
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
垂体生长激素(GH)腺瘤因分泌过多的GH引起软组织过度生长、内脏器官肥大,产生心血管、代谢和呼吸等系统并发症,严重影响患者生存质量[1]。手术是首选的治疗方法,由于部分肿瘤向海绵窦生长、包绕颈内动脉或肿瘤为巨大腺瘤,使得手术难以全切除肿瘤,手术总体生化缓解率约60%[1]。一些患者即使通过手术、药物和放疗等方法,仍不能达到有效生化控制[1]。本研究回顾性总结2例垂体难治性垂体生长激素腺瘤在手术前药物治疗、手术减瘤联合药物治疗后生化控制和临床症状缓解方面的经验,报道如下。
患者女,28岁,因容貌改变5年,闭经1年半入院。患者于2004年2月产后开始出现容貌改变及手脚变粗,2007年6月第2胎产后未恢复月经,在当地医院诊治,予雌激素治疗后有少量月经,症状反复,期间无泌乳等。2009年1月头颅MRI平扫提示垂体腺瘤而到中山大学附属第一医院神经外科住院治疗。发病以来,偶有两颞顶部胀痛,能自行缓解;无明显视力变化,近几年脚增长(鞋由37码增至39码),感手指关节活动不灵活。既往无手术及外伤史,无传染病史,无高血压等病史;末次月经2008年11月;家族成员中无类似病、无遗传相关等疾病。体格检查:体温36.3 ℃、脉博78次/min、呼吸19次/min、血压98/64 mmHg(1 mmHg=0.133 kPa),全身浅表淋巴结无肿大。颈静脉无充盈,甲状腺无肿大。胸廓对称,双肺无干湿性啰音。心率78次/min,律齐,各瓣膜听诊区无病理性杂音。腹平坦,肝脾和双肾正常。肢端肥大症面容:手指脚趾粗大、鼻唇肥厚、颧骨突出、皮肤粗糙等。实验室检查:钾3.78 mmol/L、钠139 mmol/L、钙2.33 mmol/L、磷1.32 mmol/L,促肾上腺皮质激素(ACTH) 4.20 pmol/L、皮质醇(Cortisol) 1.148 μg/L、卵泡刺激素(FSH) 2.45 U/L、黄体生成素(LH) 8.34 U/L、泌乳素(PRL) 42.49 pg/L、雌二醇(E2) 0.003 ng/L、睾酮(T) 0.42 pg/L、孕酮(P) 2.35 pg/L,促甲状腺刺激激素(TSH) 1.446 mIU/L、游离T3 3.898 pmol/L、游离T4 8.401 pmol/L;甲状旁腺素全段(iPTH) 0.016 4 pg/L、甲状腺球蛋白抗体(TG-AB) 2.11 IU/L、甲状腺过氧化物酶抗体(TPO-Ab) 16.27 IU/L,总胆固醇3.6 mmol/L、甘油三酯2.19 mmol/L,OGTT后0、30、60、90及120 min的GH分别为89.1、80.1、67.6、71.3及86.2 μg/L(同期血糖水平分别为5.9、6.7 8.2、7.5和7.1 mmol/L),胰岛素样生长因子(IGF)-1 857 pg/L,糖化血红蛋白(HBA1c) 5.40%。MRI示鞍内及鞍上实性分叶状肿块影,大小约为68 mm×37 mm×35mm,侵犯海绵窦、包绕双颈内动脉并向两侧颞叶生长。由于肿瘤分叶状生长,无论经蝶窦和(或)开颅手术都难以一次手术全切除,先予术前长效生长抑素类似物Lanreotide 40 mg/2周治疗,治疗后再行手术等综合治疗。
患者男,41岁,因容貌改变10年、垂体腺瘤术后5年、胸闷1年入院。患者于10年前出现面容改变,5年前外院CT和MRI示鞍区占位性病变、血GH 31.2 μg/L,行经鼻蝶垂体瘤切除术。术后复查GH 11.2~13.6 μg/L,2011年10月开始予Octreotide-LAR 20 mg/4周治疗。近1年前出现胸闷,间有心悸和头痛,自觉症状加重而入院。既往无手术及外伤史,无传染病史等病史。家族成员中无类似病、无遗传相关等疾病。体格检查:体温36.6 ℃,脉博72次/min,呼吸18次/min,血压102/78 mmHg,全身浅表淋巴结无肿大。颈静脉无充盈,甲状腺无肿大。胸廓对称,双肺无干湿性啰音。心率72次/min,律齐,各瓣膜听诊区无病理性杂音。腹平坦,肝脾双肾正常。肢端肥大症面容:手指脚趾粗大、鼻唇肥厚、颧骨突出等。实验室检查:钾3.92 mmol/L、钠141 mmol/L、钙2.03 mmol/L、磷1.23 mmol/L, ACTH 5.23 pmol/L、Cortisol 1.042 μg/L、FSH 3.75 IU/L、LH 3.71 IM/L、PRL 2.02 pg/L、E2 0.017 pg/L、T 2.65 pg/L、P 0.10 pg/L,TSH 0.406 mIU/L、游离T3 3.784 pmol/L、游离T4 8.807 pmol/L;iPTH 0.198 pg/L、TG-AB 3.11 IU/L、TPO-Ab 6.27 IU/L,总胆固醇6.0 mmol/L、甘油三酯1.19 mmol/L、低密度脂蛋白2.28 mmol/L,HBA1c 4.10%。OGTT后0、30、60、90及120 min的GH分别为11.3、10.1、9.21、7.34及9.31 μg/L(同期血糖水平分别为5.6、6.2、7.7、7.7和6.9 mmol/L),IGF-1 803 pg/L。MRI示右颈内动脉旁、垂体窝、右侧蝶窦、筛窦肿瘤残留。诊断明确,手术预期无法全切除,患者有经蝶手术史而恐惧再次手术,先予长效生长抑素类似物Octreotide-LAR 20 mg/4周治疗。
治疗后软组织肿胀等症状明显好转,1周后GH 6.54 μg/L、IGF-1 498 μg/L,持续治疗4个月后复查MRI示肿瘤较治疗前缩小54.5%,行经蝶手术,术后4个月复查ICA周围少许肿瘤有残留,肿瘤体积为治疗前的7.6%,行γ刀治疗,术后1年半IGF-1降至正常,现术后6年,临床症状缓解,月经正常,持续GH和IGF-1监测均正常(图1)。
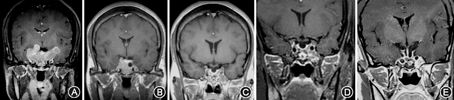

治疗后胸闷、心悸和头痛症状缓解,GH波动在4.3~8.17 μg/L、IGF-1在476~519 pg/L,持续治疗28个月后再次出现胸闷、心悸不适,超声心动图和动态心电图正常、活动平板试验阴性、多导睡眠监测正常,MRI、CT和PET-CT示垂体窝、右侧蝶窦、筛窦肿瘤残留可能,行手术减少肿瘤体积。术后继续Octreotide-LAR 20 mg/4周治疗,1个月后临床症状缓解,术后已治疗1年,持续GH和IGF-1监测在正常范围,临床症状完全缓解。
本组2例均有典型肢端肥大症病史和体征,诊断为垂体源性肢端肥大症依据充分。
例1肿瘤呈分叶状,侵犯海绵窦、包绕双侧ICA并向两侧颞叶生长,对该例选择合适的治疗方法是非常困惑的。根椐以往经验,很多医疗单位会选择开颅、分次开颅、经蝶联合开颅、放疗等综合治疗手段,可能会给患者带来更多手术创伤,疗效也难以预测。术前予Lanreotide 40 mg/2周治疗,治疗4个月后复查MRI发现肿瘤明显缩小,两颞叶方向生长的肿瘤明显向中线和鞍内方向回缩,为经蝶手术尽可能多切除肿瘤创造有利条件。患者第1次经蝶手术后,残余肿瘤体积为药物治疗前的7.6%,术后行伽马刀治疗,术后已随访6年,临床症状缓解,GH和IGF-1正常。对于手术前药物治疗能否提高手术疗效仍需更多数据支持。研究显示,术前SSA治疗虽能降低GH和IGF-1水平,缩小肿瘤体积,而对手术治愈率无影响[2,3,4],另有研究则显示,术前SSA治疗可提高手术治愈率[5]。以下情况可选择药物作为一线治疗:对于预期手术无法完全切除的大腺瘤且无肿瘤压迫症状者,不愿意接受手术以及不适合接受手术者,如明显呼吸功能障碍、心功能不全和严重代谢紊乱(包括心肌病、重度高血压和未能控制的糖尿病等),因气道问题麻醉风险较高者,术前药物治疗可以改善心肺功能以降低麻醉和手术风险[6]。
例2的MRI示右颈内动脉旁、垂体窝、右侧蝶窦、筛窦肿瘤残留,手术可能无法全切除肿瘤,患者有经蝶手术史而不愿意再次手术,GH和IGF-1升高,临床症状未缓解,予长效生长抑素类似物治疗,治疗后胸闷、心悸和头痛症状缓解,持续治疗28个月后再次出现胸闷、心悸不适,MRI、CT和PET-CT示垂体窝、右侧蝶窦、筛窦肿瘤残留可能,考虑药物不敏感,行手术减瘤后再次使用Octreotide-LAR 20 mg/4周治疗,1个月后临床症状缓解,术后已随访1年余,GH和IGF-1正常,临床症状完全缓解。Colao等[7]报道86例侵袭性腺瘤、鞍上发展的大腺瘤和微腺瘤行减瘤手术,与手术前使用生长抑素相比,减瘤手术后再次使用生长抑素后IGF-1正常化的比例明显增高;其他学者也有类似报道。因此,对于长效生长抑素类似物治疗不敏感的病例,可行手术切除部分肿瘤,以增加药物治疗的敏感性。


























