
对3种不同原理测定糖化血红蛋白(HbA1c)的结果进行比对和偏移评估。
根据美国临床和实验室标准协会(CLSI) EP9-A3文件,应用Roche Tina-quant免疫比浊法、Sebia Minicap FP毛细管电泳法和Trinity Biotech Premier Hb 9210™高效液相色谱法(HPLC)3种不同原理的检测系统分别单次测定40份线性范围内静脉血标本的HbA1c,其结果进行两两比较,绘制散点图和偏差图。并对结果进行极端学生化偏差(ESD)法离群值检验,选取最佳回归模型拟合回归方程,并计算医学决定水平处的偏移,以1/2允许总误差(Tea)为可接受标准。
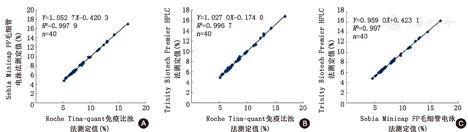
通过目测散点图及ESD法确认40份样本HbA1c检测结果具有良好的相关性,未发现离群值点。根据百分比差值偏差图、百分比差值排序偏差图、数值偏差图和排序偏差图特征选取了普通线性回归(OLR)[Roche(X)和sebia(Y1)]、加权最小二乘法(WLS)[ Roche(X)和Trinity (Y2)]以及戴明回归(Deming)[Sebia(Y1)和Trinity(Y2)]4种回归分析模型进行拟合,其回归方程分别为Y1=-0.420 3+1.052 7X,Y2=-0.174 0+1.027 0X,Y2=0.423 1+0.959 0Y1。并将HbA1c两个医学决定水平10%、16%分别代入方程中,Roche(X)和sebia(Y1)比对系统偏移为1.06%、2.61%;Roche(X)和Trinity (Y2)比对系统偏移为0.96%、1.60%;Sebia(Y1)和Trinity(Y2)比对系统偏移为0.13%、-1.47%,其偏移均小于可接受标准。
Sebia Minicap FP全自动毛细管电泳法、Trinity Biotech Premier Hb 9210™ HPLC法与Roche Tina-quant免疫比浊法3种不同方法测定HbA1c的结果具有可比性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖化血红蛋白(HbA1c)是判断糖尿病患者血糖控制效果的理想指标,2010年美国糖尿病协会将其列入糖尿病诊断标准。目前临床实验室普遍采用的糖化血红蛋白测定方法有多种,按原理可分为两大类:一类是基于糖化与非糖化血红蛋白所带电荷不同,如离子交换层析法、电泳法;另一类是基于糖化与非糖化血红蛋白的结构不同,如免疫法、亲和层析法及酶法等。在国际临床化学与医学实验室联盟(IFCC)及美国国家糖化血红蛋白标准化计划(NGSP)标准化工作推动下,糖化血红蛋白的测定方法均应以"HbA1c"或相当于"HbA1c"报告结果[1,2]。但临床应用过程中,不同仪器、不同方法以及不同实验室的检测能力不同,导致HbA1c检测结果间仍有较大差异,这也是我国暂未把HbA1c作为糖尿病诊断标准的原因之一,因此探讨不同方法间的可比性显得尤为重要。
2013年8月美国临床和实验室标准协会(CLSI)发布了EP9-A3《用患者样本进行方法学比对及偏移评估——批准指南;第三版》文件[3],相比于EP9-A2等以前的几个版本,其文件架构、实验方案、标本检测、统计方法作了很大修改,应用范围更广、可操作性更强、方案设计更科学。EP9-A3仅需40份标本随机单次测定即可,且文件同时提供OLR、WLS、Deming、Passing-Baklok 4种回归模型用于比对结果分析,实验室需先对比对结果的散点图和偏差图进行目测判断,根据方法间差值的变化特性选择适当的模型进行拟合回归方程,随后利用医学决定水平处浓度获得相应的系统偏移,用于判断结果的可比性。EP9-A3为临床实验室提供了最新的方法学比对和偏移评估指南。本研究参照EP9-A3文件,对Roche Tina-quant免疫比浊法、Sebia Minicap FP毛细管电泳法和Trinity Biotech Premier Hb 9210™高效液相色谱法(HPLC)HbA1c检测结果进行了系统间的方法比对和偏移评估,供同行参考。
收集广东省中医院住院及门诊患者乙二胺四乙酸二钾盐(EDTA-K2)抗凝新鲜全血,采样后4 ℃保存(≤5 d)。如果需要保存更久,则将样本分装保存于-80 ℃,可在4 ℃条件下冻融,24 h内完成检测。其HbA1c浓度在测量线性范围内均匀分布,不同浓度所占比例符合EP9-A3文件要求。
日立7180生化分析仪及Roche Tina-quant HbA1c试剂(批号:603946-01)、校准品(批号:180036)和质控品(Level 1:180038;Level 2:181189);Sebia Minicap FP毛细管电泳仪及原装配套试剂(溶血素批号:02094/80,缓冲液批号:22074/80)、校准品(批号:04093/01、05093/01)和质控品(Level 1:27063/01;Level 2:28063/01);Trinity Biotech Premier Hb 9210™分析仪及原装配套试剂(批号:5014)、校准品(批号:5220 )和质控品(Level 1:5531;Level 2:5532)。
(1)本实验室现有的日立7180生化分析仪、Roche Tina-quant HbA1c免疫比浊法测定HbA1c的系统(X)为参比系统,新引进的专用HbA1c测定系统Sebia Minicap FP毛细管电泳法系统(Y1)和Trinity Biotech Premier Hb 9210™系统(Y2)为待评系统。(2)新引进Sebia Minicap FP毛细管电泳法系统(Y1)和Trinity Biotech Premier Hb 9210™系统(Y2)进行比对分析。因此本研究建立的3个比对系统分别为Roche(X)与sebia(Y1),Roche(X)与Trinity (Y2),Sebia(Y1)与Trinity(Y2)。
按照CLSI EP9-A3文件要求,各检测系统分别随机测定40份糖化血红蛋白样本,每份样本每种方法单次测定,并记录测定结果。测定之前对仪器进行校准,室内质控结果在控。如有离群值标本,则排除该标本并补充相应浓度标本测定。
按照EP9-A3文件要求及文献[4]内容中描述的广义极端学生化偏差(ESD)方法对测定结果进行离群值检查。
绘制偏差图、散点图,根据分析方法间散点图和偏差图所呈现的潜在特征,选择最佳回归模型(OLR、WLS、Deming、Passing-Baklok)对各比对系统结果进行拟合分析,并计算医学决定水平处的偏移,以≤1/2 Tea(± 4%)(国家临床检验中心室间质评允许总误差)为可接受标准。
采用Microsoft Excel 2007、SPSS 17.0和MedCalc软件分析数据。计量数据以 ±s表示,各比对系统回归和偏移分析选取最佳回归模型进行计算,显著性检验采用t检验,P<0.05为差异有统计学意义。
±s表示,各比对系统回归和偏移分析选取最佳回归模型进行计算,显著性检验采用t检验,P<0.05为差异有统计学意义。
由散点图(图1)可见,3种方法40份样本HbA1c检测结果具有良好的相关性,目测无离群值。

根据EP9-A3中描述的ESD法进行离群值定量检验,具体步骤按照EP9-A3文件及文献[4]内容中所述进行,未发现离群值点,结果见表1。
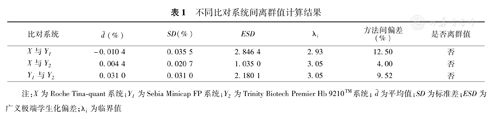
不同比对系统间离群值计算结果
不同比对系统间离群值计算结果
| 比对系统 | d-(%) | SD(%) | ESD | λi | 方法间偏差(%) | 是否离群值 |
|---|---|---|---|---|---|---|
| X与Y1 | -0.010 4 | 0.035 5 | 2.846 4 | 2.93 | 12.50 | 否 |
| X与Y2 | 0.004 4 | 0.020 7 | 1.035 0 | 3.05 | 4.00 | 否 |
| Y1与Y2 | 0.031 0 | 0.031 0 | 2.180 1 | 3.05 | 9.52 | 否 |
注:X为Roche Tina-quant系统;Y1为Sebia Minicap FP系统;Y2为Trinity Biotech Premier Hb 9210™系统;d-为平均值;SD为标准差;ESD为广义极端学生化偏差;λi为临界值
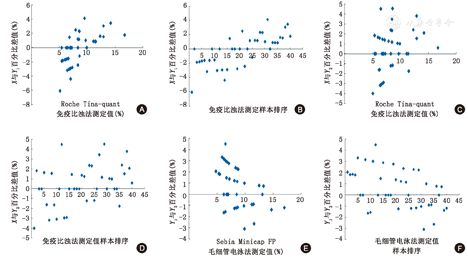
参照EP9-A3文件对无离群值的40份血清样本HbA1c结果绘制百分比差值偏差图、百分比差值排序偏差图(图2)、数值偏差图和排序偏差图等。Roche Tina-quant免疫比浊法与Sebia Minicap FP毛细管电泳法比较(图2A,图2B),测定结果总体呈现线性变化趋势,故选择OLR回归分析模型进行拟合;Roche Tina-quant免疫比浊法与Trinity Biotech Premier Hb 9210™ HPLC法比较(图2C,图2D)测定结果总体呈现恒定变化,故选择WLS模型进行拟合;Sebia Minicap FP毛细管电泳法与Trinity Biotech Premier Hb 9210™ HPLC法比较(图2E,图2F),除低浓度波动较大外,总体具有恒定变化,故选择Deming模型进行拟合。

EP9-A3提供了OLR、WLS、Deming、Passing-Baklok 4种模型进行回归分析,根据3种方法测定结果数值变化特征,选取最佳回归模型进行拟合,将HbA1c两个医学决定水平10%、16%分别代入选取的最佳回归模型拟合方程,其偏移均小于可接受标准(表2)。
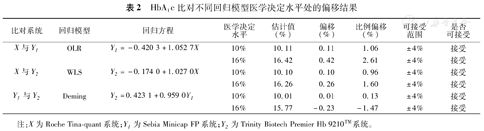
HbA1c比对不同回归模型医学决定水平处的偏移结果
HbA1c比对不同回归模型医学决定水平处的偏移结果
| 比对系统 | 回归模型 | 回归方程 | 医学决定水平 | 估计值(%) | 偏移(%) | 比例偏移(%) | 可接受范围 | 是否可接受 |
|---|---|---|---|---|---|---|---|---|
| X与Y1 | OLR | Y1=-0.420 3+1.052 7X | 10% | 10.11 | 0.11 | 1.06 | ±4% | 接受 |
| 16% | 16.42 | 0.42 | 2.61 | ±4% | 接受 | |||
| X与Y2 | WLS | Y2=-0.174 0+1.027 0X | 10% | 10.10 | 0.10 | 0.96 | ±4% | 接受 |
| 16% | 16.26 | 0.26 | 1.60 | ±4% | 接受 | |||
| Y1与Y2 | Deming | Y2=0.423 1+0.959 0Y1 | 10% | 10.01 | 0.01 | 0.13 | ±4% | 接受 |
| 16% | 15.77 | -0.23 | -1.47 | ±4% | 接受 |
注:X为Roche Tina-quant系统;Y1为Sebia Minicap FP系统;Y2为Trinity Biotech Premier Hb 9210™系统。
近年来,HbA1c在糖尿病的筛查、诊断和治疗中发挥着极为重要的作用,同时也对糖尿病慢性并发症、心血管疾病、视网膜病变、肾损伤、白内障、妊娠糖尿病等疾病的诊断具有非常重要的意义[5,6]。
本研究参考CLSI EP9-A3文件对本实验室检测HbA1c的3种方法进行比较分析。EP9-A3提供测定结果方法间拟合比较的4种回归模型,不同模型有其适用性,研究者可先根据散点图和偏差图进行目测分析,并以方法间测定结果差值的变化特性选取最佳回归模型进行拟合,通过计算获得医学决定水平处的系统偏移[7]。因工作和课题研究需要,实验室在原用日立7180生化分析仪、Roche Tina-quant HbA1c免疫比浊法测定HbA1c的系统基础上,新引进两台不同方法的专用HbA1c测定系统,即Sebia Minicap FP毛细管电泳法系统和Trinity Biotech Premier Hb 9210™ HPLC系统。因本实验室为ISO15189认可实验室,根据ISO15189:2012技术要素及实验室管理办法等检验结果可比性要求,实验室使用两套及以上检测系统检测同一项目时,应有比对数据表明其检测结果的一致性。由于Roche Tina-quant HbA1c免疫比浊法在实验室已经使用较长时间,其室间质评成绩优秀,不精密度<2%,可作为参比系统,新引进仪器先与其进行比对分析。另本实验室建立的3种不同HbA1c测定方法均通过美国糖化血红蛋白标准化计划(NGSP)认证,理论上,每种方法均具有较好的特异性和准确性,所以在实验设计时,新引进的两种方法之间亦进行了比对分析。按照CLSI EP9-A3文件要求绘制了3种方法间测定结果的散点图,目测显示无明显离群值点,再用ESD法确认。进一步分析方法间百分比差值偏差图、百分比差值排序偏差图,数值偏差图和排序偏差图的变化特征,发现Roche Tina-quant免疫比浊法与Sebia Minicap FP毛细管电泳法测定结果呈现线性变化趋势,Roche Tina-quant免疫比浊法与Trinity Biotech Premier Hb9210™ HPLC法比较时测定结果总体呈现恒定SD变化,而Sebia Minicap FP毛细管电泳法与Trinity Biotech Premier Hb9210™ HPLC法比较除低浓度波动较大外,总体具有恒定SD变化。因此本研究对上述3种方法间的比较分析分别选取了OLR、WLS以及Deming回归分析模型进行拟合。将HbA1c两个医学决定水平10%、16%分别代入回归方程中,结果显示,其偏移均小于可接受标准,表明3种方法HbA1c测定相关性和一致性较好,结果具有可比性,均能满足临床需求。
糖化血红蛋白测定方法众多,不同方法会受到一些干扰因素如血红蛋白病、衍生血红蛋白、红细胞生存周期的异常及药物等影响。实验室应知晓某些患者可能需要用某种特异的HbA1c测定方法。基于日常工作和课题研究需要,本实验室选择的3种测定方法亦各有优缺点,NGSP网页含有更新的血红蛋白变异体对不同方法干扰信息,临床和实验室人员可随时查阅。检验人员应掌握测定方法对于各种变异体检测的局限性以及引起HbA1c假性升高或降低的因素,并在报告中为医生作出提示。我国南方为地中海贫血和血红蛋白病高发地区,应尽量避免选择基于电荷差异的离子交换HPLC法,若已使用此法,在发出报告前须仔细检查色谱图,以避免发出不准确的结果误导临床[6]。同时,实验室在准备使用一个新的方法测定临床样品前,应对方法的分析性能进行验证[8];工作中,加强室内质控和室间质评工作,并定期进行方法间结果比对和偏移评估分析,保证检验质量。



























