
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
库欣综合征(Cushing syndrome, CS)又称皮质醇增多症,是由各种病因导致的高皮质醇血症,作用于靶器官,引起的以向心性肥胖、高血压、糖代谢异常、低钾血症和骨质疏松为典型表现的一种综合征。据国外文献报道,CS的年发病率为2~3/106,其患病率约40/106[1,2]。从病因上分类,CS可以分为促肾上腺皮质激素(ACTH)依赖性和ACTH非依赖性,前者包括垂体分泌ACTH的腺瘤和异位分泌ACTH的肿瘤,占病因的70%~80%;后者是肾上腺肿瘤(腺瘤和腺癌)或增生自主地分泌过量皮质醇所致,占病因的20%~30%。而垂体性CS,又称为库欣病(Cushing's disease, CD),是CS中最常见的病因,占患者总数的70%左右。
虽然CS罕见,但其病情复杂。除了会直接影响糖、脂肪、蛋白质、水电解质等各种物质代谢的平衡,还会影响全身多个系统脏器功能,使机体免疫力下降。如果未得到及时诊治则预后差,严重的低血钾、重症感染及心脑血管并发症可以危及患者生命。库欣病多数为散发,90%是垂体微腺瘤,肿瘤多<5 mm,但有向周边垂体组织浸润的倾向,约10%为大腺瘤。在CS的病因诊断中,库欣病及异位ACTH综合征由于临床表现接近,实验室检查指标有较多重叠和交叉,鉴别诊断尤其困难。半个世纪以来,中国库欣病的诊断和治疗已经获得长足进步。随着经鼻蝶窦入路垂体腺瘤探查手术普及和推广,其疗效已达到或接近国际先进水平,在辅助治疗的放射治疗和药物治疗也积累了丰富经验。然而,库欣病治疗后的缓解率低于其他类型的功能性垂体腺瘤,而且易复发的特点使得该病治疗仍是一个世界性的难题,故本协作组制定该病的专家共识,以规范库欣病的诊疗。
疑诊CS的筛查试验:(1)24 h尿游离皮质醇(UFC):24 h UFC测定的是游离皮质醇,故不受皮质醇结合球蛋白(CBG)的浓度影响,超过正常上限判断为阳性,诊断CS的敏感性可达到91%~96%[3],但至少测定2次。饮水过多(≥5 L/d)、任何增加皮质醇分泌的生理或病理应激状态都会使UFC升高而出现假阳性结果;在中、重度肾功能不全患者,GFR<60 ml/min时可出现UFC明显降低的假阴性结果[4]。目前,采用最多的放射免疫分析(RIA)和化学发光法测定UFC,可受皮质醇代谢产物和合成的糖皮质激素交叉反应的影响;而基于分子结构的高效液相色谱串联质谱分析法(LC-MS/MS)则可避免上述问题,但会受某些药物(如卡马西平和非诺贝特)干扰测定而使结果假性升高;应用LC-MS/MS测定尿皮质醇浓度较RIA法测定低40%[5]。(2)午夜血清/唾液皮质醇测定:人体皮质醇分泌呈现明显的昼夜节律,血皮质醇水平在午夜达最低值。CS患者血清午夜血皮质醇低谷会消失。如进行午夜血清皮质醇测定,应尽量保证采血时处于睡眠状态。诊断CS的午夜血清皮质醇值≥50 nmol/L(1.8 μg/dl),敏感性达100%,但特异性仅20%[6]。清醒状态下血清皮质醇值≥207 nmol/L (7.5 μg/dl),诊断的敏感性>96%,特异性87%[7]。唾液中皮质醇呈游离状态,其浓度与血中游离皮质醇浓度平行。各国文献报道,测定午夜唾液皮质醇用于诊断CS的敏感性为92%~100%,特异性为93%~100%[8,9]。抑郁症、酗酒、肥胖和糖尿病患者的HPA轴活性增强,而地塞米松抑制试验(DST)较单次测定血、唾液或尿皮质醇更有意义。(3) 1 mg过夜地塞米松抑制试验(ODST):午夜11~12点口服地塞米松1 mg,次日晨8:00采集服药后血皮质醇标本。服药后血清皮质醇值≥50 nmol/L (1.8 μg/dl)为不抑制,诊断CS的敏感性>95%、特异性约80%[10];若提高切点至140 nmol/L (5 μg/dl),其敏感性为91%,特异性可提高至>95%,但敏感性降低[7]。需注意患者对地塞米松的吸收和代谢率不同可影响DST的结果;部分药物如苯巴比妥、卡马西平和利福平等可通过诱导CYP3A4加速清除地塞米松而导致假阳性;而肝、肾功能衰竭患者的地塞米松清除率降低可以导致假阴性。(4)经典小剂量DST(LDDST,2 mg/d×48 h):检查前留24 h UFC或者清晨血皮质醇作为对照,之后开始起口服地塞米松0.5 mg,每6 h1次,连续2 d,在服药的第2天再留24 h UFC水平或服药2 d后测定清晨血皮质醇水平,若UFC未能下降到正常值下限以下或服药后血皮质醇≥50 nmol/L(1.8 μg/dl),为经典小剂量DST不被抑制。两者的敏感性和特异性相差不大,均可达到敏感性>95%[11]。
如2项以上检查异常,则高度怀疑CS,需要进行下一步定位检查。
包括血ACTH的测定和大剂量DST。
清晨8点采血,因ACTH的半衰期很短,取血后需要将血标本冰浴,并尽快低温离心测定。通常认为,如血ACTH <2.2 pmol/L(10 pg/ml),则考虑ACTH非依赖性CS,如ACTH>4.4 pmol/L(20 pg/ml),则考虑为ACTH依赖性CS[12]。
检查前留24 h UFC或血皮质醇作为对照,之后口服地塞米松2.0 mg,q6 h,连续2 d,在服药的第2天再留24 h UFC或服药2 d后测定清晨血皮质醇,若UFC或者血皮质醇下降到对照值的50%以下为经典大剂量DST被抑制,支持库欣病的诊断。该试验鉴别库欣病与异位ACTH综合征的敏感性为60%~80%,特异性80%~90%[13]。
库欣病是垂体分泌ACTH的腺瘤所致,影像学检查主要的目的是发现并定位垂体腺瘤。磁共振成像(MRI)是诊断垂体腺瘤的首选方法。正电子发射断层/计算机断层(PET/CT)可能在微小病灶的检出和残存、复发病灶的判断方面具有独特的价值。
库欣病多为垂体微腺瘤,常需要进行鞍区动态增强MRI,以提高肿瘤检出率。在动态增强中,微腺瘤的强化慢于且弱于正常垂体,因此在增强早期可形成较好的对比。垂体微腺瘤的间接征象包括:垂体形态不对称、信号不均、垂体柄偏移、鞍底倾斜凹陷等。当鞍区动态增强MRI检查阴性时,要考虑到肿瘤极其微小,未达到目前MRI的空间分辨率的可能。因此,进一步可行双侧岩下窦静脉取血明确诊断。同时,还应考虑异位ACTH综合征的可能,可能全身其他部位。故还需要进一步行胸部CT、腹盆部CT检查等。
ACTH依赖性CS如临床、生化、影像学检查结果不一致或难以鉴别病因时,建议行BIPSS以鉴别ACTH来源。BIPSS是有创性血管内介入检查,建议在经验丰富的医疗中心进行。经股静脉插管至双侧岩下窦后,可应用数字减影血管成像术证实插管位置是否正确和岩下窦解剖结构是否正常。岩下窦(inferior petrosal sinus, IPS)与外周(Peripheral, P)血浆ACTH比值在基线状态≥2和(或)DDAVP刺激后≥3则提示库欣病。BIPSS应在患者皮质醇水平升高提示肿瘤活跃分泌ACTH时进行检查,避免在周期性库欣静止期进行。技术因素的影响和静脉回流的异常可导致库欣病患者出现假阴性结果。在经验丰富的医疗中心,BIPSS诊断库欣病的敏感性为95%~99%,特异性为95%~100%[14,15],术后严重并发症如深静脉血栓、肺栓塞、蛛网膜下腔出血等少见。CRH国内尚无生产,国外产品价格昂贵,采用BIPSS联合DDAVP刺激试验具有很好的可行性,是确诊库欣病的金指标,但对垂体微腺瘤的左右侧定位意义有限。
18F-FDG PET/CT检查时正常垂体位于本底较低的鞍区,正常垂体组织对18F-FDG的摄取较低,而垂体腺瘤对18F-FDG的摄取高于周围组织。所以尽管PET/CT的空间分辨率有限(2~6 mm),18F-FDG PET/CT仍可能发现CT、MRI难以检出的垂体微腺瘤。因此,在怀疑库欣病而其他检查无阳性发现或不确定时,或在术后复发而CT、MRI很难与术后改变区分时,可选用18F-FDG PET/CT显像[16]。
生长抑素受体(SSTR)是位于细胞膜表面的G蛋白耦联受体,有5种亚型,分别是SSTR1、SSTR2、SSTR3、SSTR4、SSTR5。人工合成的生长抑素类似物(SSAs),如奥曲肽(octreotide)等,性质与SST类似,能与分布于全身的肿瘤和非肿瘤部位的SSTR特异性结合。而异位分泌ACTH的神经内分泌肿瘤组织高度表达SSTR2,将放射性核素标记的奥曲肽引入体内,能与肿瘤细胞表面的SSTR2特异性、高亲和力结合,使异位肿瘤显像。以99mTc-TOC为示踪剂的单光子发射计算机断层(SPECT)显像对于寻找异位ACTH综合征的病灶具有一定的价值,但敏感性较低,仅为49%[17]。需要与其他影像学检查进行病灶的定位。
治疗原发病、降低皮质醇水平、缓解临床症状体征、治疗相关系统的并发症、保护垂体功能、提高生活质量。
(1)手术入路的选择:库欣病多为微腺瘤,根据肿瘤的大小、质地、生长方式等选择经蝶窦入路或经颅入路。侵袭性垂体腺瘤常向鞍外、鞍旁生长,传统经蝶窦入路显露不够充分。近年来神经内镜技术的进步,尤其是成角镜头的运用,对侵犯海绵窦及鞍旁结构的垂体腺瘤有较好的显露,提高了肿瘤的切除率。(2)手术并发症:①垂体前叶功能减退:术后8.6%~53%的患者出现至少一类垂体前叶激素不足,大多数患者可在术后6~18个月内恢复;②尿崩症:9%~23.5%的患者为短暂性,而5%~5.9%为持续性[18,19];③脑脊液漏:术中或术后都可观察到脑脊液漏,发生于1.3%~3.9%的患者[20,21,22],可采取术中脂肪组织修补或术后腰椎置管引流脑脊液治疗。如果上述治疗无效,则需要再次行修补手术治疗;④脑膜炎多见于合并脑脊液漏的患者,其发生率为0.8%~3.1%[20,21,22,23];⑤血栓:由于库欣病患者肥胖且高皮质醇血症,容易出现高凝状态导致血栓形成。0.4%~7.5%的患者发生深静脉血栓或肺栓塞[22,23,24,25]。(3)术后疗效判断:库欣病经蝶窦入路手术早期术后缓解率为65%~98%,长期随访中肿瘤复发率为2%~35%[26]。对于首次治疗未缓解的患者,再次手术能够使37%~61%的患者达到缓解[27],但可能增加脑脊液漏及垂体功能低下的风险。患者随访0.3~37年后发现7%~34%出现肿瘤复发,复发部位常位于原发部位或相邻部位[26]。术后1周内清晨血清皮质醇测定是目前公认的用于评估疗效的指标[28,29]。目前多数学者认为,血清皮质醇水平低于140 nmol/L(5 μg/dl)者为缓解[30]。24 h的UFC可作为辅助评估工具,其低于28~55 nmol/L(10~20 μg)/24 h提示缓解,24 h UFC高于276 nmol/L(100 μg/24 h)则提示肿瘤残存[30]。(4)围手术期糖皮质激素替代:术前、术中不需要使用糖皮质激素。术后3 d内监测清晨血清皮质醇。如果血清皮质醇在<55 nmol/L(2 μg/dl)时,需立即补充糖皮质激素直到下丘脑-垂体-肾上腺轴功能恢复为止;如果血清皮质醇在55~276 nmol/L(2~10 μg/dl)时,患者出现血压下降,不明原因发热、低钠血症等肾上腺皮质功能减退表现,尽可能先抽血留取皮质醇、ACTH血样标本后,补充糖皮质激素,建议给予静脉输注氢化泼尼松100~200 mg,症状缓解后可开始常规口服糖皮质激素替代治疗;如血清皮质醇>276 nmol/L(10 μg/dl),根据患者是否出现肾上腺皮质功能减退症状来决定是否补充[31]。
术后鞍区正常解剖结构紊乱,术野内瘢痕形成,不易分辨肿瘤和垂体组织,给再次经蝶窦入路手术带来困难。手术过程中鞍底位置判断困难时,可借助术中X线监测、神经导航、术中MRI等手段寻找鞍底,对侵袭海绵窦的肿瘤术中超声对识别颈内动脉有参考价值。对于临床症状和内分泌检查均支持肿瘤复发,但MRI阴性者,需根据术者经验和手术条件做出综合判断,决定是否进行垂体探查术;术中发现明确肿瘤者,应行肿瘤切除加瘤周垂体大部分切除;如果术中未能见到明确肿瘤,可根据BIPSS结果对ACTH优势侧进行垂体大部分切除;若BIPSS未提示ACTH优势侧,可行初次肿瘤侧垂体大部分切除。经蝶窦入路垂体腺瘤切除加瘤周垂体组织切除是治疗复发性库欣病的首选方法。
放射治疗通常不作为库欣病的首选治疗方法。对术后完全缓解的患者不推荐预防性放疗,但对术后病理为"不典型垂体腺瘤"的患者建议术后放疗以减少复发机会。适应证:手术残留和(或)复发的库欣病;不适宜和(或)不接受手术的垂体微腺瘤患者;复发的侵袭性、垂体癌的辅助治疗;Nelson综合征。(1)常规放射治疗:库欣病分次放疗可以选用常规照射技术、三维适形放疗技术及调强放疗技术。随着放疗技术的进步,推荐采用三维适形放疗技术或调强放疗技术进行精确放疗。以MRI和CT图像融合确定照射区及周围可能累及器官,精准评估剂量分布。照射总剂量建议45~50 Gy,常规分割20~25次。常规分次放疗库欣病起效缓慢,起效时间一般为6个月~2年,生化缓解率42%~83%,肿瘤控制(影像学上肿瘤体积稳定或缩小)率93%~100%[20,32]。最常见并发症为垂体前叶功能低下,发生率约为19%~25%,少见的并发症为视路损伤,约0.8%[33,34]。(2)伽玛刀放射外科(GKS):GKS控制垂体腺瘤生长的边缘处方剂量12~16 Gy;达到生化指标缓解的处方剂量18~35 Gy。建议采用平均25 Gy的周边剂量。生化缓解率40%~80%,肿瘤控制率91%~100%,平均缓解时间为10~25个月[35,36,37]。并发症:垂体前叶功能低下最常见,发生率为23%~31.5%,发生高峰为治疗后的4~8年[38,39,40];视神经和海绵窦内颅神经的损伤比例为4%~5.2%[40,41]。
国内治疗库欣病的有效药物不多,临床证据多数来源于小样本、回顾性、单中心研究,总体疗效不佳,因此药物治疗处于辅助地位,适应证为:不适合手术、已经接受了放疗但尚未起效的患者,且一般情况不适宜行双侧肾上腺切除者;严重高皮质醇血症、出现急性精神病、高血压、严重感染等情况时需要及时降低皮质醇水平,为进一步手术创造机会的患者。可以用于库欣病治疗的药物特点见表1。
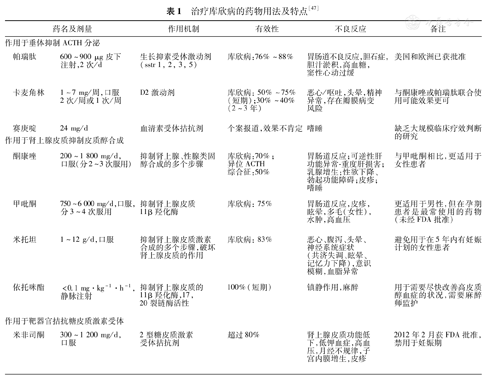
治疗库欣病的药物用法及特点[47]
治疗库欣病的药物用法及特点[47]
| 药名及剂量 | 作用机制 | 有效性 | 不良反应 | 备注 | ||
|---|---|---|---|---|---|---|
| 作用于垂体抑制ACTH分泌 | ||||||
| 帕瑞肽 | 600~900 μg皮下注射,2次/d | 生长抑素受体激动剂(sstr 1, 2, 3, 5) | 库欣病:76%~88% | 胃肠道不良反应,胆石症,胆汁淤积,高血糖,窦性心动过缓 | 美国和欧洲已获批准 | |
| 卡麦角林 | 1~7 mg/周,口服2次/周或1次/周 | D2激动剂 | 库欣病:50%~75%(短期);30%~40%(2~3年) | 恶心/呕吐,头晕,精神异常,存在瓣膜病变风险 | 与酮康唑或帕瑞肽联合使用可能效果更可 | |
| 赛庚啶 | 24 mg/d | 血清素受体拮抗剂 | 个案报道,效果不肯定 | 嗜睡 | 缺乏大规模临床疗效判断的研究 | |
| 作用于肾上腺皮质抑制皮质醇合成 | ||||||
| 酮康唑 | 200~1 800 mg/d,口服(分2~3次服用) | 抑制肾上腺、性腺类固醇合成的多个步骤 | 库欣病:70%;异位ACTH综合征:50% | 胃肠道反应;可逆性肝功能异常-重度肝损害;乳腺增生;性欲下降、勃起功能障碍;皮疹;嗜睡 | 与甲吡酮相比,更适用于女性患者 | |
| 甲吡酮 | 750~6 000 mg/d,口服,分3~4次服用 | 抑制肾上腺皮质11β羟化酶 | 库欣病:75% | 胃肠道反应,皮疹,眩晕,多毛(女性),水肿,高血压 | 更适用于男性,但在孕期患者是最常使用的药物(未经FDA批准) | |
| 米托坦 | 1~12 g/d,口服 | 抑制肾上腺皮质激素合成的多个步骤,破坏肾上腺皮质的作用 | 库欣病:83% | 恶心、腹泻、头晕、神经系统症状(共济失调、眩晕、记忆力下降),意识模糊,血脂异常 | 避免用于在5年内有妊娠计划的女性患者 | |
| 依托咪酯 | <0.1 mg·kg-1·h-1,静脉注射 | 抑制肾上腺皮质的11β羟化酶,17,20裂链酶活性 | 100%(短期) | 镇静作用,麻醉 | 用于需要尽快改善高皮质醇血症的状况,需要麻醉师监护 | |
| 作用于靶器官拮抗糖皮质激素受体 | ||||||
| 米非司酮 | 300~1 200 mg/d,口服 | 2型糖皮质激素受体拮抗剂 | 超过80% | 肾上腺皮质功能低下,低钾血症,高血压,月经不规律,子宫内膜增生,皮疹 | 2012年2月获FDA批准,禁用于妊娠期 | |
其原理是切除ACTH的靶器官从而有效缓解高皮质醇血症。但患者必须终身服用激素替代治疗,并且在某些应激状态下可能导致肾上腺皮质危象。双侧肾上腺切除后,缺乏皮质醇对下丘脑的负反馈作用,致使垂体肿瘤生长,增大的肿瘤压迫垂体导致垂体功能减退及ACTH分泌增多而出现皮肤色素沉着等症状称为Nelson综合征,发生率为21%(0~47%)[42]。双侧肾上腺切除后宜严密监测血浆ACTH水平和垂体MRI,如影像学发现垂体肿瘤则应手术切除或放射治疗。
库欣病患者治疗后(无论是手术、放疗或者药物治疗)均需密切随访,治疗后随访分为短期随访(1个月内)和长期随访。短期随访内容包括高皮质醇血症状态的缓解情况,以及评估是否出现水电解质紊乱、感染、血栓风险以及手术相关并发症等。而长期随访应规律的评估病情的缓解情况(包括皮质醇水平、鞍区肿瘤的缓解和可能的复发)、垂体前叶其他轴系功能、血压、血脂、血糖、低钾血症和骨质疏松等并发症的改善和治疗情况。所有的库欣病患者接受治疗前后均需进行健康宣教,使其了解长期随访对提高生活质量的重要性。
近期随访:除了术后1周内要检测血ACTH和F水平以评估手术治疗的效果外,库欣病患者的高凝和免疫抑制状态需要术后更密切的观察血栓栓塞和感染相关表现以期尽早诊断和治疗。
长期随访:术后1、3、6个月及1年以及此后每年需要长期随访,密切观察CS相关临床表现的缓解和复发情况、检测血尿皮质醇、必要时行地塞米松抑制试验评估病情;垂体增强MRI的随访监测肿瘤是否复发;监测垂体前叶GH/IGF-1轴、PRL、性腺轴、甲状腺轴等功能,必要时给予替代治疗。监测血压、血糖(必要时行口服糖耐量试验)、低钾血症和骨质疏松等相关并发症的改善和治疗情况。如患者随访计划外出现可疑复发的临床表现需及时复诊。
库欣病在病理学形态上可分为致密颗粒型与稀疏颗粒型。致密颗粒型库欣病肿瘤细胞呈片状生长,由单一的圆形细胞构成,常沿血管周围分布,细胞内见丰富的PAS阳性的胞质。稀疏颗粒型库欣病细胞胞质较少,呈嫌色性到弱PAS阳性。诊断库欣病需要做ACTH免疫组化染色,通常致密颗粒型库欣病细胞ACTH免疫组化染色呈弥漫强阳性表达,稀疏颗粒型库欣病呈弱阳性表达。不典型腺瘤指核分裂活性高和(或)Ki-67标记指数高的垂体腺瘤。一般良性腺瘤很难找到核分裂,而不典型腺瘤可以找到或>2个/10倍高倍视野,Ki-67指数>3%。
仅占CS的3.4%[43],儿童CS患者,在10岁前男性多见,而10岁后女性多见。和成人CS常见病因为库欣病不同,儿童CS患者的病因有随年龄分布的特点。继发于McCune-Albright综合征的儿童CS平均起病年龄1.2岁,肾上腺皮质肿瘤的平均起病年龄为4.5岁,异位ACTH综合征患儿其平均起病年龄在10.1岁,而库欣病的平均起病年龄则约14岁[44]。此外,和成人CS不同,儿童CS还有生长发育停滞的独特表现。儿童CS的诊断也分为定性和定位诊断两方面,但与成人不同,其用药剂量和诊断标准需根据儿童的特点加以修正。正常儿童24 h UFC <193 nmol/L(70 μg/m2)[45],午夜皮质醇<50 nmol/L(1.8 μg/dl)[44]。进行LDDST时,若患者体重<40 kg,则予地塞米松30 μg·kg-1·d-1[44]。进行HDDST时,若患者体重<40 kg,则予地塞米松120 μg·kg-1·d-1;如患者体重≥40 kg,则按照成人标准给予地塞米松[46]。经蝶窦入路手术是儿童库欣病的首选疗法,且手术中需顾虑垂体前叶受损的问题,所以手术缓解率低于成年人,仅约60%。放射治疗为二线治疗方案,约需1年方能达到最大疗效,其缓解率高于成人,约80%~92%,但垂体前叶功能减退较多见[47]。
(1)基础疾病的控制和妊娠适应性的调整:库欣病经过治疗病情缓解后如有生育要求,需进行以下预处理,方能备孕:控制皮质醇水平在合理状态;纠正高皮质醇血症所致的糖代谢、脂代谢和电解质代谢紊乱。(2)女性低促性腺激素者促排卵:在上述问题得到纠正,经内分泌评估后处于适宜怀孕的状态时,可开始促生育治疗。如患者出现低促性腺激素性闭经可用外源性促性腺激素(Gn)促排卵。不育治疗时,可采用人绝经后尿促性腺激素(HMG)促进卵泡成熟后,以人绒毛膜促性素(hCG)诱发排卵。(3)低促性腺激素性闭经的处理:雌激素对女性的代谢和衰老的调控十分重要,尤其是对于年轻女性来说是不可或缺的。对于低促性腺激素性闭经的患者,在库欣病情缓解后可给予雌孕激素补充治疗。对于年轻患者来说以雌孕激素序贯治疗为宜,可恢复月经,维持骨骼、心血管和神经系统健康。(4)男性库欣病患者的不育的相关治疗:对于低促性腺功能减退的患者,在库欣病情缓解后睾酮水平仍不能恢复正常,应该同时进行雄激素补充治疗以恢复和保持男性第二性征或用促性腺激素治疗恢复生育功能。
《中国库欣病诊治专家共识(2015年)》编写组成员名单(按姓氏笔画排名):王卫庆、王任直、邓成艳、毛志钢、邓侃、王海军、卞留贯、王镛斐、宁光、叶红英、冯逢、冯铭、卢琳、包新杰、刘小海、刘阿力、刘志雄、孙青芳、任祖渊、朱惠娟、朱朝晖、李士其、张少玲、余叶蓉、陆召麟、连伟、严励、连欣、陈适、李桂林、李益明、张晓波、吴哲褒、吴群、幸兵、郁琦、姚勇、贾旺、徐淑军、耿道颖、梁智勇、雷霆、蔡博文、潘力。

























