
建立骨骼肌卫星细胞(SMSC)的体外分离、原代培养、鉴定方法,观察细胞的成肌分化特点。
采用组织块法结合差速贴壁法获得SMSC。采用免疫荧光和流式细胞仪以Pax7为标志物鉴定分离获得的卫星细胞纯度,用分化培养基诱导SMSC的体外分化,实时定量PCR法检测分化标志基因成肌决定因子(MyoD)和生肌素的mRNA相对表达量。
组织块法培养约1周,可见细胞从组织块边缘爬出。经差速贴壁法纯化后,流式细胞仪检测所获得的原代SMSC纯度可达97.6%。细胞体外诱导分化后,MyoD和生肌素基因呈时序性表达。
组织块法可成功获得高纯度的SMSC,在体外具有良好的分化能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨骼肌卫星细胞(skeletal muscle satellite cell,SMSC)是骨骼肌中具有一定自我更新能力的肌源性干细胞,最早由Mauro[1]在1961年通过电镜于蛙胫骨前肌细胞表面发现,通常以静息状态存在于肌纤维的肌膜和基底膜之间[2]。与成熟的肌细胞为多核不同的是,SMSC是单核细胞。在特定的条件下,如锻炼、创伤、烧伤等时,SMSC可以被激活开始分裂、增殖、分化并迁移到受损组织处,彼此相互融合或者与原有肌纤维融合,形成肌纤维参与骨骼肌的修复[3]。由于SMSC在骨骼肌细胞中含量很低,因此如何在体外获得足够数量、高纯度、具有良好分化能力的SMSC,对于开展后续的临床应用、功能机制研究就显得十分重要。
清洁级Wistar大鼠,体重约170~190 g,5~6周龄,由中国医学科学院实验动物研究所提供。大鼠购进后在本单位动物中心饲养1周。
高糖DMEM培养基(美国Hyclone公司);胎牛血清、马血清、0.25%胰蛋白酶、鸡胚提取物(CEE)、青链霉素购自(美国Gibco公司);兔抗大鼠Pax7多克隆抗体、别藻青蛋白(APC)标记的羊抗兔IgG二抗(美国Abcam公司);山羊抗兔IgG免疫荧光异硫氰酸荧光素(FITC)试剂盒(南京碧云天生物技术研究所);磷酸缓冲盐溶液(PBS)(北京索莱宝公司);cDNA合成试剂盒、SYBR Green定量PCR试剂盒(日本Takara公司);Trizol(美国Invitrogen公司);Triton X-100、Tween-20(美国Sigma公司);Ⅰ型胶原购自(美国BD公司)。生长培养基:高糖DMEM培养基+20%胎牛血清+1%青链霉素,1% CEE。分化培养基:高糖DMEM培养基+5%马血清+1%青链霉素。BX51型倒置荧光显微镜(日本Olympus公司);Calibur型流式细胞仪(美国BD公司);Nanodrop 2000超微量分光光度计(美国Thermo公司)。
大鼠腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉,然后浸泡于75%乙醇溶液中进行皮肤表面消毒,小心分离后肢的胫骨前肌和趾长伸肌,去除筋膜及脂肪组织,用PBS冲洗肌肉组织后,在无菌培养皿中用眼科剪将肌肉剪碎成约1 mm3大小的肉糜状,4 ℃下PBS中静置1 min后弃上清液。将肌肉碎片小心贴附在10 cm培养皿的底部,倒置放入细胞培养箱中,在37 ℃、5%CO2条件下放置1 h后取出,加入适量的生长培养基,置于培养箱中继续培养,每2天更换一次培养基。待细胞从组织块边缘爬出并长满至70%~80%时,弃去组织块,用0.25%胰蛋白酶消化细胞,按照适宜密度接种至预包被Ⅰ型胶原的培养皿中,按照差速贴壁法以去除混杂的成纤维细胞。
将细胞悬液加入预包被Ⅰ型胶原的培养皿中,置于37 ℃、5%CO2培养箱中,预贴壁30 min,然后吸取上层细胞悬液,转移至另一新的预包被Ⅰ型胶原的培养皿中。下次传代时,再次进行差速贴壁,共差速贴壁2次。
细胞密度达到70%~80%时弃去培养液,用PBS清洗细胞,然后加入0.25%胰蛋白酶消化约1 min,至细胞变圆即加入生长培养基终止消化并温和吹打,200 g离心2 min后以1∶2或1∶3的比例传代。
用2%多聚甲醛在4 ℃固定细胞15 min,磷酸盐吐温缓冲液(PBST)(含0.2%吐温20的PBS)离心清洗2遍;加入0.5%皂素4 ℃破膜30 min;加入一抗(1∶100)4 ℃孵育30 min,PBST离心清洗2遍;加入APC标记的山羊抗兔二抗(1∶100)4 ℃避光孵育30 min,PBST离心清洗2遍;预冷PBS重悬后上机检测。阴性对照组用PBS代替一抗,其余步骤同实验组。
细胞爬片生长过夜后,PBS清洗细胞3次,每次5 min;加入4%多聚甲醛室温固定15 min,预冷PBS洗涤3次,每次5 min;然后用含0.2% Triton X-100的PBS室温通透10 min,吸去Triton X-100,PBS洗涤3次,每次5 min;用含1%牛血清白蛋白的PBST(PBS+0.1%吐温20)封闭30 min,加入Pax7一抗(1∶500),4 ℃湿盒孵育过夜;吸去一抗,PBST洗涤3次,每次5 min;加入FITC标记二抗(1∶1 000),室温避光孵育1 h,PBST洗涤3次,每次5 min;最后4',6-二脒基-2-苯基吲哚(DAPI)染核3 min,封片,荧光显微镜观察。
细胞生长至约70%~80%满时,吸去生长培养基,换为分化培养基。在加入分化培养基之前(第0天)和诱导分化后的第1、2、3、4、5天提取细胞的RNA。并用倒置显微镜观察记录细胞形态的变化。
用Trizol提取细胞总RNA,超微量分光光度计测定RNA浓度及质量,按照反转录试剂盒说明书合成cDNA。以cDNA为模板,进行定量PCR,以β-肌动蛋白作为内参,引物序列见表1。定量PCR采用两步法,具体反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,循环40次,然后绘制熔解曲线。检测卫星细胞分化的标志基因成肌决定因子(MyoD)、生肌素的mRNA表达。设第0天表达量为1,其余时间表达量与其比值为相对表达量。

各基因检测的引物序列
各基因检测的引物序列
| 基因名称 | 序列(5'→3') |
|---|---|
| MyoD | 上游:GGAGACATCCTCAAGCGATGC |
| 下游:AGCACCTGGTAAATCGGATTG | |
| 生肌素 | 上游:GAAGCGCAGGCTCAAGAAAG |
| 下游:GCTGCGAGCAAATGATCTCC | |
| β-肌动蛋白 | 上游:GACTTCGAGCAAGAGATGGCCACT |
| 下游:AGCACTGTGTTGGCATAGAG |
注:MyoD:成肌决定因子
倒置显微镜下观察,组织块培养7 d左右,组织块周围开始有散在细胞出现,培养8~10 d后可见大量细胞连成片,细胞为梭形或纺锤形,形态较为伸展,折光性好。
流式细胞仪检测结果显示,采用组织块法结合差速贴壁法分离得到的SMSC,纯度可达97.6%(图1)。
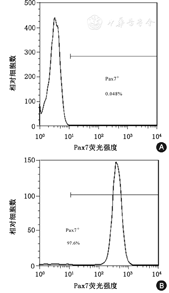

A:阴性对照组(Pax7阳性细胞数百占计数细胞0.048%);B:实验组(Pax7阳性细胞数百占计数细胞97.6%)
经Pax7的FITC免疫荧光染色,可见细胞呈阳性表达(图2A),同时用DAPI复染细胞核(图2B),所得绝大多数细胞核的Pax7免疫荧光染色呈阳性,且与DAPI核染色重合(图2C)。采用组织块法结合差速贴壁法分离得到的SMSC的纯度90%以上。


在细胞生长至70%~80%满时加入分化培养基开始,第0、1、2、3、4、5天可见细胞逐渐分化,细胞间明显发生了融合,并且呈现方向性(图3)。


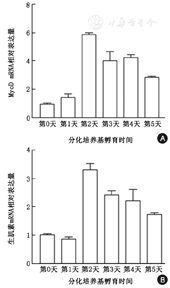
不同时间点定量PCR结果显示:MyoD的相对表达量在分化的第2天显著升高并维持到第4天,第5天显著下降;生肌素也呈现类似的趋势(图4)。

由于肌卫星细胞数目较少,位置特殊,到目前为止尚缺乏成熟的肌卫星细胞分离方法。本研究对肌卫星细胞的分离、纯度、分化稳定性进行了探讨。
对于哺乳动物随着年龄的增长,肌卫星细胞的含量会下降[4],同时增殖潜伏期变长[5]。因此,我们在取材时,选择相对年幼的大鼠进行实验。
目前体外SMSC的纯化方法主要是酶消化法和组织块法。本研究预实验结果显示,酶消化法步骤较为繁琐,消化时间过长会导致细胞受损,活力不佳,而时间过短又会造成细胞得率较低,此外还可能会清除一些细胞表面抗原,破坏了细胞的完整性,使细胞功能发生紊乱。为了避免酶消化法的缺点,我们采用组织块培养法对大鼠的SMSC进行分离。我们采取多次差速贴壁法可达到纯化富集卫星细胞的目的。除了差速贴壁法之外,目前还可采用Percoll梯度离心法或者流式细胞术纯化卫星细胞。前者所需细胞量较大,步骤较为繁琐容易污染;后者纯度高[6],但成本也高。本实验结果提示,我们采用组织块法结合差速贴壁法,也可获得了纯度较高的卫星细胞,该方法经济、易行。
肌卫星细胞属于干细胞,对其稳定性和分化进行良好控制是实验所必须的。肌卫星细胞被激活增殖分化融合成肌的过程中有各种标志基因[7],这为分化进程的检测提供了方便。Pax7是静止期和增殖期SMSC的重要标志蛋白[8]。目前尚未有商品化的直标Pax7流式抗体,因此我们采用间接免疫荧光法和流式细胞术来鉴定分离到的卫星细胞纯度。避免了以往仅仅通过免疫荧光视野随机计数的局限性。MyoD是卫星细胞增殖激活的重要标志,几乎所有的卫星细胞在激活时都表达MyoD[9]。生肌素可以作为卫星细胞分化时中晚期的标志[10]。因此,我们通过定量PCR的方法,检测了这两个基因的时序性表达,证明了分离获得的SMSC在体外具有良好的成肌分化方向潜能。我们下一步将检测肌纤维细胞标志物Desmin的表达情况,以更加明确的检测其最终成肌能力。
综上所述,本研究通过组织块培养法获得了大量的高纯度的SMSC,有满意的成肌分化能力,且操作简便,为下一步开展功能和机制的研究奠定了良好的基础。



























