
探讨血清游离脂肪酸(FFA)水平与2型糖尿病(T2DM)患者肾小球滤过率的关系及意义。
回顾性分析2013年1月至2015年6月浙江大学医学院附属邵逸夫医院内分泌科的442例T2DM患者资料,以改良的肾脏病饮食改善(MDRD)公式估测肾小球滤过率(eGFR),根据eGFR水平分为A组(eGFR≥90 ml·min-1·1.73 m-2,227例),B组(60 ml·min-1·1.73 m-2≤eGFR<90 ml·min-1·1.73 m-2,118例)和C组(eGFR<60 ml·min-1·1.73 m-2,97例),并选取50名体质指数匹配的非糖尿病者作为对照组。检测各组的血清FFA水平,分析其与eGFR的关系。
C组患者FFA水平[(450±203)μmol/L]明显高于A组[(326±167)μmol/L]、B组[(394±184)μmol/L]和对照组[(320±90)μmol/L](均P<0.05);B组FFA水平明显高于A组(P<0.05),A组和对照组间FFA水平差异无统计学意义(P>0.05)。多重线性回归分析显示,血尿酸(UA)、FFA、三酰甘油(TG)、总胆固醇(TC)、白蛋白尿、合并高血压、吸烟和糖尿病病程是eGFR下降的独立影响因素(均P<0.05)。
血清FFA水平升高与2型糖尿病患者肾功能下降相关,可能是影响2型糖尿病肾病进展的因素之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病肾病是糖尿病常见而严重的并发症,是糖尿病患者死亡的主要原因之一。在欧美国家,糖尿病肾病已占终末期肾病的50%[1],在我国为20%~40%[2],并呈不断增高趋势。研究显示,积极适当的干预,尤其是在疾病早期进行干预能显著减少和延缓糖尿病肾脏损害的发生和发展。游离脂肪酸(FFA)是反映脂代谢紊乱的一个关键指标,其在人体内的含量与2型糖尿病并发症的进展以及胰岛素敏感性密切相关[3,4]。已有研究发现,血清FFA浓度的增加与2型糖尿病(T2DM)患者尿微量白蛋白升高相关[5],但其与T2DM患者肾小球滤过率(GFR)的关系尚未明确。本研究运用改良的肾脏病饮食改善(MDRD)公式估测肾小球滤过率(eGFR),观察T2DM患者血清FFA水平与eGFR的关系,初步探讨FFA与糖尿病肾病发生发展的关系。
回顾性分析2013年1月至2015年6月浙江大学医学院附属邵逸夫医院内分泌科的442例T2DM患者资料。使用改良的MDRD公式[6]估算患者的eGFR。根据eGFR分为:A组(eGFR≥90 ml·min-1·1.73 m-2)227例,男122例,女105例,年龄(58±11)岁;B组(60 ml·min-1·1.73 m-2≤eGFR<90 ml·min-1·1.73 m-2)118例,男83例,女35例,年龄(62±11)岁;C组(eGFR<60 ml·min-1·1.73 m-2)97例,男59例,女38例,年龄(65±11)岁。同时收集在浙江大学医学院附属邵逸夫医院健康体检的50名体质指数(BMI)匹配的非糖尿病者[行口服葡萄糖耐量试验和检验糖化血红蛋白(HbA1c)后排除糖尿病]为对照组,男27例,女23例,年龄(58±6)岁。
纳入标准:符合1999年世界卫生组织(WHO)2型糖尿病诊断及分型标准;年龄≥18岁。排除标准:合并糖尿病急性并发症(高血糖高渗状态、乳酸酸中毒、酮症及酮症酸中毒)、妊娠、肿瘤、外伤、急慢性感染、精神疾病、肝病(肝酶和胆红素水平正常的脂肪肝除外)、甲状腺功能异常、其他原因的肾病等患者。
人体参数测量:记录性别、年龄、糖尿病病程、吸烟史、饮酒史、高血压史、测量身高、体重、血压、腰围,并计算BMI。血生化指标检测:研究对象禁食12~14 h,在空腹静息状态下抽取静脉血,测定空腹血糖(FPG)、空腹胰岛素(FINS)、血肌酐(Cr)、尿素氮(BUN)、血尿酸(UA)、FFA、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和HbA1c(高效液相色谱法测定),T2DM患者进一步测定空腹C肽(FCP)。使用C肽估算的胰岛素抵抗指数[HOMA-IR(CP)]公式[HOMA-IR(CP)=1.5+ FPG×FCP/2 800][7]评估本研究中T2DM患者的胰岛素抵抗。无饮酒史或饮酒折合乙醇<140 g/周(女性<70 g/周),结合B超检查符合脂肪肝诊断标准的诊断为脂肪肝。FFA以酶法测定(试剂购自日本积水医疗株式会社),采用Abbott C1600全自动生化分析仪检测。
(1)大血管病变:采用双下肢动脉彩色多普勒超声检查,并根据其严重程度进行评分,>0分为存在大血管病变[8];(2)糖尿病视网膜病变检查:采用免散瞳眼底照相,由专人使用日本Kowa nonmyda-Dm眼底相机,每眼拍摄1~2张45°眼底后极部彩色照片。眼底照片分级诊断标准采用国际眼科学会糖尿病视网膜病变和糖尿病黄斑水肿病变严重程度分级标准[9];(3)白蛋白尿:留空腹晨尿测定尿白蛋白(比浊法)和肌酐,以尿白蛋白和肌酐比值(mAlb/Cr)表示尿白蛋白排出量,mAlb/Cr<30 μg/mg为正常白蛋白尿,mAlb/Cr≥30 μg/mg为白蛋白尿(包括微量白蛋白尿和大量白蛋白尿)。
所有数据采用SPSS 18.0统计软件处理。正态分布的计量资料用 ±s表示,非正态分布的计量资料用M(Q1,Q3)表示;正态分布或经算术转换为正态分布的数据多个样本间均数比较用方差分析;计数资料以百分比表示,组间比较采用非参数检验(秩和检验);数据间的相关分析对于双变量正态分布的采用Pearson相关分析,双变量非正态分布的通过算术转化为正态分布后采用Pearson相关分析,非连续变量采用Spearman相关分析;各自变量对eGFR的影响分析采用多重线性回归分析。P<0.05为差异有统计学意义。
±s表示,非正态分布的计量资料用M(Q1,Q3)表示;正态分布或经算术转换为正态分布的数据多个样本间均数比较用方差分析;计数资料以百分比表示,组间比较采用非参数检验(秩和检验);数据间的相关分析对于双变量正态分布的采用Pearson相关分析,双变量非正态分布的通过算术转化为正态分布后采用Pearson相关分析,非连续变量采用Spearman相关分析;各自变量对eGFR的影响分析采用多重线性回归分析。P<0.05为差异有统计学意义。
4组间性别、年龄、腰围、BMI、TG、LDL-C和有无脂肪肝差异均无统计学意义(均P>0.05);A、B、C组HbA1c、FPG和FINS差异无统计学意义(P>0.05);但A、B、C组FPG、FINS、HbA1c均明显高于对照组(均P<0.05); C组病程长于A组和B组(P<0.05),A、B组间比较差异无统计学意义(P>0.05);B组和C组FCP、HOMA-IR(CP)和合并大血管病变率高于A组(均P<0.05),但B、C组间差异无统计学意义(P>0.05);合并高血压率B组和C组均高于A组、对照组(均P<0.01),A组高于对照组(P<0.01),B、C组间比较差异无统计学意义(P>0.05);合并视网膜病变率C组高于A、B组(P<0.01),A、B组间比较差异无统计学意义(P>0.05);合并白蛋白尿率C组高于A、B组(P<0.01),B组高于A组(P<0.05);血清FFA水平B组[(394±184)μmol/L]和C组[(450±203) μmol/L]明显高于A组[(326±167)μmol/L]和对照组[(320±90)μmol/L](均P<0.05),C组FFA亦高于B组(P<0.01),A组和对照组间FFA水平差异无统计学意义(P>0.05)(表1)。
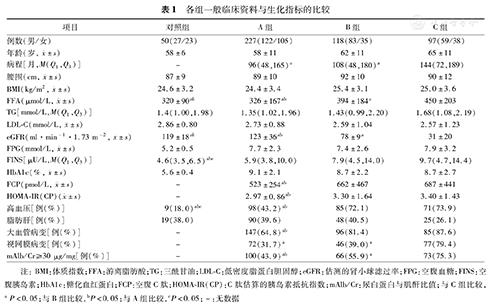
各组一般临床资料与生化指标的比较
各组一般临床资料与生化指标的比较
| 项目 | 对照组 | A组 | B组 | C组 |
|---|---|---|---|---|
| 例数(男/女) | 50(27/23) | 227(122/105) | 118(83/35) | 97(59/38) |
年龄(岁, ±s) ±s) | 58±6 | 58±11 | 62±11 | 65±11 |
| 病程[月,M(Q1,Q3)] | - | 96(48,165)a | 108(48,180)a | 144(72,189) |
腰围(cm, ±s) ±s) | 87±9 | 89±10 | 92±10 | 90±12 |
BMI(kg/m2, ±s) ±s) | 24.6±3.2 | 24.4 ±3.4 | 25.4±3.1 | 25.0±3.6 |
FFA(μmol/L, ±s) ±s) | 320±90ab | 326±167ab | 394±184a | 450±203 |
| TG[mmol/L,M(Q1,Q3)] | 1.4(1.00,1.98) | 1.35(1.02,1.96) | 1.43(0.99,2.20) | 1.68(1.08,2.19) |
LDL-C(mmol/L, ±s) ±s) | 2.86±0.80 | 2.73±0.88 | 2.59±1.04 | 2.57±1.23 |
eGFR(ml·min-1·1.73 m-2, ±s) ±s) | 119±18ab | 123±36ab | 78±9a | 31±20 |
FPG(mmol/L, ±s) ±s) | 5.2±0.5 | 7.7±2.3 | 7.4±2.6 | 7.9±3.2 |
| FINS[μU/L,M(Q1,Q3)] | 4.6(3.5,6.5)abc | 5.9(3.8,10.0) | 7.9(4.5,14.0) | 9.7(4.7,14.4) |
HbA1c(%, ±s) ±s) | 5.6±0.4 | 9.1±2.1 | 8.7±2.2 | 8.7±2.7 |
FCP(pmol/L, ±s) ±s) | - | 523±254ab | 662±467 | 687±441 |
HOMA-IR(CP)( ±s) ±s) | - | 2.97±0.86ab | 3.30±1.64 | 3.40±1.43 |
| 高血压[例(%)] | 9(18.0)abc | 98(43.2)ab | 85(72.1) | 71(73.9) |
| 脂肪肝[例(%)] | 19(38.0) | 90(39.6) | 48(40.5) | 25(26.1) |
| 大血管病变[例(%)] | - | 147(64.8)ab | 96(81.4) | 85(87.6) |
| 视网膜病变[例(%)] | - | 72(31.7)a | 46(39.0)a | 77(79.4) |
| mAlb/Cr≥30 μg/mg[例(%)] | - | 100(43.9)ab | 66(55.9)a | 73(75.3) |
注:BMI:体质指数;FFA:游离脂肪酸;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;eGFR:估测的肾小球滤过率;FPG:空腹血糖;FINS:空腹胰岛素;HbA1c:糖化血红蛋白;FCP:空腹C肽;HOMA-IR(CP):C肽估算的胰岛素抵抗指数;mAlb/Cr:尿白蛋白与肌酐比值;与C组比较,aP<0.05;与B组比较,bP<0.05;与A组比较,cP<0.05;-:无数据
T2DM患者中,eGFR与FPG呈正相关(P<0.01),与BMI、FFA、合并高血压、大血管病变、视网膜病变呈负相关(均P<0.05),而与病程、腰围、TG、TC、LDL-C、HDL-C、mAlb/Cr、HbA1c、FINS、HOMA-IR(CP)、有无脂肪肝均无明显相关性(均P>0.05)(表2)。
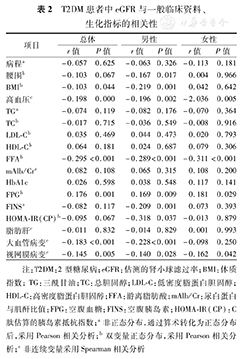
T2DM患者中eGFR与一般临床资料、生化指标的相关性
T2DM患者中eGFR与一般临床资料、生化指标的相关性
| 项目 | 总体 | 男性 | 女性 | |||
|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | |
| 病程a | -0.057 | 0.625 | -0.063 | 0.326 | -0.113 | 0.181 |
| 腰围b | -0.103 | 0.067 | -0.167 | 0.017 | 0.004 | 0.966 |
| BMIb | -0.103 | 0.044 | -0.219 | 0.001 | 0.042 | 0.642 |
| 高血压c | -0.198 | 0.000 | -0.196 | 0.002 | -2.036 | 0.005 |
| TGa | -0.074 | 0.119 | -0.082 | 0.176 | -0.070 | 0.364 |
| TCb | -0.017 | 0.715 | -0.036 | 0.549 | -0.008 | 0.916 |
| LDL-Cb | 0.035 | 0.469 | 0.044 | 0.473 | 0.020 | 0.793 |
| HDL-Cb | 0.064 | 0.181 | 0.024 | 0.687 | 0.079 | 0.306 |
| FFAb | -0.295 | <0.001 | -0.289 | <0.001 | -0.311 | <0.001 |
| mAlb/Cra | 0.082 | 0.108 | 0.065 | 0.315 | 0.108 | 0.200 |
| HbA1c | 0.026 | 0.598 | 0.038 | 0.548 | 0.117 | 0.141 |
| FPGb | 0.176 | 0.001 | 0.169 | 0.009 | 0.181 | 0.029 |
| FINSa | -0.082 | 0.117 | -0.209 | 0.001 | 0.073 | 0.393 |
| HOMA-IR(CP)b | -0.095 | 0.067 | -0.318 | 0.037 | -0.013 | 0.879 |
| 脂肪肝c | -0.011 | 0.832 | -0.014 | 0.829 | 0.001 | 0.993 |
| 大血管病变c | -0.183 | <0.001 | -0.228 | <0.001 | -0.098 | 0.250 |
| 视网膜病变c | -0.145 | 0.005 | -0.140 | 0.028 | -0.162 | 0.042 |
注:T2DM:2型糖尿病;eGFR:估测的肾小球滤过率;BMI:体质指数;TG:三酰甘油;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;FFA:游离脂肪酸;mAlb/Cr:尿白蛋白与肌酐比值;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-IR(CP):C肽估算的胰岛素抵抗指数;a非正态分布,通过算术转化为正态分布后,采用Pearson相关分析;b双变量正态分布,采用Pearson相关分析;c非连续变量采用Spearman相关分析
按性别进一步分层发现,男性患者中,eGFR与FPG呈正相关(P<0.01),与腰围、BMI、FFA、FINS、HOMA-IR(CP)、合并高血压、大血管病变、视网膜病变呈负相关(均P<0.05),而与病程、TG、TC、LDL-C、HDL-C、mAlb/Cr、HbA1c、有无脂肪肝均无明显相关性(均P>0.05)。女性患者中,eGFR与FPG呈正相关(P<0.05),与FFA、合并高血压、视网膜病变呈负相关(均P<0.01),而与病程、腰围、BMI、TG、TC、LDL-C、HDL-C、mAlb/Cr、HbA1c、FINS、HOMA-IR(CP)、有无脂肪肝、合并大血管病变均无明显相关性(均P>0.05)。
以eGFR为因变量,以性别、病程、吸烟、饮酒、BMI、腰围、有无高血压史、HbA1c、TG、TC、UA、FFA、HOMA-IR(CP)及有无白蛋白尿、糖尿病视网膜和大血管病变作为自变量进行多重线性回归分析。建立的全变量多重线性回归分析模型r2=0.390(调整r2=0.346);对各自变量的偏回归系数显著性检验显示,病程、吸烟、TG、TC、UA、FFA、合并高血压和白蛋白尿为2型糖尿病eGFR下降的独立影响因素(表3)。
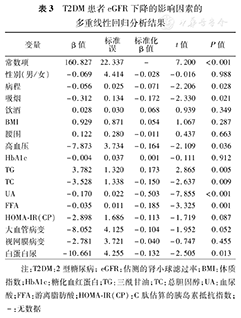
T2DM患者eGFR下降的影响因素的多重线性回归分析结果
T2DM患者eGFR下降的影响因素的多重线性回归分析结果
| 变量 | β值 | 标准误 | 标准化β值 | t值 | P值 |
|---|---|---|---|---|---|
| 常数项 | 160.827 | 22.337 | - | 7.200 | <0.001 |
| 性别(男/女) | -0.069 | 4.414 | -0.028 | -0.016 | 0.988 |
| 病程 | -0.056 | 0.025 | -0.071 | -2.206 | 0.028 |
| 吸烟 | -0.312 | 0.134 | -0.172 | -2.330 | 0.021 |
| 饮酒 | 0.028 | 0.030 | 0.068 | 0.939 | 0.349 |
| BMI | 0.929 | 0.871 | 0.054 | 1.067 | 0.287 |
| 腰围 | 0.122 | 0.280 | -0.011 | 0.437 | 0.663 |
| 高血压 | -7.873 | 3.734 | -0.164 | -2.109 | 0.036 |
| HbA1c | -0.004 | 0.037 | 0.001 | -0.111 | 0.912 |
| TG | 3.782 | 1.320 | 0.173 | 2.865 | 0.005 |
| TC | -3.528 | 1.338 | -0.150 | -2.637 | 0.009 |
| UA | -0.170 | 0.022 | -0.503 | -7.855 | <0.001 |
| FFA | -0.035 | 0.011 | -0.185 | -3.325 | 0.001 |
| HOMA-IR(CP) | -2.898 | 1.686 | -0.113 | -1.719 | 0.087 |
| 大血管病变 | -8.052 | 4.125 | -0.104 | -1.952 | 0.052 |
| 视网膜病变 | -2.781 | 3.721 | -0.040 | -0.747 | 0.455 |
| 白蛋白尿 | -10.661 | 4.255 | -0.132 | -2.505 | 0.013 |
注:T2DM:2型糖尿病;eGFR:估测的肾小球滤过率;BMI:体质指数;HbA1c:糖化血红蛋白;TG:三酰甘油;TC:总胆固醇;UA:血尿酸;FFA:游离脂肪酸;HOMA-IR(CP):C肽估算的胰岛素抵抗指数;-:无数据
糖尿病患者肾小球滤过率的下降与心血管事件的发生有密切相关,因此早期诊断及干预治疗预防或延缓糖尿病患者的肾脏损害对于减少终末期肾病、减少心血管事件具有重要的临床意义。本研究发现,在2型糖尿病患者中随着血清FFA水平逐渐升高,eGFR逐渐下降,即使在eGFR轻度下降时(eGFR 60~90 ml·min-1·1.73 m-2)FFA即显著高于eGFR正常者(eGFR≥90 ml·min-1·1.73 m-2),而eGFR正常糖尿病组与BMI匹配的非糖尿病组FFA水平差异无统计学意义,提示系eGFR下降(而非糖尿病本身)与FFA升高有关;进一步行相关分析显示,无论男女,FFA与eGFR均呈负相关(男:r=-0.289,P<0.001;女:r=-0.311,P<0.001)。而多重线性回归分析显示,2型糖尿病患者中高血清FFA是eGFR下降的独立影响因素,其对eGFR的影响甚至较病程、胆固醇、三酰甘油、是否有高血压及白蛋白尿更大,提示高FFA可能是2型糖尿病肾脏损害的发生发展的重要危险因素。
FFA和糖尿病肾病的关系既往研究也有探讨,但着眼于其与尿白蛋白的关系。与正常白蛋白尿相比,2型糖尿病组微量蛋白尿患者有更高的血清FFA水平[10],同时伴随更严重的胰岛素抵抗和血管内皮功能障碍[11]。在肥胖大鼠中的一项研究也发现血清FFA水平的升高可能导致肥胖大鼠微量蛋白尿的增加,该过程可能是由于FFA诱导的血管内皮生长因子(VEGF)-一氧化氮(NO)功能轴的解偶联以及血管内皮功能障碍所致[5]。目前越来越多的学者认为糖尿病患者中eGFR的下降较mAlb/Cr更能反映肾功能的恶化和肾病的进展[12],eGFR下降和mAlb/Cr增高有时并不一致。我们之前的研究[13]和日本糖尿病临床数据研究组[14]也发现,在尿微量白蛋白正常的T2DM患者中,约20%左右的患者eGFR下降。因此探讨2型糖尿病患者中FFA水平与eGFR的关系较与尿微量白蛋白的关系可能更有价值。
eGFR下降和血清FFA增高的因果关系目前并不明确。脂代谢紊乱可能是糖尿病肾病的启动因素。有研究显示,FFA可以通过诱导培养足细胞内质网应激导致足细胞凋亡[15],通过增加活化胆固醇调节元件结合蛋白1(SREBP1),增加Toll样受体(TLR)2/TLR4表达,促进炎性细胞因子分泌而损伤足细胞[16],还通过增加蛋白尿而损伤足细胞[17],从而在糖尿病肾病发病过程中起着重要作用。同样,肾脏损伤本身也可引起血清FFA的增高。动物实验表明慢性肾脏病大鼠血清FFA水平较对照组明显增高,与肝脏中促进FFA合成的酶上调,而促使FFA氧化及降解的酶下降相关[18]。
总而言之,本研究结果表明FFA与2型糖尿病肾脏功能的减退有着密切的关系,FFA可能在糖尿病肾病的发生和发展中起着一定的作用,但基于本研究的横断面研究性质,无法阐明FFA升高和肾小球滤过率下降的确切因果关系,有待于更多的基础和临床研究来明确。



























