
探讨表没食子儿茶素没食子酸酯(EGCG)对糖尿病db/db小鼠肾脏的保护作用及其机制。
将8周db/db小鼠(血糖>16.7 mmol/L)随机分为对照组(未干预,8只)、EGCG A组(EGCG 50 mg·kg-1·d-1,8只)、EGCG B组(EGCG 100 mg·kg-1·d-1,8只)。于实验前、第4、8周测体重、空腹血糖、行口服葡萄糖耐量试验(OGTT),并收集24 h尿液检测24 h尿蛋白。酶联免疫吸附试验(ELISA)检测血管紧张素Ⅱ(AngⅡ)、胰岛素、尿8-羟基脱氧鸟苷(8-OHdG)水平;Western印迹法检测肾皮质组织AngⅡ受体1(AT-1R)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚基P22-phox和P47-phox、磷酸化细胞外调节蛋白激酶1/2(p-Erk1/2)、磷酸化P38丝裂原活化蛋白激酶(p-P38MAPK)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-AKT)的蛋白表达水平。过碘酸雪夫(PAS)染色方法观察肾脏病理情况。
EGCG干预8周后,与对照组相比,EGCG A、B组空腹血糖水平降低[(14.4±1.0)、(14.2±0.7)比(17.2±0.8)mmol/L];空腹胰岛素水平增高[(13.2±1.2)、(13.4±1.3)比(9.9±1.0)mU/L];OGTT曲线下面积减少[(49.3±1.8)、(44.8±0.7)比(60.0±0.8)mmol·L-1·h-1];24 h尿蛋白[(8.8±1.0)、(8.6±1.1)比(11.7±1.3)mg]和尿8-OHdG[(90±5)、(78±5)比(118±10)ng/d]水平均降低;血清AngⅡ[(498±23)、(511±19)比(688±17)ng/L]和肾皮质AngⅡ[(367±5)、(384±10)比(406±7)ng/L]水平均降低;AT-1R、P22-phox、P47-phox、p-Erk1/2、p-P38MAPK蛋白表达水平明显下调,p-PI3K、p-AKT的蛋白表达水平明显上调,差异均有统计学意义(均P<0.05);肾脏病理出现改善。干预8周后,与EGCG A组相比,EGCG B组尿8-OHdG水平降低(P=0.007),OGTT曲线下面积减少(P=0.01)。
EGCG具有保护糖尿病小鼠肾脏的作用,其机制可能与抑制氧化应激,抑制Erk/P38MAPK信号通路,激活PI3K/AKT信号传导通路有密切关系。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病肾病(diabetic kidney disease, DKD)随着糖尿病发病率的增多而逐年增加[1]。研究发现,DKD的病程进展与肾素-血管紧张素系统(RAS)的激活有密切关系[2]。高糖可激活RAS的各种组分,特别是血管紧张素Ⅱ (AngⅡ)[2]。Ang Ⅱ可通过诱导氧化应激,激活细胞外调节蛋白激酶1/2 (Erk1/2),P38丝裂原活化蛋白激酶(P38MAPK)引起肾脏损伤[3]。此外,研究发现血管紧张素Ⅱ受体1(AT-1R)的激活在DKD进展过程可引起蛋白尿的增多,AT-1R拮抗剂能显著减轻高糖环境下的蛋白尿水平[4]。目前也有研究表明,磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)信号通路在糖尿病(包括DKD)的病程进展中起重要作用[5,6]。
表没食子儿茶素没食子酸酯(EGCG)是一种绿茶提取物,因其特殊的化学结构具有较强的抗氧化性,从而引起广泛关注。EGCG除具有抗氧化性外,还具有抗炎、降血糖等作用,在心血管系统疾病、糖尿病及其并发症等慢性疾病方面有一定的治疗作用[7]。目前已有研究表明,EGCG在链脲佐菌素(STZ)诱导的1型糖尿病小鼠模型中具有保护DKD肾脏的作用[8],然而EGCG对2型糖尿病肾病的研究甚少。本次研究以2型糖尿病db/db小鼠为动物模型,旨在探讨EGCG保护糖尿病肾脏的具体机制,为EGCG的临床研究提供理论基础。
8周糖尿病db/db小鼠,雌雄各半,体质量(33.4±1.1)g(南京大学-南京生物生物医药研究院);胰岛素、AngⅡ和尿8-羟基脱氧鸟苷(8-OHdG)酶联免疫吸附试验(ELISA)定量检测试剂盒(武汉基因美生物科技有限公司);兔抗鼠血管紧张素转化酶2(ACE2)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚基P22-phox和P47-phox、β-肌动蛋白、p-PI3K、PI3K、辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(美国Abcam公司);兔抗鼠p-Erk1/2、Erk1/2、p-P38MAPK、P38MAPK、p-AKT、AKT抗体(美国CST公司);EGCG(浓度>95%,美国Sigma公司)。
6周db/db小鼠于SPF级环境饲养,12 h光照,12 h黑暗,自由饮水、饮食,适应环境2周后开始实验。8周6 h空腹血糖>16.7 mmol/L的小鼠用于实验。符合条件的小鼠随机分成3组:(1)对照组(未干预,8只)、(2) EGCG A组(EGCG 50 mg·kg-1·d-1,8只)、(3) EGCG B组(EGCG 100 mg·kg-1·d-1,8只)。EGCG溶于0.9% NaCl中,每日灌胃;对照组每日灌胃同体积0.9% NaCl。所有实验操作均符合动物伦理委员会的要求。
于实验前、第4、8周测小鼠空腹16 h体重、血糖。尾静脉测血糖并取血清标本。10%的葡萄糖1 g/kg灌胃,测15、30、60、90、120 min血糖。AngⅡ、胰岛素的检测使用小鼠ELISA定量检测试剂盒。实验重复3次,取其平均值。
于实验前、第4、8周把小鼠单独放入代谢笼,自由饮水,收集24 h尿液,4 ℃ 2 000 r/min离心5~10 min,分装于EP管中,-80 ℃保存备用。尿8-OHdG的检测使用小鼠ELISA定量检测试剂盒。实验重复3次,取其平均值。
肾脏指数为小鼠肾脏体质量(mg)/总体质量(g)。于第4、8周收集尿液后,麻醉db/db小鼠,经PBS灌洗后,取肾脏组织,称其两肾质量(mg),所有小鼠一个肾脏-80 ℃保存备用,另一肾脏保存于4%多聚甲醛溶液中,制备石蜡切片,常规过碘酸雪夫(PAS)染色观察肾脏病理变化。
裂解肾脏皮质组织提取蛋白,经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,每孔上样50 μg),待溴酚蓝跑到底部后,转移到聚偏氟乙烯(PVDF)膜,然后5%脱脂牛奶室温封闭1 h, PVDF膜和所需抗体孵育4 ℃过夜,TBST洗3次,室温孵育二抗1 h,TBST洗3次,化学发光显影。重复实验3次,取其平均值。
采用SPSS 19.0统计软件进行分析,计量资料以 ±s表示。多组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
±s表示。多组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
EGCG干预4周、8周后,各组之间体重差异无统计学意义,但与对应时间点的对照组相比,EGCG A、B组肾脏指数减少,空腹血糖水平降低、空腹胰岛素水平升高;尿蛋白、尿8-OHdG、AngⅡ水平均降低,差异均有统计学意义(均P<0.05)。对应时间点EGCG B组与EGCG A组相比,尿8-OHdG水平均降低,差异均有统计学意义(均P<0.05),其他指标差异均无统计学意义(均P>0.05,表1)。

各组相关指标的变化情况( ±s)
±s)
各组相关指标的变化情况( ±s)
±s)
| 指标 | 对照组(n=8) | EGCG A组(n=8) | EGCG B组(n=8) | |
|---|---|---|---|---|
| 体质量(g) | ||||
| 实验前 | 33.2±0.8 | 33.4±1.0 | 33.3±1.1 | |
| 4周 | 39.8±1.4 | 38.9±1.9 | 39.5±1.7 | |
| 8周 | 45.6±1.2 | 44.2±1.8 | 44.3±3.1 | |
| 肾脏指数(mg/g) | ||||
| 4周 | 8.1±0.3 | 7.1±0.8b | 7.3±0.1b | |
| 8周 | 8.4±0.1 | 7.4±0.2b | 7.5±0.1b | |
| 空腹血糖(mmol/L) | ||||
| 实验前 | 11.5±0.9 | 11.3±1.1 | 11.5±1.1 | |
| 4周 | 15.1±0.5 | 12.8±1.0b | 12.1±0.6b | |
| 8周 | 17.2±0.8 | 14.4±1.0b | 14.2±0.7b | |
| 空腹胰岛素(mU/L) | ||||
| 实验前 | 8.6±0.5 | 8.4±1.1 | 8.6±0.8 | |
| 4周 | 9.5±1.1 | 10.8±0.8a | 11.8±0.9b | |
| 8周 | 9.9±1.0 | 13.2±1.2b | 13.4±1.3b | |
| 24 h尿蛋白(mg) | ||||
| 实验前 | 5.8±0.6 | 5.9±0.9 | 5.5±1.1 | |
| 4周 | 7.5±0.2 | 6.7±0.1b | 6.7±0.5b | |
| 8周 | 11.7±1.3 | 8.8±1.0a | 8.6±1.1a | |
| 尿8-羟基脱氧鸟苷(ng/d) | ||||
| 实验前 | 50±6 | 52±7 | 51±2 | |
| 4周 | 94±4 | 76±2a | 63±3bc | |
| 8周 | 118±10 | 90±5b | 78±5bc | |
| 血清血管紧张素Ⅱ (ng/L) | ||||
| 实验前 | 435±16 | 428±19 | 436±20 | |
| 4周 | 604±25 | 509±14b | 502±15b | |
| 8周 | 688±17 | 498±23b | 511±19b | |
| 肾皮质血管紧张素Ⅱ (ng/L) | ||||
| 4周 | 346±23 | 298±16a | 309±7a | |
| 8周 | 406±7 | 367±5b | 384±10a | |
注:EGCG:表没食子儿茶素没食子酸酯;与对照组比较,aP<0.05,bP<0.01;与EGCG A组比较,cP<0.05
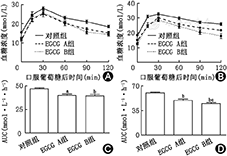
EGCG干预4周、8周后,和对应时间点的对照组(47.1±0.6、60.0±0.8)相比,EGCG A组(38.7±1.4、49.3±1.8)及EGCG B组(37.5±1.1、44.8±0.7)OGTT曲线下面积(AUC)明显减少,差异均有统计学意义(均P<0.01)。干预8周后,EGCG B组与EGCG A组相比,AUC明显减少,差异有统计学意义(P<0.05,图1)。

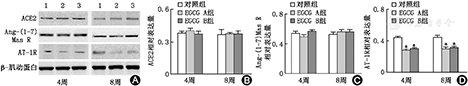
EGCG干预4周、8周后,对应时间点对照组、EGCG A、B组中ACE2、Ang-(1-7) Mas R蛋白表达水平无明显变化,差异均无统计学意义(均P>0.05,图2A, 图2B, 图2C);EGCG干预4周、8周后,和对应时间点对照组相比,EGCG A、B组中AT-1R(图2A, 图2D)、P22-phox和P47-phox(图3)、p-Erk1/2和p-P38MAPK(图4)蛋白表达水平均明显下降,差异有统计学意义(均P<0.05);p-PI3K、p-AKT蛋白表达水平明显增加,差异有统计学意义(均P<0.01,图5)。







PAS结果显示:对照组db/db小鼠肾小球体积增大,系膜细胞增多伴有系膜基质的增生,肾小球基底膜弥漫增厚,给予EGCG治疗8周后肾小球体积增大及肾小球系膜增生情况较未治疗组明显好转(图6)。


本次研究发现,EGCG能减轻2型糖尿病db/db小鼠尿蛋白水平,抑制肾脏AT-1R蛋白的表达,还能减少血清及肾脏皮质组织AngⅡ水平,减少肾组织氧化应激指标P22-phox、P47-phox蛋白和尿8-OHdG的表达、抑制氧化应激,抑制Erk1/2-P38MAPK信号通路、减轻细胞损伤及增殖,激活PI3K-AKT信号通路,但对ACE2和Ang-(1-7) Mas R蛋白的表达无明显影响。
RAS系统在DKD的病程进展中起重要作用,其中AngⅡ是RAS系统的重要组成成分[2]。研究表明高糖可引起AngⅡ表达增加,AngⅡ可通过多种途径引起肾脏损伤,例如:刺激诱导氧化应激反应,上调炎症因子的表达,引起炎症反应、细胞增生及肥大,从而导致肾脏纤维化[3]。AngⅡ还可引起丝裂原活化蛋白激酶(MAPK)表达增加[3]。MAPK家族成员包括Erk1/2、P38等,MAPK在细胞生长、增殖、分化和凋亡等方面发挥重要作用,其中Erk1/2是细胞增殖和分化的关键,P38与细胞凋亡、增殖、炎症有密切关系。研究表明在高糖环境下,在肾小球系膜细胞中Erk1/2可被激活[9],引起肾脏肥大。在糖尿病条件下,抑制P38-MAPK,可明显减少促炎介质肿瘤坏死因子α(TNF-α)、白细胞介素(IL)1、IL-6和胶原蛋白等的表达[10]。因此,高糖和Ang-Ⅱ都可引起Erk1/2-P38MAPK信号通路的激活,引起细胞增殖、炎症反应、最终引起肾脏细胞的损伤及凋亡。AT-1R是AngⅡ的受体,其在尿蛋白的产生过程中起到重要作用,已有研究表明AT-1R拮抗剂能明显减轻糖尿病条件下的蛋白尿水平[4]。PI3K-AKT信号通路在糖尿病的病程过程中起着重要作用,它不仅是胰岛素信号传导重要通路,也可调控细胞的增殖和凋亡[5,6]。
EGCG干预8周后与对照组相比,EGCG A组(50 mg·kg-1·d-1)和EGCG B组(100 mg·kg-1·d-1)血清及肾脏皮质组织AngⅡ水平均降低,肾脏组织AT-1R蛋白表达降低,尿蛋白也减轻,这就表明EGCG不仅能减轻血清AngⅡ水平,还能降低肾脏局部AngⅡ水平和降低AT-1R蛋白的表达,减轻AngⅡ-AT-1受体轴引起的肾脏损伤。另外,EGCG A组和EGCG B组p-Erk1/2、p-P38MAPK蛋白表达均明显下降,p-PI3K、p-AKT蛋白表达增加,表明EGCG能通过抑制Erk1/2-P38MAPK信号通路及激活PI3K-AKT信号通路,改善肾脏病理变化。但在非糖尿病肾损伤模型中观察到EGCG 50 mg·kg-1·d-1干预2周后p-PI3K、p-AKT蛋白表达减少,可能与抑制细胞增殖有关[11]。说明EGCG激活还是抑制PI3K-AKT信号通路可能在不同的疾病中发挥不同的作用。
已有研究表明,DKD的发生发展与氧化应激有着密切的关系,氧化应激主要是指活性氧(ROS)等的过度产生,引起细胞损伤及凋亡,加快疾病进展,其中在糖尿病动物模型中发现ROS的主要来源是NADPH氧化酶,NADPH氧化酶能将NADPH的电子转移产生ROS[12]。EGCG因其特殊的化学结构具有抗氧化,但也有研究表明EGCG也具有促氧化能力[13]。在本实验糖尿病动物模型db/db小鼠中发现,与对应时间点对照组相比,NADPH氧化酶亚基P22-phox、P47-phox在EGCG A组和EGCG B组中表达减少,同时尿氧化应激指标8-OHdG水平降低,说明在db/db小鼠中,EGCG表现出抗氧化能力。也有研究表明EGCG除了能减少氧化酶的表达,可以直接抑制NADPH氧化酶的活性[14]。
研究表明,EGCG可通过增加胰岛素的分泌,提高胰岛素的敏感性等途径降低血糖[15]。在本研究中也证实了EGCG具有降糖作用。EGCG干预8周后,EGCG A组和EGCG B组和对照组相比,空腹血糖水平降低、胰岛素分泌增加,OGTT曲线下面积明显减少,说明EGCG能改善糖尿病小鼠的糖代谢异常。本研究还发现在db/db小鼠中,EGCG干预8周后,EGCG B组和EGCG A组相比,除尿8-OHdG水平均降低,OGTT的AUC减少外,其他指标差异均无统计学意义。EGCG保护肾脏的最佳剂量到目前为止并不清楚,将来可以通过增加样本含量及延长干预时间等方法进一步探讨其保护肾脏的有效剂量。
综上所述,在2型糖尿病模型db/db小鼠中,EGCG具有保护肾脏的作用,其机制可能与EGCG减少AngⅡ和AT-1R蛋白的表达,抑制Erk1/2-P38MAPK信号通路,降低氧化应激,激活PI3K-AKT信号通路有密切关系。目前EGCG的临床研究较少,本研究为EGCG的临床研究提供理论基础,也为DKD的防治提供潜在的治疗方案。



























