
研究后肾间充质干细胞(MMSC)在肾缺血再灌注损伤中的作用。
将C57BL/6J雄鼠分为正常组(n=5)和实验组(n=30)。正常组作为术前对照,实验组进行肾缺血再灌注损伤手术处理,根据股静脉注射物不同,再分为两个亚组:缺血再灌注组(注射生理盐水,10 ml/kg)和细胞治疗组(注射含5×105个MMSC的生理盐水,10 ml/kg)。实验组术后12、24、72 h和正常组各取5只小鼠全血和肾脏,检测血清肌酐(SCr)水平,分析肾组织病理染色结果和肾小管Paller评分,评估MMSC的作用。采用反转录-聚合酶链反应法检测肾组织的微小RNA-26a(miR-26a)水平,观察miR-26a在各组间的差异。
(1)缺血再灌注组和细胞治疗组术后12、24、72 h的SCr均高于正常组,且术后24 h的SCr均高于术后12、72 h,差异均有统计学意义(均P<0.05);术后12、24、72 h缺血再灌注组和细胞治疗组间SCr差异无统计学意义(均P>0.05)。(2)缺血再灌注组和细胞治疗组术后12、24、72 h的肾小管Paller氏评分均高于正常组,且24 h评分>72 h评分>12 h评分(均P<0.05);在术后24 h,细胞治疗组的Paller氏评分低于缺血再灌注组[(57.2±6.3)比(70.8±14.8)分](P<0.05);与正常组和细胞治疗组相比,缺血再灌注组术后24 h可见明显的蛋白管型,肾小管萎缩、肿胀。(3)缺血再灌注组和细胞治疗组术后12、24 h的肾组织miR-26a相对表达量均低于正常组(均P<0.05);在术后24、72 h,细胞治疗组肾组织miR-26a相对表达量分别是0.416±0.139、1.152±0.239,明显高于缺血再灌注组(0.244±0.067、0.855±0.038,均P<0.05),且肾组织miR-26a的相对表达量与SCr呈负相关(r=-0.5,P<0.05)。
MMSC对肾缺血再灌注损伤有一定的修复作用,伴随着肾组织miR-26a表达量的增加。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全球有10%的慢性肾脏疾病进展为慢性肾功能不全、尿毒症。对于终末期肾脏病,肾移植的治疗效果优于透析,能提高生存率和生存质量,因此肾移植是目前肾衰竭患者最有效的治疗方式[1,2,3]。缺血再灌注损伤(ischemia reperfusion injury,IRI)是影响移植肾最主要的抗原非依赖性非免疫因素之一,它参与多种肾脏疾病的发生发展,如急慢性肾衰竭、移植后急慢性排斥反应[4]。近年来,干细胞的治疗成为防治IRI研究的热点之一。
干细胞具有多向分化潜能和自我更新的特点,已有不少报道骨髓干细胞修复肾脏损伤的研究[5,6,7,8],但存在一定争议。相比之下,后肾间充质干细胞(metanephros mesenchymal stem cells,MMSC)是一类直接参与肾脏发生的干细胞,MMSC和来源于中肾导管的输尿管芽(UB)交互作用发育成哺乳类动物的后肾。此外,有研究证明MMSC在原位能长出新的肾脏[9],和UB一起移植,MMSC能分化形成具有正常肾脏的结构[10]。
微小RNA(microRNA,miRNA)是一类长19~25个核苷酸的非编码单链小分子RNA[11]。微小RNA-26a(miR-26a)在多种恶性肿瘤中出现下调,如肝癌[12]、鼻咽癌[13]、肺癌[14,15]、乳腺癌[16]和Burkitt淋巴瘤[17], miR-26a过表达能引起细胞凋亡[12,13,15,16,17]。最近研究发现,miR-26a的过表达能缓解IRI [18]。
本研究通过建立小鼠肾IRI模型,观察MMSC对肾IRI的作用以及miR-26a的表达差异,初步探讨MMSC与miR-26a之间的联系。
SPF级C57BL/6健康雄性小鼠,8~10周龄,体质量20~25 g,北京维通利华实验动物技术有限公司购置,SCXK(京)2012-0001,由浙江大学医学院附属第一医院实验动物中心统一饲养。动物实验伦理批号:zju2015-049-01。
异氟烷(河北一品制药有限公司)、Ⅴ型胶原酶(美国Sigma公司)、胎牛血清(FBS)及DMEM/F12培养基(美国GIBCO公司)、红细胞裂解液(达文生物有限公司)、生理盐水(杭州民生药业有限公司)、磷酸盐缓冲液(PBS)(吉诺生物医药技术有限公司)。
实验小鼠分为正常组(n=5)和实验组(n=30)。正常组予开腹但不进行肾IRI处理。实验组进行肾IRI处理,根据实验过程中接受的注射物不同,实验组小鼠再分为两个亚组:(1)缺血再灌注组:IRI处理后立刻股静脉注射10 ml/kg的生理盐水;(2)细胞治疗组:IRI处理后立刻股静脉注射10 ml/kg的含5×105个MMSC的生理盐水。正常组和实验组术后12、24、72 h各取5只小鼠全血和肾脏进行下一步实验。
小鼠术前用吸入式小动物麻醉机进行麻醉,麻醉试剂为浓度2%的异氟烷,氧气流速0.4 L/min。麻醉后取腹正中切口,充分暴露右肾,显微镜下大尖镊分离肾筋膜,游离肾蒂,在靠近肾脏处电离器切除肾蒂,同样方法暴露左肾,用无创血管夹阻断左侧肾动脉35 min,期间置于20~25 ℃温箱内并维持吸入性麻醉,切口覆以生理盐水浸润的纱布,到阻断时间则取夹缝合。
将成年健康C57BL/6小鼠按雌雄2∶1合笼,次日分笼,得12.5 d的孕鼠。颈椎脱臼法处死孕鼠,取胚胎得到胚鼠,在解剖显微镜下获取胚肾,并置于4 ℃预冷的DMEM培养基中,用无菌刀片切碎小鼠胚胎肾组织后加入0.1%的胶原酶37 ℃下消化15 min,以胎牛血清终止消化,轻轻吹打细胞后经BD Falcon 40 μm细胞过滤器过滤,400 ×g离心10 min,红细胞裂解液去除红细胞,PBS重悬后,获得胚胎MMSC悬液,细胞计数,最后生理盐水重悬。
经小鼠眼球取正常组及实验组术后12、24和72 h全血,2 000 ×g离心10 min,收集上层血清,使用干式生化仪检测SCr水平,评价肾脏功能。
从-80 ℃保存的各组小鼠肾组织中取半粒绿豆大小组织,装于加入Trizol的EP管中过夜,第2日提取肾组织总RNA。Nanodrop测定提取的总RNA量。miR-26a与标准化内参U6小核RNA(small nuclearRNA,snRNA)共同逆转录,逆转录产物染料法进行实时定量PCR反应,最后在结果中计算miR-26a的相对表达量。
取各组小鼠术后24 h肾组织样本,经4%多聚甲醛固定、脱水、石蜡包埋后,制成石蜡切片,进行HE、PAS染色,初步评价组织病理学情况。此外,在HE染色的肾组织病变严重处,采用Paller氏评分评估肾小管损伤程度,即在400倍高倍镜下,取10个高倍镜视野合计100个肾小管,肾小管明显扩张、细胞扁平(1分);肾小管内出现管型(2分);肾小管官腔内有脱落、坏死的细胞,但未成管型或细胞碎片(1分);上皮细胞颗粒变性(1分);空泡变性(1分);细胞核固缩(1分)。
数据分析采用SPSS 19.0统计软件。计量资料用 ±s表示。多组均数的比较采用单因素方差分析,P<0.05为差异有统计学意义。Graphpad Prism 5.0统计软件进行作图。
±s表示。多组均数的比较采用单因素方差分析,P<0.05为差异有统计学意义。Graphpad Prism 5.0统计软件进行作图。
如表1所示,缺血再灌注组术后12、24、72 h的SCr均高于正常组,且术后24 h的SCr高于术后12、72 h(均P<0.05);术后12和72 h之间SCr差异无统计学意义。细胞治疗组术后12、24、72 h的SCr均高于正常组,且术后24 h的SCr高于术后12、72 h(均P<0.05);术后12和72 h之间SCr差异无统计学意义。术后12、24、72 h,缺血再灌注组和细胞治疗组间的SCr差异均无统计学意义(P>0.05)。

各组小鼠不同时间点的血清肌酐水平(n=5, ±s)
±s)
各组小鼠不同时间点的血清肌酐水平(n=5, ±s)
±s)
| 组别 | 血清肌酐(μmol/L) | |
|---|---|---|
| 正常组 | 28.8±11.4 | |
| 缺血再灌注组 | ||
| 术后12 h | 194.8±41.8ab | |
| 术后24 h | 415.2±125.8a | |
| 术后72 h | 250.2±143.9ab | |
| 细胞治疗组 | ||
| 术后12 h | 197.2±41.8ab | |
| 术后24 h | 315.0±26.1a | |
| 术后72 h | 158.4±119.6ab | |
注:与正常组比较,aP<0.05;组内与术后24 h比较,bP<0.05
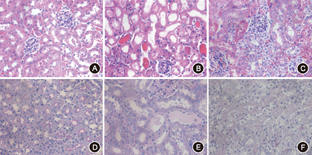
如表2所示,缺血再灌注组和细胞治疗组术后12、24、72 h的肾小管Paller氏评分均高于对照组,且24 h评分高于72 h评分,72 h评分高于12 h评分(均P<0.05);在术后24 h,细胞治疗组的Paller氏评分低于缺血再灌注组(P<0.05)。与正常组和细胞治疗组相比,缺血再灌注组术后24 h可见明显的蛋白管型,肾小管萎缩、肿胀(图1)。

各组小鼠不同时间点的肾小管评分(n=5, ±s)
±s)
各组小鼠不同时间点的肾小管评分(n=5, ±s)
±s)
| 组别 | 肾小管评分(分) | |
|---|---|---|
| 正常组 | 10.0±2.6 | |
| 缺血再灌注组 | ||
| 术后12 h | 25.0±4.0a | |
| 术后24 h | 70.8±14.8ab | |
| 术后72 h | 52.6±7.4abc | |
| 细胞治疗组 | ||
| 术后12 h | 22.4±4.6a | |
| 术后24 h | 57.2±6.3abd | |
| 术后72 h | 34.8±9.2abc | |
注:与正常组比较,aP<0.05;组内:与术后12 h比较bP<0.05,与术后24 h比较cP<0.05;与同一个时间点缺血再灌注组比较,dP<0.05

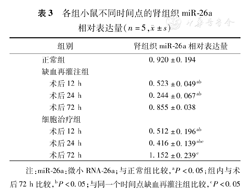
如表3所示,缺血再灌注组术后12、24 h的肾组织miR-26a相对表达量均低于正常组,且72 h肾组织miR-26a高于12、24 h肾组织miR-26a(均P<0.05);细胞治疗组术后12、24 h的肾组织miR-26a相对表达量均低于正常组,且72 h肾组织miR-26a高于12、24 h肾组织miR-26a(均P<0.05);在术后24、72 h,细胞治疗组肾组织miR-26a相对表达量明显高于缺血再灌注组(均P<0.05)。
各组小鼠不同时间点的肾组织miR-26a相对表达量(n=5, ±s)
±s)
各组小鼠不同时间点的肾组织miR-26a相对表达量(n=5, ±s)
±s)
| 组别 | 肾组织miR-26a相对表达量 | |
|---|---|---|
| 正常组 | 0.920±0.194 | |
| 缺血再灌注组 | ||
| 术后12 h | 0.523±0.049ab | |
| 术后24 h | 0.244±0.067ab | |
| 术后72 h | 0.855±0.038 | |
| 细胞治疗组 | ||
| 术后12 h | 0.512±0.196ab | |
| 术后24 h | 0.416±0.139abc | |
| 术后72 h | 1.152±0.239c | |
注:miR-26a:微小RNA-26a;与正常组比较,aP<0.05;组内与术后72 h比较,bP<0.05;与同一个时间点缺血再灌注组比较,cP<0.05
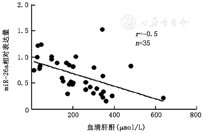
相关性分析显示,小鼠的肾组织miR-26a与SCr呈负相关(r=-0.5,P<0.05) (图2)。

尽管肾移植取得很大的进展,但是肾功能不全的发生率仍较高,IRI一直是肾移植不可避免的一个关键问题。所以,减少IRI,对防止急性排斥反应的发生及促进移植肾延迟恢复,进而提高移植肾长期生存率具有重要意义。
本研究通过观测术后不同时间点SCr和病理的改变,确定小鼠肾IRI模型是否成功。小鼠进行肾IRI手术处理后,SCr开始逐渐上升,在24 h达到高峰后逐渐下降,但仍高于SCr正常水平,且术后24 h的肾脏病理变化也最显著[14]。本次研究结果中,无论是缺血再灌注组还是细胞治疗组中SCr的情况,与以往的一些研究结果一致,说明造模成功。SCr的这种变化趋势,很有可能因为小鼠自身修复系统的启动,肾脏损伤后期出现缓解。
肾IRI术后,肾组织的miR-26a开始逐渐降低,在72 h又有所回升。分析两者的关系,发现肾组织miR-26a表达量和SCr负相关,此结果与近年来提出的miR-26a过表达能缓解IRI[18]观点类似。
本研究发现,在术后24 h,尽管SCr差异无统计学意义,但细胞治疗组的Paller氏评分低于缺血再灌注组,MMSC对肾IRI仍有一定的修复作用;在术后24和72 h,细胞治疗组的miR-26a水平显著高于缺血再灌注组,由此可见,对于细胞的输注,肾组织miR-26a反应比SCr更敏感。所以,MMSC对肾IRI有一定的修复作用,伴随着肾组织miR-26a表达量的增加。
miRNA通过调节mRNA和蛋白的翻译来调节基因的表达,可见miRNA引起一些促炎因子的表达[19],有研究表明miR-26a的过表达能提高叉头蛋白p3+CD4+调节细胞的表达,升高白细胞介素10,降低白细胞介素6、17和干扰素的水平[18]。我们猜测,MMSC对肾IRI有一定的修复作用,可能和miR-26a调控的下游基因的转录产物有关,只是具体涉及哪些细胞因子的变化有待进一步研究。



























