
评价非原位肝切除术(ESLR)治疗侵犯肝静脉回流区域肝脏肿瘤的可行性、安全性和疗效。
检索中国知网、万方数据库、维普数据库、PubMed、Medline、Embase、Chochrane、国际临床移植注册平台、移植电子图书馆等数据库,系统评价可行性、安全性和肿瘤疗效,就其中转异体移植率、并发症发生率、90 d死亡率进行总结分析。
共有46篇文献报道191例ESLR(其中自体肝移植术101例,半离体肝切除术90例)。最常见的手术适应证是肝细胞癌(49例),其次为结肠癌肝转移(37例)、肝泡型包虫病(33例)、胆管细胞癌(26例)。手术成功率为84.5%(CI=76.6%~90.1%)、中转异体移植率为13.5%(CI=8.5%~21.0%)、总并发症发生率为58.1%(CI=48.5%~67.1%)、Ⅲa级以上并发症发生率为43.1%(CI=33.6%~53.1%)和90 d死亡率为19.5% (CI=12.7%~28.8%)。
ESLR是治疗侵犯肝静脉汇合区和肝后下腔静脉肿瘤的有效治疗措施。严格把握手术适应证、术前精确评估自体供肝"质和量"及精准的外科操作是手术成功的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近两个世纪以来,肝脏解剖和肝再生的神秘"面纱"不断被揭开。随着精准肝脏外科理念的广泛接受和手术技术的不断改进,肝脏外科医生驾驭肝脏的能力亦不断提升。目前,解剖性肝切除、原位肝移植、门静脉栓塞、二期肝切除和联合肝脏分割与门静脉结扎的分期肝切除术(ALPPS)等已成为肝脏外科的常规术式[1]。多少年来,肝脏外科医生一直致力于寻找保障肝脏"质和量"的平衡点[2]。当肿瘤累及肝静脉-腔静脉汇合区、肝后下腔静脉伴或不伴有第一肝门Glisson鞘受侵时,常规肝切除技术可能导致不可控制的出血、术后肝功能衰竭,而且可能无法保障肿瘤的R0切除。尽管肝移植术是可能的治疗措施之一,然而,供肝缺乏、伦理考虑、已超出米兰或杭州标准等因素在一定程度上制约移植技术的开展。于1988年德国Pichlmayr等[3]实施首例非原位肝切除术(Ex-situ liver resection, ESLR)治疗肝脏肿瘤。起初,该技术被命名为"离体非原位"肝切除术,亦即"自体肝移植术"。此后,Sauvanet等[4]报道"在体非原位"肝切除术,亦即"半离体肝切除术"。ESLR具有无需供肝、无需长期使用免疫抑制药物等特点。国内温浩等于2006年实施首例自体肝移植术治疗肝内胆管癌获得成功[5]。另于2010年,温浩团队国内外首次采用自体肝移植术治疗终末期肝泡型包虫病获得成功[6]。目前,该项技术在术式命名、适应证、围手术期处理和术后并发症等方面尚存一定的争议。因此,本研究旨在通过对全球文献进行系统分析,探讨ESLR的可行性、安全性和有效性。
以Ex vivo、Ex situ、Extracorporeal、Autologous、Ante situm or ante-situm、Bench resection、hepatectomy、liver transplantation、liver or hepatic autotransplant、liver or hepatic transplant、liver or hepatic resection、非原位肝切除、自体肝移植、半离体肝切除、体外肝切除、离体肝切除、全肝切除为检索词,在中国知网、万方数据库、维普数据库、Medline、Embase、Chochrane、国际临床移植注册平台、移植电子图书馆等数据库检索文献,检索时间为建库至2015年10月。
(1)国内、外公开发表的有关非原位肝切除术(自体肝移植术和半离体肝切除术)的文献;(2)研究语种限中、英文;(3)相关的队列研究、病例系列报道和个案报道;(4)干预措施应为非原位肝切除术;(5)结局指标为手术可行性、中转异体移植率、总体并发症和Clavien-DindoⅢa以上并发症发生率、90 d死亡率。
动物实验研究、基础研究、综述、会议摘要和重复发表的文献。
将文献导入至Endnote X5软件,以便于进行除重、查阅等文献管理操作。由两位文献评价员独立筛选文献和提取资料,并交叉核对,如遇分歧,则交由第3位研究者裁决,缺失的资料尽可能与原作者联系予以补充。资料提取内容主要包括:第1作者、发表年份、国家、例数、年龄、性别构成、器官保存液种类及量、灌注途径、冷/热缺血时间和术后随访时间等。
本研究所纳入的文献有回顾性病例研究和个案报道,文献评价工作由两位文献评价员按照Oxford医学证据等级进行评价。在原文献的基础上,数据以参数或非参数的形式展现。运用软件Comprehensive Meta-Analysis (Biostat, Englewood, NJ,美国)进行分析。
共筛选出符合纳入标准的46篇文献和191例患者进行分析,文献筛选流程见图1。其中,有19篇文献报道了2例及以上的患者,余27篇均为个案报道。对19篇包含164例患者的文献进行定量分析研究。共有191例患者接受非原位肝切除术,其中中国83例、德国55例、日本15例、英国14例、法国9例、美国7例,其余8例来自其他国家。患者年龄波动在15~71岁,男女性别比例在138例患者中为76∶62,余53例未述及性别(表1,表2)。
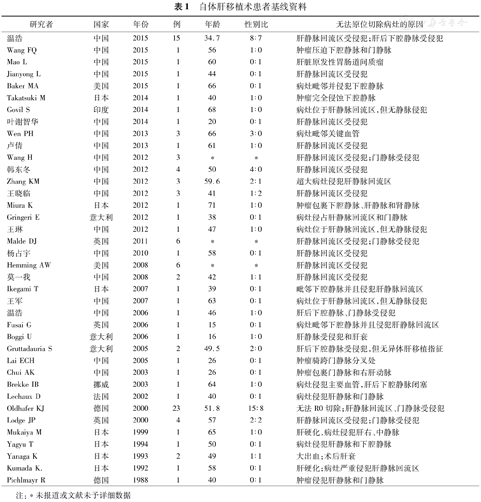
自体肝移植术患者基线资料
自体肝移植术患者基线资料
| 研究者 | 国家 | 年份 | 例 | 年龄 | 性别比 | 无法原位切除病灶的原因 |
|---|---|---|---|---|---|---|
| 温浩 | 中国 | 2015 | 15 | 34.7 | 8∶7 | 肝静脉回流区受侵犯;肝后下腔静脉受侵犯 |
| Wang FQ | 中国 | 2015 | 1 | 56 | 1∶0 | 肿瘤压迫下腔静脉和门静脉 |
| Mao L | 中国 | 2015 | 1 | 60 | 0∶1 | 肝脏原发性胃肠道间质瘤 |
| Jianyong L | 中国 | 2015 | 1 | 44 | 0∶1 | 肝静脉回流区受侵犯 |
| Baker MA | 美国 | 2015 | 1 | 66 | 0∶1 | 病灶毗邻并侵犯下腔静脉 |
| Takatsuki M | 日本 | 2014 | 1 | 40 | 1∶0 | 肿瘤完全侵蚀下腔静脉 |
| Govil S | 印度 | 2014 | 1 | 68 | 1∶0 | 病灶位于肝静脉回流区,但无静脉侵犯 |
| 叶谢智华 | 中国 | 2014 | 1 | 20 | 0∶1 | 肝静脉回流区受侵犯 |
| Wen PH | 中国 | 2013 | 3 | 66 | 3∶0 | 病灶毗邻关键血管 |
| 卢倩 | 中国 | 2013 | 1 | 61 | 1∶0 | 肝静脉回流区受侵犯 |
| Wang H | 中国 | 2012 | 3 | * | * | 肝静脉回流区受侵犯;门静脉受侵犯 |
| 韩东冬 | 中国 | 2012 | 4 | 50 | 4∶0 | 肝静脉回流区受侵犯 |
| Zhang KM | 中国 | 2012 | 3 | 59.6 | 2∶1 | 超大病灶侵犯肝静脉回流区 |
| 王晓临 | 中国 | 2012 | 3 | 41 | 1∶2 | 肝静脉回流区受侵犯 |
| Miura K | 日本 | 2012 | 1 | 71 | 1∶0 | 肿瘤包裹下腔静脉、肝静脉和肾静脉 |
| Gringeri E | 意大利 | 2012 | 1 | 38 | 0∶1 | 病灶侵占肝静脉回流区和门静脉 |
| 王琳 | 中国 | 2012 | 1 | 47 | 1∶0 | 病灶位于肝静脉回流区,但无静脉侵犯 |
| Malde DJ | 英国 | 2011 | 6 | * | * | 肝静脉回流区受侵犯;门静脉受侵犯 |
| 杨占宇 | 中国 | 2010 | 1 | 58 | 0∶1 | 肝静脉回流区受侵犯 |
| Hemming AW | 美国 | 2008 | 6 | * | * | 肝静脉回流区受侵犯 |
| 莫一我 | 中国 | 2008 | 2 | 42 | 1∶1 | 肝静脉回流区受侵犯 |
| Ikegami T | 日本 | 2007 | 1 | 39 | 0∶1 | 毗邻下腔静脉并且侵犯肝静脉回流区 |
| 王军 | 中国 | 2007 | 1 | 63 | 0∶1 | 病灶位于肝静脉回流区,但无静脉侵犯 |
| 温浩 | 中国 | 2006 | 1 | 46 | 1∶0 | 肝后下腔静脉、门静脉受侵犯 |
| Fusai G | 英国 | 2006 | 1 | 15 | 0∶1 | 病灶毗邻下腔静脉并且侵犯肝静脉回流区 |
| Boggi U | 意大利 | 2006 | 1 | 16 | 1∶0 | 肝静脉受侵犯和肝衰 |
| Gruttadauria S | 意大利 | 2005 | 2 | 49.5 | 2∶0 | 肝后下腔静脉受侵犯,但无异体肝移植指征 |
| Lai ECH | 中国 | 2005 | 1 | 26 | 0∶1 | 肿瘤骑跨门静脉分叉处 |
| Chui AK | 中国 | 2003 | 1 | 26 | 0∶1 | 肿瘤包裹门静脉和右肝动脉 |
| Brekke IB | 挪威 | 2003 | 1 | 64 | 1∶0 | 病灶侵犯主要血管,肝后下腔静脉闭塞 |
| Lechaux D | 法国 | 2002 | 1 | 40 | 0∶1 | 病灶侵犯肝静脉和门静脉 |
| Oldhafer KJ | 德国 | 2000 | 23 | 51.8 | 15∶8 | 无法R0切除;肝静脉回流区、门静脉受侵犯 |
| Lodge JP | 英国 | 2000 | 4 | 57 | 2∶2 | 肝静脉回流区受侵犯;门静脉受侵犯 |
| Mukaiya M | 日本 | 1999 | 1 | 65 | 1∶0 | 肝硬化,病灶侵犯肝右、中静脉 |
| Yagyu T | 日本 | 1994 | 1 | 50 | 0∶1 | 病灶侵犯肝静脉和下腔静脉 |
| Yanaga K | 日本 | 1993 | 2 | 49 | 1∶1 | 大出血;术后肝衰 |
| Kumada K. | 日本 | 1992 | 1 | 58 | 0∶1 | 肝硬化;病灶严重侵犯肝静脉回流区 |
| Pichlmayr R | 德国 | 1988 | 1 | 40 | 0∶1 | 肿瘤侵犯肝静脉和门静脉 |
注:*未报道或文献未予详细数据
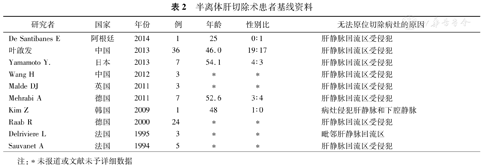
半离体肝切除术患者基线资料
半离体肝切除术患者基线资料
| 研究者 | 国家 | 年份 | 例 | 年龄 | 性别比 | 无法原位切除病灶的原因 |
|---|---|---|---|---|---|---|
| De Santibanes E | 阿根廷 | 2014 | 1 | 25 | 0∶1 | 肝静脉回流区受侵犯 |
| 叶啟发 | 中国 | 2013 | 36 | 46.0 | 19∶17 | 肝静脉回流区受侵犯 |
| Yamamoto Y. | 日本 | 2013 | 7 | 54.1 | 4∶3 | 肝静脉回流区受侵犯 |
| Wang H | 中国 | 2012 | 3 | * | * | 肝静脉回流区受侵犯 |
| Malde DJ | 英国 | 2011 | 3 | * | * | 肝静脉回流区受侵犯 |
| Mehrabi A | 德国 | 2011 | 7 | 52.6 | 3∶4 | 肝静脉回流区受侵犯 |
| Kim Z | 韩国 | 2009 | 1 | 48 | 1∶0 | 病灶侵犯肝静脉和下腔静脉 |
| Raab R | 德国 | 2000 | 24 | * | * | 肝静脉回流区受侵犯 |
| Delriviere L | 法国 | 1995 | 3 | * | * | 毗邻肝静脉回流区 |
| Sauvanet A | 法国 | 1994 | 5 | * | * | 肝静脉回流区受侵犯 |
注:*未报道或文献未予详细数据

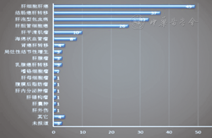
研究报道非原位肝切除术主要应用于侵犯3个肝静脉、肝后下腔静脉和(或)第一肝门病灶的根治性切除。研究结果表明,非原位肝切除最常见适应证为肝细胞肝癌(49/191),其次为结肠癌肝转移(37/191)、肝泡型包虫病(33/191)、胆管细胞癌(26/191)和其他占位性病变(46/191)(图2)。

在191例患者中,65例患者术前应用三维重建对肝脏体积和脉管侵犯进行了评估(未述及126例)。多学科诊治讨论(MDT)模式应用于46例患者手术方案的制定和围手术期管理实践中。8例患者在术前进行腹腔镜探查判断可切除性后再行非原位肝切除术。另有8例患者术前备异体供肝以备可能的异体肝移植。
非原位肝切除术包括自体肝移植术和半离体肝切除术,本研究共有101例自体肝移植术和90例半离体肝切除术。文献中手术方式命名存在差异:(1) 36篇英文文献命名方式有:ex situ、ex situ ex vivo、ex vivo、in vivo ex situ、antesitum, extracorporeal、bench resection、liver autotransplantation等;(2) 10篇中文文献表述方式有:半离体肝移植术、离体肝切除联合剩余肝脏自体移植术、体外肝切除联合自体肝移植术、离体肝切除自体肝移植术、全离体肝切除术等。
1.手术时长为257~1 380 min,无肝时间为62~401 min。术中分别用超声吸引手术刀(CUSA)和水刀切开、解剖、分离肝组织。本研究中,共有159例行静脉-静脉转流,56例行暂时性门体分流,32例行临时下腔静脉重建技术。器官保存液的应用方面,有83例用HTK(Histidine-tryptophan-ketoglutarate)灌注液,有95例用UW(University of Wisconsin )灌注液,有1例用Euro-Collin灌注液。移植方式最常见者为原位移植(137/191),有2例行背驮式肝移植,2例行异位移植。血管重建过程中大隐静脉、颈外静脉、髂内静脉、肝圆韧带、自体腔静脉转移和冷藏血管是常用的选择。
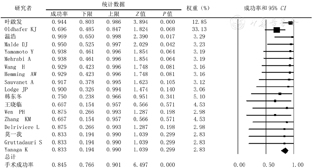
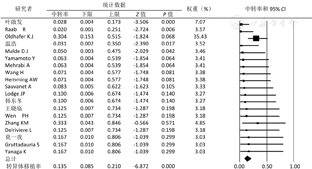
2.手术成功率和中转异体移植率:非原位肝切除术成功完成于182例患者,余9例中转行异体肝移植术。手术成功率为84.5%(CI=76.6%~90.1%),中转异体移植率13.5%(CI=8.5%~21.0%)(图3,图4)。


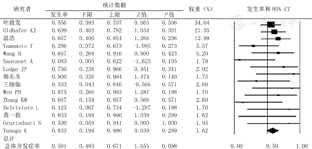
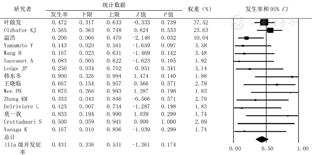
由于各文献未严格遵循Clavien-Dindo分类法的标准化并发症分类,很难从当前的研究中描述出客观的并发症。本研究中术后并发症(围手术期并发症或近期并发症)主要是:小肝综合征(Small for size syndrome,SFSS)、胆漏、出血、肺部感染、肺水肿、胸腔积液、结肠瘘、肾功能不全、肝血管扭转。共有109例患者述及并发症,总并发症发生率为58.1%(CI=48.5%~67.1%),Clavien-DindoⅢa级以上并发症发生率为43.1%(CI=33.6%~53.1%),90 d死亡率为19.5%(CI=12.7%~28.8%)(图5,图6,图7)。


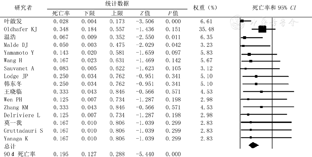

尽管9例行中转异体肝移植术,但所有患者(100%)得到了完全性病灶切除术(R0切除)。总体生存率和无瘤生存率在文献中少有报道,因患者数量过少,且仅有少数文献报道术后带瘤及无瘤生存率。
自1988年Pichlmayr等[3]第一次描述非原位肝切除术治疗"不可切除"肝脏肿瘤以来,全球肝脏外科中心共报道191例患者。我国首例自体肝移植术由我中心温浩教授于2006年成功实施[5],此外,温浩教授团队自2010年完成国内外首例自体肝移植术治疗终末期肝脏泡型包虫病患者以来[6],共完成32例并获得长期治愈。
至今,自体肝移植相关术式命名仍尚未完全统一。一般来讲,非原位肝切除术是指肝脏离开原有解剖部位后进行切除,主要包括"在体非原位"(ex situ in vivo)和"离体非原位"(ex situ ex vivo)两种术式。肝脏切除过程中,肝脏尚未完全离开体内正常的解剖位置,仅以部分结构(如血管)与人体相连,该技术被称为"在体非原位"肝切除术或"半离体"肝切除术。若将肝脏完全移出体外进行瘤体切除后移回到原位,则被称为"离体非原位"、"体外肝切除术"或"自体肝移植技术"。作者根据临床经验,建议将前者统称为半离体肝切除术(ante situm liver resection),而将后者命名为自体肝移植术(Autologous liver transplantation, ALT),则更为简明、易记而不混淆概念,供同行参考讨论以便规范术式命名法。
非原位肝切除术的主要优势在于它无需供肝、可达到根治切除、全方位观察瘤体和避免使用免疫抑制药物。从解剖角度来讲,非原位肝切除术为侵犯肝后下腔静脉、肝静脉-腔静脉汇合区伴或不伴有第一肝门的肝脏或肝外肿瘤提供了根治的可能。本研究结果表明,自体肝移植术和半离体肝切除术适应证主要包括肝脏或肝外恶性肿瘤、良性肿瘤和肝脏外伤导致肝静脉汇合区撕裂的患者。其中,肝细胞肝癌、结肠癌肝转移、肝脏泡型包虫病和胆管细胞癌是最为常见的适应证。我中心基于32例自体肝移植术治疗终末期肝脏泡型包虫病的临床经验,探讨自体肝移植术可能的手术指征如下:(1)肝后下腔静脉受严重压迫,浸润甚至堵塞者(长度>1.5 cm,周径>120°);(2)肝静脉汇合区和第一肝门严重受侵;(3)自体供肝体积应>40%标准肝体积而且功能正常;(4)合并梗阻性黄疸患者需行PTCD或其他措施以减轻或降低TBIL至<60 μmol/L (正常水平的2倍);(5)合并有慢性肝脏淤血(如慢性布加氏综合征,Budd-Chiari syndrome/BCS)的患者应谨慎实施[7]。
早期临床研究报道了较高的中转异体移植率、死亡率和并发症发生率[8]。因此,对于恶性肿瘤患者实施自体肝移植术或半离体肝切除术前需慎重考虑。目前认为,肝脏潜在的病理改变、胆汁淤积、潜在的基础肝脏病变是影响非原位肝切除术的重要影响因素。因此,术前精确评估自体供肝的"质和量"是成功的关键。合并有胆汁淤积[9]、脂肪肝[10]、肝硬化[11]和既往有化疗栓塞术病史的患者应按"边缘供体"来对待[12]。合并有术前梗阻性黄疸的患者术前应实施PTCD减黄,必要时可考虑肝穿刺活检或经腹腔镜探查。吲哚青绿清除试验、核素扫描等可客观评价供肝功能。由肝脏外科、肝病内科、介入科、影像科和麻醉医师的MDT团队在评估手术风险和实施非原位肝切除术决策的制定过程中起举足轻重的作用[13]。
静脉-静脉转流技术应用于早期的临床实践过程中,然而,肺动脉栓塞、缺血-再灌注综合征等并发症发生率高达30%[14]。因此,近年来,临时性肝后下腔静脉重建和门体分离技术已广泛应用,以保证非原位肝切除技术无肝期血流动力学稳定[11]。有研究指出、肿瘤长期压迫、甚至闭塞肝后下腔静脉的情况下,有充分的侧支循环建立保证体循环和(或)门静脉血流的回流,因此经术前行3D重建和静脉造影评价侧支循环和术中严密观察的前提下,可不进行转流或重建亦能保证血流动力学稳定[8]。切取肝脏后,台下采用器官保存液冷灌注的同时进行瘤体切除。本研究结果表明,UW和HTK是非原位肝切除技术过程中最为常用的灌注液。自体肝原位移植是首选方案,而Lechaux等[15]报道了有关异位自体肝移植的经验并取得良好的疗效。
非原位肝切除术过程充分体现外科技术和艺术的完美结合。血管和胆道重建存在多样性和复杂性,常常需要根据每一例患者的特点进行个性化的设计。其中,静脉重建的选择呈多样化,如自体腔静脉转移技术、人造血管、自体颈静脉、大隐静脉、肝圆韧带、髂内静脉和异体血管等提供了可能的重建材料。近期研究表明,壁腹膜亦同样成为具有前景的自体血管材料[16]。本研究结果表明,手术成功率为84.5%(CI=76.6%~90.1%),中转异体移植率占13.5%(CI=8.5%~21.0%),总并发症发生率为58.1%(CI=48.5%~67.1%),Ⅲa级以上并发症发生率为43.1%(CI=33.6%~53.1%),90 d死亡率为19.5%(CI=12.7%~28.8%)。肝功能不全仍是非原位肝切除术后最为常见的并发症,因此,精确评估并保证足够的"功能肝"和"体积肝"是手术成功的关键。
总之,非原位肝切除术是治疗侵犯肝静脉汇合区和肝后下腔静脉肿瘤的有效可选治疗措施之一。严格把握手术适应证、术前精确评估自体供肝"质和量"及精准外科操作是手术成功的关键。



























