
探讨早期乳酸面积对老年脓毒性休克患者预后的评估价值。
2012年1月至2013年12月入住山东大学齐鲁医院重症医学科的115例年龄≥65岁的脓毒性休克患者,每6小时监测血乳酸水平,记录早期乳酸面积和急性生理与慢性健康评分(APACHE)Ⅱ等指标。
患者28 d病死率为67.0%,呼吸道、腹腔和血流为最常见的原发感染灶。与存活组相比,病死组患者早期乳酸面积和APACHEⅡ明显升高[(27.4±7.6)比( 20.3±6.5)],乳酸清除率更低,接受机械通气、肾脏替代和≥3 d的血管活性药物治疗者更多,更易出现心血管、呼吸和肝、肾功能障碍(均P<0.05)。受试者工作特征曲线显示,早期乳酸面积能有效预测患者28 d病死率(AUC值0.758,P<0.01),预测价值明显高于初始乳酸值和乳酸清除率(均P<0.05)。
早期乳酸面积能有效评估对老年脓毒性休克患者预后,且优于其他乳酸指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
老年人合并的基础疾病较多,免疫力低下,容易发生脓毒症并进展为脓毒性休克[1]。脓毒性休克的病死率高达50%[2],而老年患者病死率更高[3]。早期实施临床干预、改善老年患者预后至关重要[4]。乳酸是脓毒症重要的代谢指标。组织细胞缺血缺氧导致细胞供能方式由线粒体氧化磷酸化转变成糖酵解,从而产生乳酸[5]。乳酸在体内过量蓄积与多脏器功能不全的发生和病死率增加有关[6]。初始血乳酸值和乳酸清除率是较常用的指标[7,8]。但上述指标难以反映脓毒症早期乳酸在体内蓄积的总量。早期乳酸面积可弥补上述不足;儿童脓毒性休克患者中,该指标能独立预测患儿28 d病死率,是评估预后的有效因子[9]。但在老年脓毒性休克患者中其有效性尚未证实。本研究拟探讨早期乳酸面积在老年脓毒性休克患者中的预后评估价值。
2012年1月至2013年12月山东大学齐鲁医院重症医学科(ICU)年龄≥65岁且存在脓毒性休克的患者158例。纳入标准:脓毒症定义为感染引起的全身炎症反应综合征,伴有确定的或高度怀疑的感染[10]。脓毒性休克定义为脓毒症合并急性循环衰竭,表现为用其他原因无法解释的低血压,在充足液体复苏下,收缩压(SBP)仍<90 mmHg(1 mmHg=0.133 kPa)、平均动脉压<60 mmHg,或SBP较基线水平下降达40 mmHg[10]。使用脓毒症序贯脏器衰竭评分(SOFA)来判断患者是否存在系统或脏器功能不全[11]。排除标准:入住ICU时间<72 h(30例);患者家属放弃积极治疗(2例);入组前存在癫痫(8例)、恶性心律失常或心跳骤停;需急症手术(3例)。
采集患者一般情况、基础疾病、病原学、实验室检查结果等资料,使用APACHEⅡ评分和SOFA评分评估患者发生脓毒性休克时的病情严重程度,并通过医院信息系统或电话随访获得患者随后28 d内的生存资料。所有患者均按照美国重症医学会临床治疗指南进行[10]。
使用GEM Premier 3000型血气分析仪(美国Instrumentation Laboratory公司)测定动脉血乳酸水平。在患者入住ICU的前24 h内,每6小时监测1次血乳酸水平。首次测量在入住ICU的30 min内进行,定义为初始乳酸值。乳酸清除率计算方式为:(初始乳酸值-入ICU 24 h后的血乳酸值)/初始乳酸值。计算入ICU的24 h内乳酸监测曲线下的面积(trape-zoidal法,即为早期乳酸面积)[9]。脏器功能不全参考SOFA评估中心血管、呼吸、中枢神经系统、肾脏、肝脏等脏器,单个脏器赋分≥2分视为存在脏器功能不全。
使用SPSS 16.0统计软件包进行统计学分析。正态分布或近似正态分布的计量资料以 ±s表示,组间比较使用独立样本t检验。偏态分布的计量资料以中位数及四分位距表示,组间比较使用秩和检验。计数资料以百分比表示,组间比较使用χ2检验或Fisher确切概率法检验。使用受试者工作特征(ROC)曲线,计算不同乳酸指标预测28 d病死率的曲线下面积(AUC),并计算早期乳酸面积预测死亡率的截断值,使用Hanley和McNeil法进行不同ROC曲线之间的比较,P<0.05为差异有统计学意义。
±s表示,组间比较使用独立样本t检验。偏态分布的计量资料以中位数及四分位距表示,组间比较使用秩和检验。计数资料以百分比表示,组间比较使用χ2检验或Fisher确切概率法检验。使用受试者工作特征(ROC)曲线,计算不同乳酸指标预测28 d病死率的曲线下面积(AUC),并计算早期乳酸面积预测死亡率的截断值,使用Hanley和McNeil法进行不同ROC曲线之间的比较,P<0.05为差异有统计学意义。
本研究共纳入115例老年脓毒性休克的患者,年龄(72.9±7.6)岁,76例(66.1%)患者为男性。在发病第28天时共77例患者病死,病死率为67.0%。导致脓毒性休克的3大原发感染灶分别为呼吸道(44.3%)、腹腔(13.9%)和血流(11.3%)。存活组和病死组相比,原发感染灶分布的差异无统计学意义(表1)。
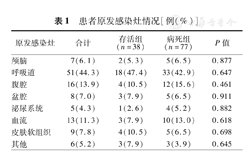
患者原发感染灶情况[例(%)]
患者原发感染灶情况[例(%)]
| 原发感染灶 | 合计 | 存活组(n=38) | 病死组(n=77) | P值 |
|---|---|---|---|---|
| 颅脑 | 7(6.1) | 2(5.3) | 5(6.5) | 0.877 |
| 呼吸道 | 51(44.3) | 18(47.4) | 33(42.9) | 0.647 |
| 腹腔 | 16(13.9) | 4(10.5) | 12(15.6) | 0.461 |
| 盆腔 | 8(7.0) | 3(7.9) | 5(6.5) | 0.911 |
| 泌尿系统 | 5(4.3) | 1(2.6) | 4(5.2) | 0.882 |
| 血流 | 13(11.3) | 3(7.9) | 10(13.0) | 0.618 |
| 皮肤软组织 | 9(7.8) | 4(10.5) | 5(6.5) | 0.698 |
| 其他 | 6(5.2) | 3(7.9) | 3(3.9) | 0.645 |
与存活组相比,病死组患者的乳酸清除率更低[(13.1%±72.0%)比(45.0%±48.7%)],早期乳酸面积[(111.6±47.3)比(84.1±46.3)]和APACHE Ⅱ评分[(27.4±7.6)比( 20.3±6.5)]明显升高(均P<0.05),初始乳酸值虽有所升高,但差异无统计学意义[(5.5±3.6 )mmol/L比(4.5±2.5) mmol/L,P>0.05]。与存活组相比,病死组患者入住ICU时间更短[(8.7±6.7)d比(16.9±15.6)d],存在慢性肾功能不全(40.3%比21.1%)、接受机械通气(79.2%比39.5%)、肾脏替代治疗(46.8%比23.7%)和≥ 3 d的血管活性药物治疗者(94.8%比73.7%)均明显增多,且更容易出现心血管系统(58.4%比36.8%)、呼吸系统(83.1%比52.6%)、肝脏(50.6%比28.9%)和肾脏(71.4%比44.7%)的功能障碍(均P<0.05,表2)。
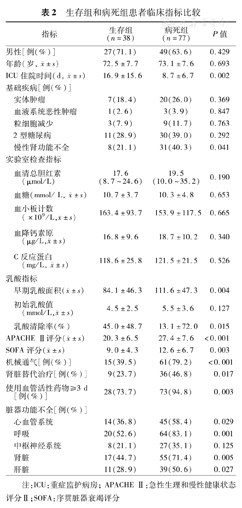
生存组和病死组患者临床指标比较
生存组和病死组患者临床指标比较
| 指标 | 生存组(n=38) | 病死组(n=77) | P值 | |
|---|---|---|---|---|
| 男性[例(%)] | 27(71.1) | 49(63.6) | 0.429 | |
年龄(岁, ±s) ±s) | 72.5±7.7 | 73.1±7.6 | 0.693 | |
ICU住院时间(d ±s) ±s) | 16.9±15.6 | 8.7±6.7 | 0.002 | |
| 基础疾病[例(%)] | ||||
| 实体肿瘤 | 7(18.4) | 20(26.0) | 0.369 | |
| 血液系统恶性肿瘤 | 1(2.6) | 3(3.9) | 0.847 | |
| 粒细胞减少 | 3(7.9) | 9(11.7) | 0.763 | |
| 2型糖尿病 | 11(28.9) | 30(39.0) | 0.292 | |
| 慢性肾功能不全 | 8(21.1) | 31(40.3) | 0.041 | |
| 实验室检查指标 | ||||
| 血清总胆红素(μmol/L) | 17.6(8.7~24.6) | 19.5(10.0~35.2) | 0.190 | |
血糖(mmol/ L ±s) ±s) | 10.7±3.7 | 10.3±4.8 | 0.653 | |
血小板计数(×109/L, ±s) ±s) | 163.4±93.7 | 153.9±117.5 | 0.665 | |
血降钙素原(μg/L, ±s) ±s) | 16.8±9.6 | 18.7±10.2 | 0.340 | |
C反应蛋白(mg/L ±s) ±s) | 118.6±25.8 | 121.5±21.5 | 0.526 | |
| 乳酸指标 | ||||
早期乳酸面积( ±s) ±s) | 84.1±46.3 | 111.6±47.3 | 0.004 | |
初始乳酸值(mmol/L, ±s) ±s) | 4.5±2.5 | 5.5±3.6 | 0.127 | |
| 乳酸清除率(%) | 45.0±48.7 | 13.1±72.0 | 0.015 | |
APACHE Ⅱ评分( ±s) ±s) | 20.3±6.5 | 27.4±7.6 | <0.001 | |
SOFA评分( ±s) ±s) | 9.0±4.3 | 12.6±6.7 | 0.003 | |
| 机械通气[例(%)] | 15(39.5) | 61(79.2) | <0.001 | |
| 肾脏替代治疗[例(%)] | 9(23.7) | 36(46.8) | 0.017 | |
| 使用血管活性药物≥3 d [例(%)] | 28(73.7) | 73(94.8) | 0.003 | |
| 脏器功能不全[例(%)] | ||||
| 心血管系统 | 14(36.8) | 45(58.4) | 0.029 | |
| 呼吸 | 20(52.6) | 64(83.1) | 0.001 | |
| 中枢神经系统 | 8(21.1) | 27(35.1) | 0.125 | |
| 肾脏 | 17(44.7) | 55(71.4) | 0.005 | |
| 肝脏 | 11(28.9) | 39(50.6) | 0.027 | |
注:ICU:重症监护病房;APACHE Ⅱ:急性生理和慢性健康状态评分Ⅱ;SOFA:序贯脏器衰竭评分
早期乳酸面积、初始乳酸值和乳酸清除率均可以有效预测28 d病死率(AUC分别为0.758、0.626、0.669,P值分别为0.001、0.029和0.010,95%可信区间分别为0.659~0.856、0.522~0.731、0.522~0.731,图1)。两两比较发现,早期乳酸面积的ROC曲线的AUC值明显高于初始乳酸值和乳酸清除率(均P<0.05),该指标对死亡率的预测价值最高。
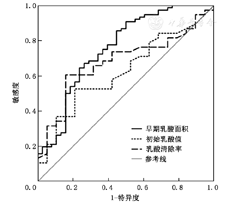

ROC曲线分析提示,当早期乳酸面积截断值为91.2时,预测死亡率的Yuedden指数最高(0.408),预测的灵敏度和特异度分别为0.645(95%可信区间为0.527~0.751)和0.763(95%可信区间为0.598~0.886)。
尽管近年来脓毒症的管理和治疗取得了一些进展,它仍是入住ICU患者的第二大死因[3]。ICU住院人群中,近60%为年龄>65岁的老年患者,且随着全社会的老龄化趋势,该比例还在不断增加[12]。合并的基础疾病较多、体质变差、免疫力下降等诸多因素导致老年人更容易发生感染和脓毒症[1]。有研究预计,到2030年,高龄人口将翻番,因此,老年脓毒症将成为一个全球性的公共卫生问题。
小儿和老年人均为脓毒症的多发人群,发生脓毒症的危险因素也多相似,发生脓毒性休克时,往往伴随不良的预后[13]。但老年脓毒症患者的绝对数量却远高于小儿患者:美国人口中1/5为老年人,但住院的脓毒症患者中老年人的比例却高达2/3,消耗着一半以上的治疗资源[3,14]。与小儿脓毒症相比,老年脓毒症患者病情更为复杂,接受侵袭性治疗的机会更低,恢复更慢,需要更多的护理和出院后康复工作[15]。而且,高龄是脓毒症患者病死的独立危险因素,脓毒症的病死率岁年龄增加,>85岁的脓毒症患者病死率为38.4%,远高于儿童10%的病死率[14]。因此,早期识别高病死风险人群,对早期实施临床干预、改善老年脓毒症患者预后至关重要[4]。
组织器官的缺氧低灌注和应激致高儿茶酚胺血症机制可能是乳酸升高的主要原因[16]。乳酸通过糖酵解途径产生,缺氧情况下葡萄糖生成丙酮酸而后转化为乳酸。此外,交感神经兴奋,肾上腺素分泌增多,肾上腺素与骨骼肌细胞膜的肾上腺素能受体结合,使cAMP产生增多,使线粒体内氧化还原电位向着有利于糖酵解方向进行,也导致高乳酸血症[16]。作为能明确反映组织低灌注的指标,乳酸的动态变化迅速而准确,是脓毒症患者早期目标指导治疗的复苏指标[5]。而迅速有效的降低血乳酸水平、防止较长时间的高乳酸血症,可能是严重脓毒症和脓毒性休克患者重要的早期治疗目标之一。
尽管有研究证实初始乳酸值升高与脏器功能障碍发生率增加和病死风险增加有关[7],但本研究未发现初始乳酸值的这种预后评估价值。单次乳酸测定值并不能反映乳酸的动态变化趋势,而连续动态乳酸监测则可能反映复苏即时效果。乳酸清除率即为动态监测的典型指标,其能够反映血乳酸水平的动态变化趋势和复苏即时效果,但也有局限性:(1)难以反映乳酸升高的严重程度;(2)在乳酸值轻度升高的时候数值往往被夸大,导致人为误差[9]。
早期乳酸面积的计算方式能够弥补其他乳酸指标的诸多缺陷,它不仅能够反映脓毒性休克早期的乳酸持续时间、乳酸升高的严重程度,更为重要的是,它能够反映早期乳酸蓄积的总量[9],从而更利于有效评估患者预后。本研究结果也证实上述假设,早期乳酸面积、初始乳酸值和乳酸清除率均可以有效预测28 d病死率,但早期乳酸面积的ROC曲线下面积最高,且显著高于初始乳酸值和乳酸清除率的曲线下面积。因此,早期乳酸面积对老年脓毒性休克患者预后的价值优于其他乳酸指标,具有较好的临床应用前景。动态监测乳酸变化,使用早期乳酸面积评估患者病死风险,有利于指导早期液体复苏和其他治疗,从而改善老年脓毒性休克患者预后。



























