
建立隐睾模型,观察分析乙醛脱氢酶1A1(ALDH1A1)mRNA和蛋白在大鼠隐睾及正常睾丸组织中表达的变化及意义。
应用内分泌诱导法建立隐睾动物模型,分别取出生后第15天(幼年期)、第45天(青春期)和第90天(成年期)隐睾和正常子代雄鼠的睾丸组织,采用HE染色、实时荧光定量聚合酶链反应(PCR)法、蛋白质印迹法、组织芯片免疫组化检测大鼠隐睾及正常睾丸组织中ALDH1A1 mRNA和蛋白水平表达的变化。
隐睾组幼年期、青春期和成年期ALDH1A1 mRNA表达量分别为1.01±0.19,1.60±0.32,0.75±0.16;正常组各期表达量分别为1.66±0.23,0.52±0.08,0.15±0.10,幼年期隐睾组睾丸组织中ALDH1A1 mRNA和蛋白的表达量低于正常组,青春期和成年期隐睾组睾丸组织中ALDH1A1 mRNA和蛋白的表达量高于正常组,差异有统计学意义(P<0.05)。
ALDH1A1在大鼠睾丸的发生发育过程中,在不同年龄阶段有着不同的表达。ALDH1A1的表达与隐睾疾病的发生发展机制有着重要的联系。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
隐睾是睾丸下降异常的总称,是指睾丸未能按正常发育过程从腹部腹膜后下降至阴囊。流行病学分析,足月产的新生儿隐睾发生率为1%~3%,早产儿发生率为30%[1]。隐睾最主要的危害在于,它会导致男性不育和睾丸肿瘤[1,2]。目前,外国学者研究认为最佳的手术时间为出生后6~12个月[3],然而虽然目前手术是治疗隐睾的首选治疗方案,但是手术却不能完全逆转对生育功能的影响,迄今为止,隐睾的病因及其发病机制仍然尚不明确,随着深入的研究,发现隐睾与多种基因密切相关[4]。ALDH1A1是乙醛脱氢酶(ALDH)家族的一种重要亚型,能够通过调节胚胎干细胞的基因转录,对其多潜能性和自我更新的能力,具有关键性的调控作用,保护细胞免受损害[5],且具有增殖、分化及应激等细胞调控功能[6]。ALDH1A1 mRNA已经被证实存在于人体睾丸,肝脏和食管等中[7,8]。Bowles等[9]研究发现,ALDH1A1在鼠和鸡发育中的泌尿生殖脊细胞及睾丸组织中均有高表达,并与青春期和成年期支持细胞促进精子生成密切相关。由此可见,ALDH1A1在胚胎发育过程中,在泌尿生殖系统的形成及发育过程中可能起着至关重要的作用。而ALDH1A1在隐睾中的表达特点目前尚无相关研究报道。
内分泌诱导法是国际公认的隐睾造模方式之一,已有研究采用此方法造模检测隐睾组织雌激素受体α、β及miR-315a的表达变化[10,11]。为探究大鼠隐睾及正常睾丸组织中ALDH1A1 mRNA及蛋白的表达变化情况,本研究通过内分泌诱导方式,制备SD大鼠隐睾动物模型,采用HE染色观察隐睾大鼠睾丸组织的组织学改变,实时荧光定量PCR、蛋白质印迹法和免疫组织化学法检测大鼠隐睾及正常睾丸组织中ALDH1A1的表达差异情况,探讨ALDH1A1表达的变化,为进一步研究其参与疾病的可能机制打下基础,并为临床上优化隐睾治疗方案奠定实验基础。
氟他胺购自Sigma公司,Trizol购自Invitrogen公司,逆转录试剂盒购自日本TAKARA公司,引物购自上海生工技术有限公司,兔抗鼠ALDH1A1单克隆抗体购自Abcam公司,雌性SD大鼠(孕13 d)10只,由南通大学医学院实验动物中心提供。
于孕第14~20天,5只孕鼠每天腹腔注射7.5 mg氟他胺(溶于95%玉米油+5%乙醇),以出生后的子代雄鼠作为隐睾组;以5只健康孕鼠出生后的子代雄鼠为正常组,作为对照。
造模的5只孕鼠均于孕第21天分别产子14,15,14,14,15只,其中子代雄鼠分别为7,8,8,7,6只,共36只。于出生后15 d(幼年期)取10只子代雄鼠一侧睾丸,共10例标本;剩余26只出生后45 d(青春期)子代雄鼠中21只为双侧隐睾,3只单侧隐睾,2只正常,隐睾造模成功率92.3%,取10只双侧隐睾雄鼠一侧睾丸,共10例标本;于出生后90 d(成年期)取10只双侧隐睾雄鼠一侧睾丸,共10例标本。正常组分别取出生后第15天(幼年期)、第45天(青春期)和第90天(成年期)的睾丸组织各10例作为对照,60例标本均一半以福尔马林固定液固定,一半以-80 ℃保存。
组织常规固定、包埋、切片,二甲苯脱蜡,梯度乙醇脱水,苏木素浸染、分化、蓝化,伊红酒精浸染、脱水、透明,封片,显微镜下观察。
(1)总RNA的提取:取50~100 mg的睾丸组织按照RNA提取试剂盒提总RNA。(2)cDNA合成:应用PrimerScript RT reagent Kit逆转录试剂盒合成cDNA。(3)引物设计:根据GenBank提供的基因已知序列,应用Primer Premier 5.0软件设计引物。ALDH1A1上游引物:5′TCGGATTTAGGAGGCTGCAT 3′,下游引物:5′TGACAACCACGGTATTCCCA 3′,GAPDH上游引物:5′TCGTGGAGTCTACTGGCGTCT 3′,下游引物:5′CAACCTGGTCCTCAGTGTAG 3′。(4)Real-time PCR:使用Real-time PCR仪(Life Technologies),按照PCR QuantiNova SYBR Green PCR试剂盒说明书完成实时法荧光定量PCR,反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 10 s,共40个循环。GAPDH作为标准内参基因对照,使用ΔΔCT方法进行数据分析。
提取各期各组睾丸蛋白,测定蛋白浓度,加入Loading缓冲液,于沸水中煮10 min,采用10%十二烷基酸钠-聚丙烯酰胺(SDS-PAGE)分离胶和5%SDS-PAGE积层胶,常规电泳、转膜、封闭。孵育一抗(兔抗鼠ALDH1A1抗体,ab52492,1∶1 000,Abcam),室温1~2 h或者4 ℃过夜,二抗(HRP标记的羊抗兔抗体,ab6721,1∶10 000,Abcam),室温2 h。按照Ecl试剂盒显影、拍照保存。
采用Tissue Microarrayer System Quick Ray (UT06, UNITMA, Korea)工具,于每块组织蜡块取2 mm直径组织,置于新的石蜡模块中制作组织芯片,常规脱蜡,于枸橼酸盐缓冲液中行微波抗原修复,滴加3% H2O2-甲醇,室温孵育10 min,以切断内源性过氧化物酶的活性,用5%山羊血清封闭,孵育一抗(兔抗鼠ALDH1A1抗体,ab52492,1∶100,Abcam),4 ℃过夜,二抗(HRP标记的羊抗兔抗体,ab6721,1∶1 000,Abcam),室温30 min,DAB显色,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。组化结果由两人采用盲法观测评分,胞质染色为棕黄色为阳性结果,阳性细胞染色强度评分为0(阴性),1(弱阳性),2(中度阳性),3(强阳性),阳性细胞百分比评分为0~100%,两者的乘积为最终染色评分(0~300)。
实验数据采用SPSS 20.0软件分析,组间差异采用one-way ANOVA分析,以P<0.05表示差异有统计学意义。
与正常组睾丸相比较,各期隐睾组睾丸体积明显减小,差异有统计学意义(P<0.01)(表1)。
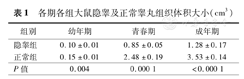
各期各组大鼠隐睾及正常睾丸组织体积大小(cm3)
各期各组大鼠隐睾及正常睾丸组织体积大小(cm3)
| 组别 | 幼年期 | 青春期 | 成年期 |
|---|---|---|---|
| 隐睾组 | 0.10±0.01 | 0.85±0.05 | 1.28±0.17 |
| 正常组 | 0.15±0.01 | 2.48±0.19 | 3.53±0.14 |
| P值 | 0.004 | 0.000 1 | <0.000 1 |
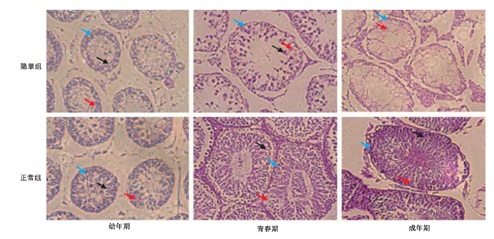
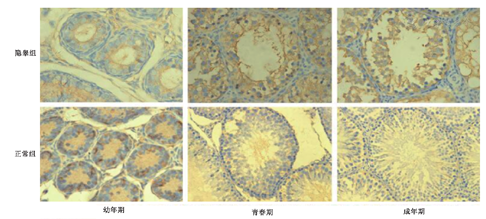
隐睾组幼年期,生精细胞和支持细胞较正常组减少,生精上皮细胞层变薄。隐睾组青春期及成年期,睾丸支持细胞形态异常,排列紊乱,生精上皮细胞变性坏死,生精小管萎缩(图1)。

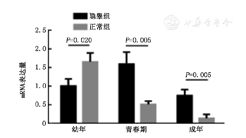
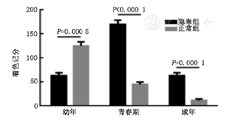
以GAPDH为内参照,进行实时荧光定量PCR检测ALDH1A1 mRNA在大鼠隐睾及正常睾丸组织中的表达变化。隐睾组幼年期、青春期和成年期ALDH1A1 mRNA表达量分别为1.01±0.19,1.60±0.32,0.75±0.16;正常组各期表达量分别为1.66±0.23,0.52±0.08,0.15±0.10(图2)。幼年期隐睾组睾丸组织中ALDH1A1 mRNA的表达量明显低于正常组,差异有统计学意义(P<0.05);青春期和成年期隐睾组睾丸组织中ALDH1A1 mRNA的表达量明显高于正常组睾丸组织,差异有统计学意义(P<0.01)。

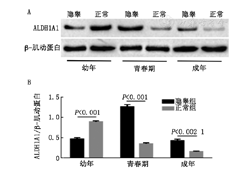
ALDH1A1蛋白在大鼠隐睾及正常睾丸组织中均有表达(图3A)。幼年期隐睾组睾丸组织中ALDH1A1蛋白表达较正常组明显降低,差异有统计学意义(P<0.01);青春期和成年期隐睾组睾丸组织中ALDH1A1蛋白表达较正常组明显升高,差异有统计学意义(P<0.01)(图3B)。

ALDH1A1蛋白在大鼠隐睾及正常睾丸组织中均有表达(图4),表达于睾丸支持细胞的细胞质中,细胞质染色为棕黄色为阳性。幼年期隐睾组ALDH1A1蛋白表达呈阳性,正常组ALDH1A1蛋白表达较隐睾组明显升高,呈强阳性,差异有统计学意义(P<0.01);青春期和成年期隐睾组中ALDH1A1蛋白表达呈强阳性或阳性,而青春期和成年期正常组中ALDH1A1蛋白散在表达于细胞质中,较隐睾组ALDH1A1蛋白表达明显降低,呈弱阳性,差异有统计学意义(P<0.01)(图5)。结果与PCR和蛋白质印迹一致。


由于目前国内外对隐睾的病因及睾丸损害的具体机制尚未清楚,因此对于隐睾的治疗,可以从隐睾发病发展机制方面着手研究,为隐睾的分子治疗提供新的方向。
研究认为,在对大鼠胎儿时期的睾丸给予外源的RA,能有完全抑制精索的形成[12],抑制中肾细胞的迁徙,抑制睾丸支持细胞的分化和性原细胞的生存[13]。另外,在体内和体外研究证明,在鼠的睾丸发育过程中,RA会引起生殖细胞过早的进入减数分裂和细胞凋亡[14]。Bowles等[9]研究提出,ALDH1A1高表达于胎鼠睾丸组织中,且另一种在胎鼠睾丸组织中高表达的细胞色素P450酶(cytochrome P450 enzyme,CYP26B1)能降低内源性RA,在CYP26B1基因敲除雄性性腺中ALDH1A1表达降低,因此提出假设,ALDH1A1高表达于胎鼠睾丸组织中,这种高表达现象从某种程度上,暗示了RA的耗尽。由此看出,ALDH1A1表达在睾丸的发生和发育过程中具有重要意义。而ALDH1A1在隐睾中表达特点目前尚缺乏研究。
本研究通过实时荧光定量PCR检测结果示大鼠隐睾及正常睾丸组织中均有不同程度的ALDH1A1 mRNA的表达。幼年期隐睾组睾丸组织中表达量明显低于正常组,蛋白质印迹和免疫组化结果与PCR一致。由此我们可以分析,由于正常睾丸幼年期发育过程中,ALDH1A1的呈高表达,暗示着RA的耗尽,而与隐睾睾丸相比,隐睾中ALDH1A1的表达降低,可能意味着RA的剩余,RA又会抑制精索的形成,抑制中肾细胞的迁徙,抑制睾丸支持细胞的分化和性原细胞的生存,引起生殖细胞过早的进入减数分裂和细胞凋亡,由此影响了正常睾丸的发育,这可能是隐睾发病机制之一,值得我们更进一步研究,为隐睾的分子治疗提供了新的方向。另外PCR检测结果示青春期和成年期隐睾组睾丸组织中ALDH1A1mRNA的表达量明显高于正常组睾丸组织,且蛋白质印迹和免疫组化结果与PCR一致。我们可以推测,青春期睾丸将开始处于发育成熟,产生精子阶段,成年期睾丸已经拥有正常产精功能,正常组青春期和成年期ALDH1A1的表达明显较幼年期减少,这可能暗示着RA较幼年期增多,参与促进生殖细胞的减数分裂,而与隐睾组青春期和成年期相比较,隐睾组ALDH1A1的表达量明显升高,由此,我们可能推测,表达量明显升高,可能暗示着RA的缺少,生殖细胞减数分裂减少,从而可能引起了隐睾患者的不育,这值得也我们更进一步的研究。另外,ALDH1A1作为肿瘤干细胞标志物的高表达于各种肿瘤疾病中,包括肝癌,肺癌,卵巢癌,食管癌,胃癌,前列腺癌,乳腺癌等[15],由此我们可以推测,对于隐睾引起的另一并发症睾丸癌,是否也可应用ALDH1A1作为肿瘤干细胞标志物而进行诊断、治疗或预后分析,值得我们更进一步的深入研究。



























