
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
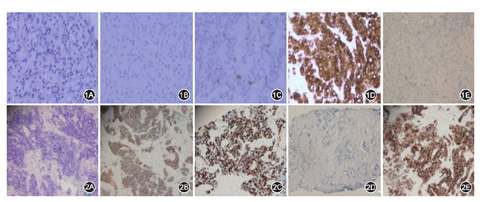
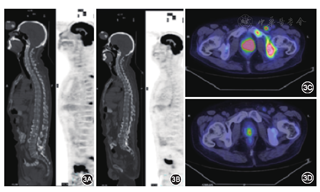
患者男,57岁,因前列腺腺癌(PCa)内分泌治疗2年余,进行性排尿困难半年余,于2015年7月16日入院。病史:2012年5月无明显诱因出现尿频、尿急、尿痛,伴排尿困难。2013年4月就诊于当地医院,总前列腺特异性抗原(TPSA)为500 μg/L,前列腺穿刺活检,病理报告:前列腺腺癌,Gleason评分:4+4=8分。全身骨CT扫描(ECT)示:全身多发骨转移。随后,给予内分泌治疗(戈舍瑞林3.6 mg皮下注射,1次/28 d,比卡鲁胺50 mg,口服,1次/8 d)和唑来膦酸抗骨转移治疗(4 mg,静脉滴注,1次/28 d),治疗后前列腺特异抗原(PSA)逐渐下降至正常。但从2014年12月开始TPSA逐渐升高,腰背部疼痛进行性加重,2015年5月复查TPSA为15.02 μg/L。遂更换二线内分泌药物:氟他胺250 mg,口服,3次/d,但疼痛未见明显减轻。患者自发病以来精神、饮食尚可,体重明显减轻(3个月下降10 kg)。入院查体:专科检查:直肠指诊:前列腺体积巨大,质硬,表面不光滑,未触及硬结,边界不清,中央沟消失,轻压痛,指套无染血。疼痛数字评分9分,卡氏评分50分。主要实验室及辅助检查:TPSA 26.5 μg/L,游离PSA 3.39 μg/L,游离PSA/TPSA 0.13;乳酸脱氢酶552 U/L;C反应蛋白48.7 mg/L,睾酮8 μg/L。2015年7月18日正电子发射计算机断层显像(PET-CT)示:前列腺正常结构消失;左侧耻骨、坐骨、左侧腹股沟淋巴结异常放射性浓集,相互融合,范围约5 cm×6 cm;全身多发骨质代谢异常,考虑为骨转移。印象:(1)前列腺癌;(2)左侧腹股沟淋巴结肿大;(3)全身多发骨转移。入院后病例讨论分析患者诊断为去势抵抗性前列腺癌,临床特点为低PSA水平下快速临床进展,不除外小细胞癌,需要明确目前病理类型以指导下一步治疗方案。向家属充分告知二次活检的必要性和潜在的风险,2015年7月20日行"超声引导下前列腺肿物穿刺活检"。病理诊断:低分化腺癌。同病理科医生沟通后,请病理科主任会诊,加做免疫组织化学:PSA(-),PSAP(-),CD56(+),SYN (+),CgA (+),P504S(弱+),Ki-67 (90%+)。借取第一次活检病理蜡块和切片,加做免疫组织化学,诊断为前列腺腺癌,Gleason 4+4=8分( 图1A~E),修正病理诊断为"前列腺小细胞神经内分泌癌"(图2A~E)。结合两次活检,诊断为前列腺腺癌内分泌治疗失败后转化为小细胞神经内分泌癌。随后,给予卡泊联合足叶乙甙(CE)方案化疗3周期:依托泊苷150 mg d1~d3,卡铂550 mg d1,并予保肝、止吐、升白细胞等对症治疗。随访1个月,患者腰痛症状明显缓解,疼痛数字评分降至2分,卡氏评分升至80分。2015年10月10日复查PET-CT示:与前1次PET-CT比较(图3A),前列腺局部未见异常放射性浓集,左侧腹股沟区淋巴结也明显缩小(图3B)。复查血清TPSA、乳酸脱氢酶均正常,疗效评价:部分缓解(PR)。随后,患者规律行CE方案化疗,化疗后症状明显缓解,目前仍在随访中。


PCa是泌尿生殖系统常见的恶性肿瘤之一。近年来,我国PCa总体发病率呈显著增长趋势[1]。并且,我国PCa诊断时已处于中晚期,起初,多数患者对去势治疗(ADT)有效,但经过18~24个月的缓解期后,绝大多数患者均发展为预后极差的去势抵抗性前列腺癌(CRPC),其中位生存期仅为12个月[2],成为困扰前列腺癌临床治疗的难题。CRPC中预后极差的一个亚型是神经内分泌型前列腺癌(NEPC),多由ADT引起,越来越多的证据支持:NEPC的发生机制是PCa转分化(transdifferentiation)为tNEPC[3,4]。近年来,人们开始关注PCa内分泌后的组织病理学转化,并逐渐认识到这是一种获得性耐药机制。tNEPC对ADT治疗不敏感[5],化疗效果也极其有限,进展迅猛,预后极差,约占CRPC死亡患者的25%。此外,随着新型抗雄激素药物(阿比特龙、MDV3100等)的广泛使用,tNEPC的比例很可能会大大升高。
然而,临床工作中,由于tNEPC发病率相对较低,绝大多数泌尿外科和肿瘤科医师对其治疗经验不足,容易按前列腺腺癌的治疗方案治疗,但小细胞癌与前列腺腺癌的治疗原则截然不同。因此,作为泌尿外科和肿瘤科医师应明确tNEPC的临床和病理特点,如确诊为tNEPC应尽早行全身化疗,以免耽误宝贵的治疗时间,进而加重患者的经济及心理负担。
1.tNEPC的临床表现和诊断:tNEPC多发生在内分泌治疗后12~24个月,临床表现以盆腔肿物最为多见,其他表现还可能有高钙血症、Cushing综合征、重症肌无力、类癌综合征、骨痛、下尿路梗阻、血尿等[6,7]。单纯tNEPC患者的PSA一般不增高,但合并前列腺腺癌时PSA可增高,因此PSA不能作为tNEPC诊断的特异性指标。目前的诊断缺乏有效的生化指标,主要依靠病理学检查,光镜下的典型表现为:肿瘤呈片槽状分布,无腺泡结构,肿瘤细胞较小,只比淋巴细胞略大,最典型的细胞呈一头尖一头圆的"燕麦"形,细胞质较少,细胞核染色较深但核仁不明显[8]。但tNEPC与极低分化的前列腺腺癌(Gleason 5+5分)容易混淆,因为低分化腺癌也没有腺泡结构,肿瘤细胞也呈小细胞形态,这可能是NEPC病理诊断困难的原因之一。目前tNEPC病理诊断参照世界卫生组织(WHO) 2004版小细胞肺癌的诊断标准,免疫组化中的神经内分泌指标也有助于支持诊断。常见的神经内分泌标志物有神经元烯醇化酶(NSE)、突触素(Syn)、嗜铬素A(CgA)。CD56是最敏感的神经内分泌标志物,TTF-1在半数以上的神经内分泌癌中呈阳性表达,但不表达于低分化腺癌[9]。90%的NEPC中至少一种神经内分泌指标阳性,但是如果组织病检中发现小细胞癌的典型形态学特征时,尽管全部神经内分泌指标均阴性,仍然不能排除NEPC。本例患者初次病理诊断为低分化腺癌,临床和病理专家沟通交流后再次行相关免疫组化检测再次明确诊断,也证明了鉴别诊断的重要性。因此,NEPC确诊取决于有经验病理医生的细致观察和综合判断。
临床上对前列腺癌内分泌治疗耐药后转化为小细胞神经内分泌癌(tNEPC)的认识不足。
病理切片上tNEPC与低分化前列腺癌(Gleason评分:5+5=10分)相似,鉴别诊断困难。
tNEPC对经典的内分泌治疗无效,进展迅猛,预后极差。
由于临床上不常规进行二次活检,tNEPC的发病率被大大低估。临床医生和病理医生要加强对tNEPC的认识,避免不必要的诊断和治疗延误。
当前列腺癌患者内分泌治疗失败后出现类癌综合征、下尿路症状、溶骨性骨转移、内脏转移等临床特征,影像学上出现异乎寻常的进展转移现象,但PSA未见升高或升高水平明显和肿瘤进展不呈比例时,应该考虑tNEPC的可能,建议对快速进展病灶再次活检以排除tNEPC诊断。
一旦确诊为tNEPC应尽早行以依托泊苷联合顺铂(EP)或CE方案为主的全身化疗,必要时联合放疗,以免耽误宝贵的治疗时间,加重患者的经济及心理负担。
tNEPC预后极差,其凶险的生物学行为迫使我们必须给予足够重视和更多的研究。
由于tNEPC预后极差,且腺癌和NEPC治疗方法迥异,当去势治疗失败的PCa患者出现上述症状,影像学上出现异乎寻常的浸润转移现象,但PSA未见升高或升高水平明显和肿瘤进展不呈比例时,应该首先考虑tNEPC的可能,建议针对快速进展病灶再次活检(rebiopsy)以排除tNEPC诊断。本例患者临床表现特点为CRPC患者出现低PSA水平快速临床进展,临床上可疑NEPC,在向家属充分告知了风险及必要性,及时采取了二次活检,及时调整了治疗策略,避免了不必要的多西他赛联合泼尼松化疗及二线内分泌治疗。
2.tNEPC的可能机制:对于tNEPC产生的机制,目前有两种主要观点,一是选择性模型(也称克隆选择),指的是在未治的肿瘤中已存在占优势的敏感和少数的耐药细胞,长期用药后敏感细胞被杀灭而原来少量的耐药细胞被选择出来成为优势细胞。二是获得性模型,指的是长期使用内分泌治疗后诱发的突变或旁路激活,如基础研究已证实TP53(p53)基因和RB基因(Retinoblastoma gene)的同时失活可以导致肺和前列腺中小细胞的出现。也许前列腺腺癌在治疗过程中出现了类似TP53和RB基因的缺失,致使腺癌转化成为NEPC。另外,Beltran等[10]在最近进行的一项研究中发现,AURKA和MYCN基因共扩增发生在65%的后续出现NEPC转化的原发性PCa标本中,而仅仅发生在5%普通PCa标本中,提示这两个基因在NEPC发展中可能发挥重要作用。此外,Gururajan等[11]研究发现,SRC激酶家族中的FYN基因可以促进PCa的神经内分泌型转化及内脏转移。Dong等[12]研究发现,DEK基因在前列腺癌尤其是NEPC的发生发展中起了非常重要的作用,有望成为NEPC的潜在治疗靶点。总之,目前越来越多的证据支持获得性模型。
3.NEPC临床治疗棘手,目前主要治疗方法为化疗,化疗主要参照小细胞肺癌化疗方案。以顺铂为基础的多种方案是NEPC治疗的主要方法,单独使用或与放疗等方法联用。NCCN前列腺癌临床实践指南(2014)建议对于PCa发生tNEPC转化的患者给予顺铂联合依托泊苷(EP)化疗。Sequist等报道了6例tNEPC患者,有4例患者接受NEPC标准方案化疗,3例有效,其中1例为化疗联合放疗。Kadakia等[13]报道了1例47岁的前列腺癌(Gleason评分:9分)患者,该患者在雄激素去势治疗6个月后就进展为肝转移,肝组织穿刺活检病理回报:小细胞神经内分泌型前列腺癌。随后,患者进行了二代DNA测序,进而获得生存获益。Wang等[14]报道123例NEPC转化,多因素分析显示化疗联合放疗是独立预后因素。内分泌治疗对NEPC几乎没有治疗作用,但对同时合并前列腺腺癌成分者可以考虑联合使用。目前临床指南推荐CRPC患者仍然有必要维持去势水平,最近有实验研究支持这一策略。由于tNEPC的预后不佳,探索新的治疗策略迫在眉睫,分子靶向药物可能是未来治疗突破。最近,有学者试图通过抑制tNEPC转化的关键通路来治疗这部分CRPC患者。例如,Beltran等[10]研究证实,AURKA抑制剂PHA-739358在体内和体外实验中能有效杀伤tNEPC,提示其是有前景的NEPC治疗靶点。目前正在开展二期临床试验以验证其对tNEPC的抑制效果(NCT01799278)。
tNEPC进展迅速,恶性程度高,尽管有的病例治疗后可以短期内缓解,但是有效时间并不长,不久即难以控制。Wang等[14]对国内外HT获得性耐药后转化为tNEPC的123例PCa患者的临床病理和生存资料进行系统评价和整合分析,结果显示:PCa转化为tNEPC的中位时间为20个月,转化后的tNEPC预后极差,中位生存时间7个月。此外,他们还发现,Gleason评分是tNEPC的唯一独立预后因素,Gleason评分≥8分的PCa患者的tNEPC中位时间显著短于Gleason评分<8分的患者。转移灶数目是NEPC患者生存期的独立预后因素,转移灶数目≥3处的NEPC患者中位生存时间显著短于转移灶数目<3处的NEPC患者。放疗与化疗虽然可以有效延长NEPC患者生存期,但总体治疗效果仍不满意。本例患者在诊断为前列腺腺癌后在2年内对内分泌治疗敏感,但转化为小细胞癌后则对雄激素阻断治疗无效,而在CE方案全身化疗后症状明显缓解,瘤体缩小,近期疗效获得肯定。
4.本例的经验总结:本病例的诊治过程中有以下总结:(1)临床医生要加强对PCa转化为tNEPC的认识,对可疑tNEPC患者建议尽早再次活检确诊,以免延误诊治。(2)由于病理医生对本病认识不足,初始病理诊断为低分化腺癌,经加做免疫组化后确诊,因此,病理医生也要加强对此病的认识,以免延误诊治,另外鼓励临床和病理专家之间的沟通。(3)tNEPC对经典的内分泌治疗无效,进展迅猛,预后极差。一旦确诊为tNEPC应尽早行以EP或CE方案为主的全身化疗,必要时联合放疗等,以免耽误宝贵的治疗时间和加重患者的经济及心理负担。(4)由于临床上不常规进行二次活检,tNEPC的发病率被大大低估。tNEPC预后极差,其凶险的生物学行为迫使我们必须给予足够重视和更多的研究。


























