
探讨P21活化激酶1(PAK1)在膀胱癌组织中的表达和其对膀胱癌细胞侵袭能力的生物学影响。
免疫组化法检测2009年1月至2012年12月在复旦大学附属金山医院手术获取的54份膀胱癌组织蜡块和12份正常膀胱组织蜡块中PAK1的表达情况,实时荧光定量PCR、Western印迹实验验证PAK1在膀胱癌细胞系和正常膀胱上皮细胞系中的表达差异。构建PAK1基因沉默的膀胱癌5637细胞稳定株,Transwell法检测PAK1基因沉默的膀胱癌5637细胞迁移及侵袭能力的改变。
PAK1在膀胱癌组织的表达明显高于正常膀胱上皮组织(28/54比1/12,P<0.05),其高表达与高级别病理分级、淋巴转移以及肿瘤直径等呈正相关(均P<0.05)。膀胱癌细胞系T24、5637中PAK1的mRNA和蛋白水平明显高于正常膀胱上皮细胞系SV-HUC-1,PCR和Western印迹实验证实PAK1-短发夹RNA(shRNA)对膀胱癌5637细胞中PAK1表达抑制效果理想,迁移和侵袭实验证实PAK1基因沉默的膀胱癌5637细胞穿过小室数目较对照组减少。
膀胱癌组织中PAK1高表达是一个重要特征,与膀胱癌细胞迁移及侵袭能力有关,其调控的分子机制有待进一步深入研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膀胱癌是国内泌尿系统最常见的恶性肿瘤,其发病率呈现增长趋势[1]。该疾病具有增殖及侵袭进展的特点,高侵袭性膀胱癌严重影响患者生活质量[2]。近年来分子生物学研究的发展为膀胱癌诊治提供了新思路,但仍没有完全明确其发生及进展的分子生物作用机制,寻找新的分子标志物对于膀胱癌的诊断和治疗具有重要意义。
小分子GTP酶如Ras、Rho、Rac、Cdc42等构建了一些恶性转化的信号通道,P21活化激酶(PAK)是Rac、Cdc42的作用底物,PAK由含有丝氨酸/苏氨酸的蛋白激酶组成,分为Ⅰ类PAK(包括PAK1、PAK2、PAK3)和Ⅱ类PAK(PAK4、PAK5、PAK6)[3]。PAK1属于PAK家族中的一员,最新研究显示其在部分肿瘤中存在高表达,可磷酸化肿瘤抑制因子(Merlin)和肌球蛋白轻链激酶(MLCK),抑制活性而促进肿瘤的增殖和转移[4]。目前PAK1调控膀胱癌细胞增殖及侵袭迁移能力的分子作用机制尚不明确,本研究拟通过免疫组化观察其在膀胱癌组织中的表达情况;体外构建PAK1基因沉默的膀胱癌5637细胞稳定株,研究PAK1对膀胱癌细胞迁移和侵袭能力影响,探讨PAK1在膀胱癌进展机制中的作用。
选取2009年1月至2012年12月间复旦大学附属金山医院的膀胱尿路上皮癌组织病理蜡块54份和正常膀胱上皮组织蜡块12份,收集临床资料。54例膀胱癌包括非肌层浸润(Ta~T1)39例、肌层浸润(>T1)15例;病理分级低级别29例、高级别25例,以上病理结果均经病理分析证实。研究方案经复旦大学附属金山医院伦理委员会批准(批准号:2014-14-01)。
人膀胱癌细胞系T24、5637和人正常膀胱上皮细胞系SV-HUC-1购自上海中科院细胞库。
PAK1基因干扰碱基序列和对照组无义碱基序列(siRNA)由上海吉玛公司负责设计合成。pHY-LV-KD5.1RNAi慢病毒载体由上海汉尹生物科技公司提供。
兔抗人PAK1多克隆抗体购自美国CST公司,辣根过氧化物酶标记鼠抗人β-肌动蛋白单克隆抗体购自上海康成生物公司,DAB显色试剂盒购自福建迈新公司,逆转录试剂盒购自大连Takara公司,TRIzol、lipo 2000、荧光定量PCR试剂盒均购自美国Life Technologies公司,Matrigel基质胶购自美国BD公司,定量PCR仪购自美国Applied Biosystems公司,ImageQuant LAS 4000化学发光图像成像系统购自美国通用电气公司。
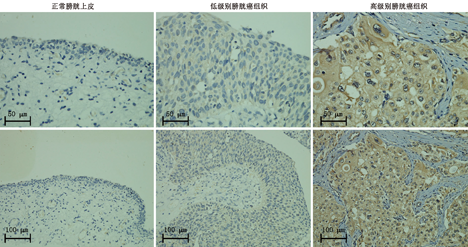
蜡块组织切片,常规脱蜡、水化后行高压抗原修复,3%过氧化氢封闭内源性过氧化物酶,山羊血清封闭30 min,孵育一抗(1∶100),4 ℃过夜,孵育二抗1 h,DAB显色,苏木精复染,常规脱水封片。双盲法观察染色结果,PAK1在胞质中表达,以出现黄色或棕褐色为阳性。5个高倍视野下计数阳性细胞数,染色范围:不显色为0分,细胞数<25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度:无染色为0分,弱阳性(浅黄色)为1分,中等阳性(黄色或棕色)为2分,强阳性(棕褐色)为3分。染色指数:为上述两种指数之和,0级为≤2分,1级为3~4分,2级为5~6分,3级为7分。定义:0级和1级为PAK1阴性,2级和3级为PAK1阳性。
TRIzol抽提细胞RNA,使用逆转录试剂盒合成cDNA,PAK1引物序列:上游5'AGTTTCAGAAGATGAGGATGA-TGA,下游5'AATCACAGACCGTGTGTATACAG;内参基因GAPDH引物序列:上游5'CAGGAGGCATTG-CTGATGAT,下游5'GAAGGCTGGGGCTCATTT。采用20 μl反应体系,每个标本设置3复孔,运用Applied Biosystems 7 500 2.0.6版软件分析熔解及扩增曲线,采用2-ΔΔCt方法进行数据分析。
提取细胞蛋白,BCA法测定蛋白浓度,取35 μg蛋白上样,进行SDS-PAGE电泳,转膜,封闭,孵育一抗[PAK1(1∶1 000)、β肌动蛋白(1∶3 000)],4 ℃过夜。加入二抗(1∶3 000)孵育1 h,TBST液轻摇清洗,ECL发光液显影,运用ImageQuant LAS4000 mini全自动化学发光图像成像系统采集信号并检测蛋白条带。
针对人PAK1基因干扰碱基序列和对照组无义碱基序列(siRNA)分别转染膀胱癌细胞5637,通过RT-PCR和Western印迹实验验证,确定PAK1基因干扰的靶点序列为GATGCTTTGACGCGGAATA,根据此序列合成1对寡聚单链DNA,插入短发夹RNA(shRNA)慢病毒载体(均由上海汉尹生物科技公司提供),通过转化,慢病毒重组质粒制备,包装,转染,收集,分装保存并检测滴度等步骤,感染膀胱癌5637细胞,通过RT-PCR和Western印迹实验验证shRNA对膀胱癌细胞5637 PAK1的沉默效率后,经过挑选克隆及药物筛选,扩大细胞培养,构建PAK1基因沉默的膀胱癌5637细胞稳定株。
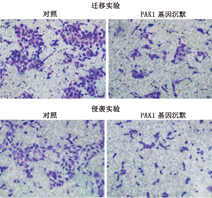
将处于对数生长期的PAK1基因沉默的5637细胞稳定株和对照组细胞均分别接种到Transwell小室上室和经过Matrigel胶处理形成基质屏障胶的Transwell上室中,接种细胞数为20 000个细胞,并在下室中添加含20%胎牛血清的培养基600 μl,细胞培养24 h后,取出Transwell小室,拭去残余的上室细胞,固定染色后高倍镜视野下拍照并计数穿过小室的细胞数目,对数据进行统计分析。
实验数据采用SPSS 17.0统计软件进行分析,实验结果以 ±s表示,两样本均数比较采用t检验,临床病理参数间比较采用χ2检验。P<0.05表示差异有统计学意义。
±s表示,两样本均数比较采用t检验,临床病理参数间比较采用χ2检验。P<0.05表示差异有统计学意义。
PAK1在膀胱癌组织染色主要在胞质部位,表现为黄褐色或棕褐色,54份膀胱癌组织中表达为阳性的有28份,阳性率为51.8%,12份正常膀胱上皮组织中PAK1染色,仅1份表达阳性,差异有统计学意义(P<0.05)(图1)。PAK1蛋白表达水平与病理分级、肿瘤直径、淋巴结转移相关(P<0.05)(表1)。
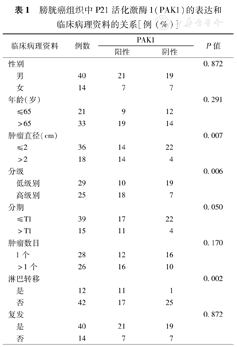
膀胱癌组织中P21活化激酶1(PAK1)的表达和临床病理资料的关系[例(%)]
膀胱癌组织中P21活化激酶1(PAK1)的表达和临床病理资料的关系[例(%)]
| 临床病理资料 | 例数 | PAK1 | P值 | ||
|---|---|---|---|---|---|
| 阳性 | 阴性 | ||||
| 性别 | 0.872 | ||||
| 男 | 40 | 21 | 19 | ||
| 女 | 14 | 7 | 7 | ||
| 年龄(岁) | 0.291 | ||||
| ≤65 | 21 | 9 | 12 | ||
| >65 | 33 | 19 | 14 | ||
| 肿瘤直径(cm) | 0.007 | ||||
| ≤2 | 36 | 14 | 22 | ||
| >2 | 18 | 14 | 4 | ||
| 分级 | 0.006 | ||||
| 低级别 | 29 | 10 | 19 | ||
| 高级别 | 25 | 18 | 7 | ||
| 分期 | 0.050 | ||||
| ≤T1 | 39 | 17 | 22 | ||
| >T1 | 15 | 11 | 4 | ||
| 肿瘤数目 | 0.170 | ||||
| 1个 | 28 | 12 | 16 | ||
| >1个 | 26 | 16 | 10 | ||
| 淋巴转移 | 0.002 | ||||
| 是 | 12 | 11 | 1 | ||
| 否 | 42 | 17 | 25 | ||
| 复发 | 0.872 | ||||
| 是 | 40 | 21 | 19 | ||
| 否 | 14 | 7 | 7 | ||

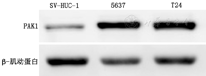
实时荧光定量PCR实验显示膀胱癌细胞系5637和T24中PAK1的mRNA水平明显高于正常膀胱上皮细胞系SV-HUC-1(3.35±0.95、2.44±0.57比1.00)(P<0.05)。Western印迹实验显示3种细胞系均存在PAK1蛋白表达,膀胱癌细胞系5637、T24中PAK1蛋白条带明显高于正常膀胱上皮细胞系SV-HUC-1(图2)。

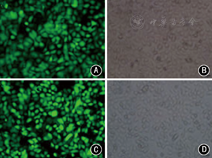
运用siRNA合成片段转染膀胱癌细胞5637,通过qPCR和Western印迹对siRNA片段沉默PAK1的效果进行分析,明确干扰效果最好的片段,确定干扰的靶点序列,通过慢病毒重组质粒制备及包装,成功构建慢病毒载体pHY-LV-KD5.1-PAK1-shRNA,结果显示PAK1-shRNA慢病毒液感染膀胱癌5637细胞的效率达95%以上(图3)。经过挑选克隆及筛选,扩大细胞培养,PCR实验显示PAK1基因沉默的5637细胞中的PAK1 mRNA水平较对照组明显降低(0.14±0.05比1.00)(P<0.05),Western印迹实验显示干扰组细胞PAK1蛋白水平明显低于对照组(图4),构建PAK1基因沉默的膀胱癌5637细胞稳定株成功。



与对照组比较,运用RNA干扰技术对PAK1干扰引起其表达水平下降,可导致膀胱癌5637细胞穿过滤膜的数目减少,表明存在其迁移和侵袭能力的降低,PAK1有助于膀胱癌细胞5637体外迁移及侵袭能力(图5)。

膀胱癌具有增殖及侵袭进展的特点,在肿瘤发展形成过程中,细胞核染色体及分子结构产生变化[5],导致原癌基因激活、抑癌基因功能失活、相关信号通路关键蛋白活化、DNA修复基因突变[6]等而促进肿瘤的发生及进展转移。PAK1基因定位于11q13区,尽管其在肿瘤中一般并不发生突变,但它们在一些肿瘤中存在着过表达及过度活化,有研究表明口腔癌组织中存在PAK1高表达,降低PAK1表达可抑制细胞增殖,迁徙侵袭和促进细胞凋亡等生物学行为[7],另有研究显示PAK1的表达与结肠癌病变的病理分级及临床分期存在相关性[8],本实验结果显示PAK1在膀胱癌组织的阳性率显高于正常膀胱上皮组织,并且其表达水平与淋巴结转移、病理分级及肿瘤直径大小存在相关性,表明PAK1表达水平有助于判断病变,提示膀胱癌病变进展,有助于临床诊断。
我们运用人膀胱癌细胞系T24、5637和正常膀胱上皮细胞系SV-HUC-1行进一步研究,运用qPCR和Western印迹法检测膀胱癌细胞系5637、T24和正常膀胱上皮细胞系SV-HUC-1中PAK1的mRNA和蛋白水平的差异,结果显示在膀胱癌细胞系,PAK1的mRNA和蛋白水平均呈明显升高趋势,从细胞分子层面进一步验证了PAK1在肿瘤细胞中有高表达,可能与膀胱癌细胞的增殖、侵袭转移能力相关。
目前国内外对PAK1参与膀胱癌进展过程中的分子生物学机制研究尚不明确,为进一步了解PAK1如何参加膀胱癌细胞迁移及侵袭方面生物学行为,我们针对膀胱癌5637细胞的PAK1表达进行干预,成功构建PAK1基因沉默的5637细胞稳定株,通过实验发现PAK1-shRNA的5637细胞中PAK1的mRNA和蛋白水平出现明显降低,说明慢病毒介导的RNA干扰技术可以有效抑制膀胱癌细胞5637中PAK1的表达,为进一步研究PAK1在细胞中的所起到的生物学功能建立了一个研究平台。也有类似研究应用shRNA方法来抑制NIH3T3细胞中的内源性PAK1来观察其下游靶点蛋白的变化及对细胞增殖的影响[9]。肿瘤的侵袭转移是肿瘤病变发展进程的重要特点,我们针对PAK1是否参与调控膀胱癌细胞迁移和侵袭进行了Transwell实验,结果显示PAK1基因沉默的膀胱癌5637细胞穿过小室滤膜的细胞数目较对照组细胞数目明显减少,提示着下调PAK1的表达可以导致膀胱癌细胞5637的迁移和侵袭能力明显下降。有研究显示上调PAK1表达可以增强胃癌MKN45细胞的迁移能力,而抑制其表达可导致细胞侵袭能力减弱,并认为应激活化蛋白激酶、细胞外调节蛋白激酶等蛋白参与调节PAK1所介导的胃癌细胞迁移侵袭过程[10],这与我们的研究结果有相似之处。
综上所述,PAK1在膀胱癌组织和细胞中存在高表达,并在膀胱癌细胞迁移和侵袭过程起重要作用,提示PAK1参与膀胱癌发生及进展过程,有助于膀胱癌诊断以及病情进展判断,是一个新的有潜在价值的肿瘤生物学标志物,PAK1异常高表达对膀胱癌的生物学影响及其具体参与细胞周期调控、侵袭转移的分子机制仍有待于进一步研究。



























