
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
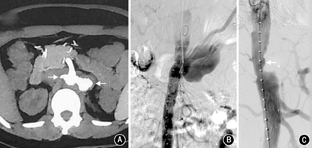
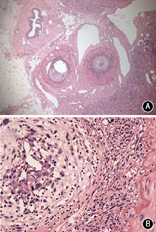
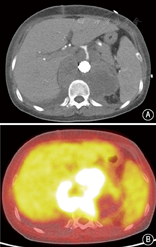
患者女,35岁,因发作性腰背疼痛1年,加重2个月余,于2014年12月入住北京协和医院。患者于2013年12月中旬无明显诱因出现头痛、心慌、大汗,无恶心、呕吐,未重视。2014年1月,患者因头痛伴血压明显升高至200/110 mmHg(1 mmHg=0.133 kPa)就诊于外院,左肾肾小球滤过率(GFR) 7.48 ml/min,超声提示左肾明显萎缩,大动脉造影显示左肾动脉起始段假性动脉瘤形成,压迫左肾动脉导致远端不显影;遂行左侧无功能肾切除术。术后病理提示左侧肾盂组织慢性炎,左肾组织间质少许慢性炎细胞浸润并玻璃样变性,左输尿管残端黏膜组织慢性炎。2014年4月,患者突发少尿,血肌酐(Cr) 795 μmol/L,考虑急性肾功能衰竭,开始行肾脏替代治疗,腹部增强CT提示L1水平腹主动脉左侧动脉瘤,大小约1.9 cm×1.7 cm,右肾动脉闭塞,右肾实质未见异常,腹膜后肿大淋巴结,腹主动脉周围可见软组织密度影包绕,增强扫描未见明显强化(图1A)。肾动脉造影提示右肾动脉主干仅线形显影,余完全闭塞。2014年5月尝试行右肾自体肾移植术,但术中发现肾动脉及其分支全部堵塞,遂切除右肾。术后病理显示右肾脏动脉间叶组织肿瘤,结合免疫组化染色符合血管内膜肉瘤,可见右肾脏肾小球及肾小管透明变性、凝固性坏死伴灶状炎细胞浸润及间质纤维结缔组织增生,右输尿管残端及右肾周脂肪组织未见肿瘤组织(图2);免疫组化:波形蛋白(Vimentin)(+),肌动蛋白(actin)(+),增殖指数(Ki-67)(+,约10%),簇分化抗原(CD)31、CD163、CD68、CD3、白细胞共同抗原(LCA)、B细胞淋巴瘤白血病基因-2(BcL-2)、CD34、高分子量钙调结合蛋白(h-Caldesmon)、平滑肌肌动蛋白(SM-actin)、CD21、CD35、D2-40、CD123、CD20、S-100、第Ⅷ因子相关抗原(FⅧ-RAg)、结蛋白(Desmin)、间变性淋巴瘤激酶(ALK)、CD99、角蛋白(CK)、上皮膜抗原(EMA)、CK18、黑色素瘤相关抗原(HMB45)均(-);未进行后续辅助治疗。2014年7月,患者复查胸腹部CT血管造影(CTA),提示腹膜后肿物包绕T12、L1椎体水平腹主动脉、腹腔干及双肾动脉残端,左肾动脉残端瘤样扩张,大小约2.3 cm×2.1 cm×2.3 cm;患者未治疗。2014年12月3日,患者因腰部剧烈疼痛复查肾动脉超声提示腹主动脉瘤可能性大,大小约5.7 cm×4.0 cm,左肾动脉主干受压前移。当日夜间,患者血压最高达190/110 mmHg,次日早晨患者因失血性休克急诊行大动脉造影提示左肾动脉残端假性动脉瘤(图1B),考虑左肾残端动脉瘤破裂出血,遂行腹主动脉假性动脉瘤腔内隔绝术,术中对支架行肠系膜上动脉开窗。2015年1月,患者上厕所时突发右侧腰背部持续钝痛;腹主动脉CTA考虑腹主动脉假性动脉瘤形成。主动脉造影提示原主动脉支架上方造影剂轮廓不规则,考虑主动脉假性动脉瘤形成(图1C),遂再次行腔内隔绝术,支架放置于腹腔干上方。术后行PET/CT提示腹主动脉(T10~L2水平)周围巨大肿块,包裹腹腔干及肠系膜上动脉,范围约11.8 cm×9.0 cm×10.0 cm,考虑恶性病变,全身其余部位未见明确转移(图3)。出院后患者未行辅助治疗。2015年3月,患者因心力衰竭去世。



血管内膜肉瘤是假性动脉瘤形成的罕见病因,术前诊断困难。
肿瘤所在部位的假性动脉瘤治疗难度大,腔内治疗可作为急诊救治的措施,术中开窗技术是保证重要脏器灌注的主要方法。
假性动脉瘤均应积极寻找病因,对怀疑恶性者应尽可能行病理检查。
肿瘤相关假性动脉瘤的腔内治疗可作为应急治疗手段,但无法改善患者最终预后。
对于明确为恶性的患者,应以手术治疗为主,术中应将病变血管及双侧切缘送病理检查,以求整体切除肿瘤。
血管内膜肉瘤是罕见的高度恶性肿瘤,原发于大动脉内膜,最常累及肺动脉干,亦常累及主动脉、股动脉等主动脉主要分支[1,2]。该病极为罕见,病因尚不清楚,临床可因肿瘤生长、脱落及继发血栓形成、血栓脱落而表现为血管腔内占位、血管假性缩窄、外周动脉栓塞等表现。极少数主动脉内膜肉瘤可同时向腔内及腔外生长,形成腹膜后肿物、动脉瘤,甚至出现动脉瘤破裂[3,4]。其中以肾动脉受累为主要表现的内膜肉瘤目前全世界仅有2例[5,6],Sethi等[5]报道1例以难治性高血压、双肾动脉狭窄为首诊表现的病例,于腔内治疗过程中取活检明确病理诊断,虽病程中多次行腔内治疗,但未能手术整体切除病灶或放化疗,最终患者在术后短期内死亡。本例患者以左肾假性动脉瘤起病,虽术后未对左肾动脉行病理检查,但结合患者右肾动脉病理提示血管内膜肉瘤,左肾动脉残端在术后早期即被软组织包绕,残端动脉瘤逐渐增大及后期PET/CT提示包绕左肾动脉残端及腹主动脉的肿物为恶性,因此不能除外左肾假性动脉瘤形成与肿瘤侵袭相关。患者左肾切除近1年内相继出现左肾动脉残端及腹主动脉假性动脉瘤,腔内治疗后短期复发,因病变紧邻或位于内膜肉瘤内部,因此考虑反复假性动脉瘤形成与肿瘤相关。
病理是诊断该病的金标准。血管内膜肉瘤的影像学表现常不特异,但可协助鉴别内膜肉瘤与其他动脉管腔内占位性病变。该病好发于大动脉,超声常难以探及,且难以鉴别其与血栓或动脉粥样硬化性斑块。增强CT可显示管腔内占位病变、动脉瘤、假性动脉瘤或远处转移灶,但因内膜肉瘤常无明显强化,且可出现动脉壁钙化,故极难与动脉粥样硬化鉴别[7]。目前认为钆增强MRI是诊断该病较好的手段,肿物边缘强化,可为分叶状长T1、长T2信号,可与动脉粥样硬化性斑块、血栓机化等良性病相鉴别[7,8,9]。此外,内膜肉瘤易出现骨转移,因此当怀疑该病时应早期完善全身骨扫描、PET/CT等全身筛查[10]。结合本例患者血管内膜肉瘤部位标准摄取值(SUV)明显升高,因此PET/CT对难以明确性质的血管腔内占位亦有重要诊断价值。
内膜肉瘤极为罕见,目前尚未形成公认的治疗方案。虽然尚无明确证据表明手术治疗优于放化疗。但因手术可明确诊断、缓解管腔狭窄、避免肿瘤栓子继续脱落、减轻肿瘤负荷,甚至可能整体切除病变并重建血管,故仍是首选治疗。动脉瘤虽然为内膜肉瘤的罕见表现,但由于动脉瘤破裂出血可导致患者迅速死亡,因此预防及相关治疗尤为重要。目前对于内膜肉瘤尚未发现明确的危险因素及病因,因此预防极为困难。对于肿瘤破裂出血的治疗目前分为腔内治疗与肿瘤整体切除,尚未有放化疗对动脉瘤治疗效果的报道。腔内治疗仅暂时缓解症状,无法延长患者生存时间[3,5,11],本例患者虽行腔内治疗,但由于疾病进展,术后短期内再次出现假性动脉瘤形成。肿瘤整体切除可减少术后动脉瘤复发并延长生存时间。目前绝大部分内膜肉瘤的诊断均来自术后病理,往往发现切缘阳性,于是为内膜肉瘤进展及动脉瘤形成提供可能。术前和术中的正确诊断可促使医师选择根治性手术方式,进而从根本上预防动脉瘤形成及破裂出血。
其他手术方式包括动脉内膜剥脱术(EA)、肿瘤整体切除术(EBR)[12]。既往多认为在内膜肉瘤中,肿瘤细胞局限于管腔内皮及栓子的表面,而不侵及中膜或外膜,因此认为EA可以切除肿瘤[10,13]。但越来越多病例显示内膜肉瘤可沿内膜水平扩散或向血管中膜和外膜浸润性生长,甚至达血管外[4,14],因此目前多认为,对怀疑内膜肉瘤者,应尽量行EBR并于术中对病变组织及双侧切缘送病理检查。
在行EBR的患者中,切缘阴性的患者好于切缘阳性者,无远处栓塞者好于有远处栓塞患者;进一步发现,对于行EBR且切缘阴性者,无远处栓塞患者的预后好于存在远处栓塞患者;而对于行EBR且切缘阳性者,即使无远处栓塞亦不能改善预后;行EA的患者无论术前是否有远处转移,其预后均差于行EBR者。行腔内治疗、姑息手术或未手术患者常短期内死亡[1,3,5,8,11,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32]。既往病例说明能否完整切净肿瘤及是否存在栓塞均明显影响患者预后,其中肿瘤切除的完整性对患者预后的影响更大。由于EA的手术范围明显小于EBR,因此术后生存期亦短于EBR。但需要说明,由于患者就诊时实际病程长短差异大,该病没有标准治疗方案,所以相同治疗方案的效果差别大;又因为该病数量极少,所以不同组别间术后生存期难以形成显著统计学差异。尽管如此,考虑到本病极为罕见,仅对术后生存期平均值进行综合比较亦对临床有很大指导意义。本例患者术后病理明确诊断为血管内膜肉瘤,并术后短期内相继出现与肿瘤相关的左肾残端假性动脉瘤和腹主动脉假性动脉瘤,首选治疗应为EBR。但考虑患者一般情况差,且肿瘤包绕主动脉、腹腔干、肠系膜上动脉等重要血管,手术风险极大,遂行腔内姑息治疗。由于病变部位紧邻关键动脉,因此术中行动脉覆膜支架开窗术。腔内治疗后患者生命体征迅速恢复稳定,疼痛明显缓解,暂时起到了延长生命、改善症状的作用。但由于未能整体切除肿瘤,故对患者整体预后无改善。
放疗和化疗对内膜肉瘤的效果尚存在争议,目前的放化疗建议多基于其他软组织肉瘤[12],其中化疗以多柔比星和异环磷酰胺为主[10]。对于存在瘤栓、远处转移及手术无法完全切除的患者,建议应用放疗或化疗[9,10,33,34]。即使已行EBR者,术后序贯以放疗或化疗亦可一定程度延长生存期[14,35]。有病例报道显示放疗5个月后肿瘤可坏死近20%[4]。
该病预后极差,有文献显示[8],平均生存时间仅为(16.0±2.4)个月,3年生存率为11.2%,5年生存率为8%。


























