
评估中国活体肾移植受者移植前及移植后早期各项因素与急性排斥反应(AR)发生的相关性。
这是一个多中心回顾性注册研究的亚组分析,纳入1995年1月至2008年12月间在中国接受活体肾移植的1 255例受者,其中男921例(73.4%),平均年龄(33±10)岁。对于患者发生AR的情况进行了单因素分析,同时应用多因素Logistic回归对可能影响AR发生的风险因素进行分析。
共106例(8.4%)受者发生肾移植术后AR,而其余1 149例患者无AR发生。多变量分析显示,受者年龄和冷缺血时间(CIT)对发生AR有显著的影响(OR:0.956,95% CI:0.923~0.990;OR:1.006,95% CI:1.002~1.011)。AR受者严重感染的发生率较无AR受者显著升高(38.7%比10.8%,P<0.000 1),而二者具有类似的新发糖尿病和肿瘤的发生率。
受者年龄较轻与较长的CIT是活体肾移植术后AR的风险因素。减少CIT和对年轻受者加强重症监护管理有益于肾移植患者的术后恢复。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是最成功的一种主要器官移植方式,目前广泛存在于临床实践中[1],但是移植器官的短缺仍然是一个严峻的挑战。活体肾移植供体是解决这一问题的重要途径之一。相对于接受透析或接受死亡供体肾移植患者,接受活体肾移植的患者会有更好的生存率和临床预后[2]。急性排斥反应(acute rejection, AR)是肾移植失败的风险之一[3],也是影响移植物长期存活的最主要障碍[4]。AR也是移植肾功能下降的风险因素,这是由于在AR治疗后基线肾功能不能完全恢复而亚临床细胞损伤可能继续发生。此外,AR是移植患者心血管和总体死亡率的一个风险因素。虽然免疫抑制剂,包括钙调神经磷酸酶抑制剂(calcineurin inhibitors,CNI)(如环孢素A和他克莫司)、雷帕霉素靶蛋白抑制剂、霉酚酸(mycophenolic acid,MPA)和霉酚酸酯(mycophenolate mofetil,MMF)以及生物免疫抑制剂(如多克隆和单克隆抗体),已经被应用于预防AR,但其发生率下降并不理想[5]。因此,减少AR的风险因素对提高肾移植术后的长期存活是非常重要的。
目前认为受者年龄、输注红细胞(red blood cells transfusion,RBCT)导致的人类白细胞抗原(HLA)致敏、冷缺血时间(cold ischemia time,CIT)和白细胞介素(interleukin,IL)-17F的单核酸多态性可能是AR的风险因素。缩短CIT有助于降低AR和移植失败的发生。关于RBCT的研究,已经报道其可以诱导供体特异性抗HLA抗体和HLA Ⅰ/Ⅱ类群体反应性抗体(panel reactive antibody,PRA),两者都与增加抗体介导排斥反应相关[6],尽管这一观察还具有争议性[7,8]。
本亚组分析基于一个多中心的注册研究,该研究目的为评估和分析中国接受亲属活体肾移植受者的长期存活率和相关的风险因素,而本研究中针对活体肾移植后患者是否发生AR而进行了亚组分析,观察和分析患者AR发生情况及相关风险因素。
这项回顾性亚组研究是应用多中心注册表来进行的,用于分析在中国接受活体肾移植患者的情况。本研究的每个中心,都通过独立伦理委员会(independent ethics committee,IEC)或机构审查委员会(institution review board,IRB)的审批,研究是基于赫尔辛基宣言的伦理原则进行。根据国际医学组织理事会的指导方针,在获得IEC或IRB的批准后,可以免于签署知情同意书。
受者包括在1995年1月至2008年12月间接受活体肾移植的男、女患者,年龄18~75岁。排除标准:(1)多器官移植的受者;(2)患者在其医疗记录中明确表示不愿意公开他/她的诊断和治疗信息;(3)未完成移植后12个月随访的患者。共纳入1 255例受者,同时纳入受者的供者,即1 255名供者。
复查所有肾移植受者的医疗记录,包括年龄、性别和终末期肾病的病因;移植前乙型肝炎和丙型肝炎血清学检测;透析种类和持续时间;移植肾功能延迟恢复(delayed graft function,DGF)、急性或慢性排斥、合并症和最初的免疫抑制治疗方案(药物、剂量)、治疗变化(方案、剂量和频率)、拒绝治疗的原因、伴随药物(解酸剂、降血糖药、降压药和其他药物)等。
分析受者血清中HLAⅠ/Ⅱ PRA时分别采用流式PRA-Ⅰ筛分试验(One Lambda,Canoga Park,加利福尼亚,美国)和流式PRA-Ⅱ筛分试验(One Lambda),具体操作参照制造商提供的说明书进行。
不良事件是指在数据收集过程中发现的异常征兆、症状或实验室检测结果。所有不良事件,即使其被认为与免疫抑制剂或干预无关,都需记录下来。不良事件包括:AR、严重感染、活检证实的CNI相关肾毒性、移植后肿瘤以及死亡。严重不良事件为死亡。AR临床表现通常为发热、全身不适、移植物肿大、疼痛,伴有移植物功能突然减退;同时需使用皮质类固醇冲击治疗或T细胞清除性抗体治疗。活检证实的急性排斥反应(biopsy-proven acute rejection,BPAR)采用2013年Banff标准评级的病理结果确定[9]。肾功能恶化是指移植术后肾小球滤过率(glomerular filtration rate,GFR)降到低于30 ml·min-1·(1.73 m2)-1。同时收集了其他不良结果的数据,包括恶性肿瘤、原发肾病的复发、慢性肝病和住院情况等。
本研究计划纳入1 500例患者。根据先前的数据,受者和移植物的生存率在肾移植术后第1、3、5和10年都在50%以上。当有多个存活率可以参照以及其他条件固定的情况下,最可靠的样本大小在存活率50%的基础上计算而得。因此,假设存活率为50%(α=5%)和容许误差为5%,在此基础上计算得到的样本存活率可以看作是总体存活率的估计值,所需的样本大小是1 537例。
应用SAS 9.1.3软件罗列和总结数据。描述性统计可用于分析包括人口统计学、病史、主要结局和所有安全信息的数据。有效病例(缺失病例)的数目、均值、标准差、中位数和上下四分位数都表示为连续数据。分类数据用次数和百分比来表示。分类变量的比较采用χ2检验或Fisher精确检验。基于向后似然率(α=0.2)的多回归分析用于确定移植后AR的相对风险,同时测定比值比(OR)和95%置信区间,统计显著性以P≤0.05为准。
肾移植供者和受者的人口学资料见表1。供者的平均年龄为(44±12)岁,而受者的平均年龄为(33±10)岁。总体上,47.7%的供者是男性,而73.4%的受者是男性。
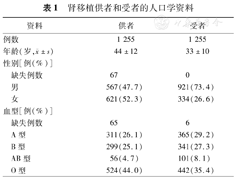
肾移植供者和受者的人口学资料
肾移植供者和受者的人口学资料
| 资料 | 供者 | 受者 | |
|---|---|---|---|
| 例数 | 1 255 | 1 255 | |
年龄(岁, ±s) ±s) | 44±12 | 33±10 | |
| 性别[例(%)] | |||
| 缺失例数 | 67 | 0 | |
| 男 | 567(47.7) | 921(73.4) | |
| 女 | 621(52.3) | 334(26.6) | |
| 血型[例(%)] | |||
| 缺失例数 | 65 | 6 | |
| A型 | 311(26.1) | 365(29.2) | |
| B型 | 299(25.1) | 341(27.3) | |
| AB型 | 56(4.7) | 101(8.1) | |
| O型 | 524(44.0) | 442(35.4) | |
肾移植术后,591例(47.1%)受者给予他克莫司,618例(49.2%)受者给予环孢素(新赛斯平、新山地明、田可),其中治疗中途换药的患者分别为接受他克莫司治疗的患者有20例,接受新赛斯平治疗的患者有73例,接受新山地明的患者54例,接受田可治疗的患者有17例。表2列出了所用的免疫抑制剂和血药浓度检测结果,结果表明所有的免疫抑制剂都维持在所需的浓度范围内。受者其他临床资料见表3。
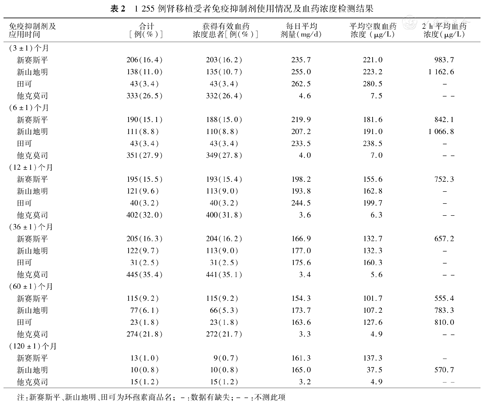
1 255例肾移植受者免疫抑制剂使用情况及血药浓度检测结果
1 255例肾移植受者免疫抑制剂使用情况及血药浓度检测结果
| 免疫抑制剂及应用时间 | 合计[例(%)] | 获得有效血药浓度患者[例(%)] | 每日平均剂量(mg/d) | 平均空腹血药浓度(μg/L) | 2 h平均血药浓度(μg/L) | |
|---|---|---|---|---|---|---|
| (3±1)个月 | ||||||
| 新赛斯平 | 206(16.4) | 203(16.2) | 235.7 | 221.0 | 983.7 | |
| 新山地明 | 138(11.0) | 135(10.7) | 255.0 | 223.2 | 1 162.6 | |
| 田可 | 43(3.4) | 43(3.4) | 262.5 | 280.5 | - | |
| 他克莫司 | 333(26.5) | 332(26.4) | 4.6 | 7.5 | -- | |
| (6±1)个月 | ||||||
| 新赛斯平 | 190(15.1) | 188(15.0) | 219.9 | 181.6 | 842.1 | |
| 新山地明 | 111(8.8) | 110(8.8) | 207.2 | 191.0 | 1 066.8 | |
| 田可 | 43(3.4) | 43(3.4) | 233.5 | 238.5 | - | |
| 他克莫司 | 351(27.9) | 349(27.8) | 4.0 | 7.0 | -- | |
| (12±1)个月 | ||||||
| 新赛斯平 | 195(15.5) | 193(15.4) | 198.2 | 155.6 | 752.3 | |
| 新山地明 | 121(9.6) | 113(9.0) | 193.8 | 162.8 | - | |
| 田可 | 40(3.2) | 40(3.2) | 244.5 | 199.7 | - | |
| 他克莫司 | 402(32.0) | 400(31.8) | 3.6 | 6.3 | -- | |
| (36±1)个月 | ||||||
| 新赛斯平 | 205(16.3) | 204(16.2) | 166.9 | 132.7 | 657.2 | |
| 新山地明 | 122(9.7) | 113(9.0) | 177.0 | 132.3 | - | |
| 田可 | 31(2.5) | 31(2.5) | 175.6 | 160.3 | - | |
| 他克莫司 | 445(35.4) | 441(35.1) | 3.4 | 5.6 | -- | |
| (60±1)个月 | ||||||
| 新赛斯平 | 115(9.2) | 115(9.2) | 154.3 | 101.7 | 555.4 | |
| 新山地明 | 77(6.1) | 66(5.3) | 173.7 | 107.2 | 783.3 | |
| 田可 | 23(1.8) | 23(1.8) | 163.6 | 127.6 | 810.0 | |
| 他克莫司 | 274(21.8) | 272(21.7) | 3.3 | 4.9 | -- | |
| (120±1)个月 | ||||||
| 新赛斯平 | 13(1.0) | 9(0.7) | 161.3 | 137.3 | - | |
| 新山地明 | 10(0.8) | 10(0.8) | 165.0 | 37.5 | 570.7 | |
| 他克莫司 | 15(1.2) | 15(1.2) | 3.2 | 4.9 | -- | |
注:新赛斯平、新山地明、田可为环孢素商品名;-:数据有缺失;--:不测此项
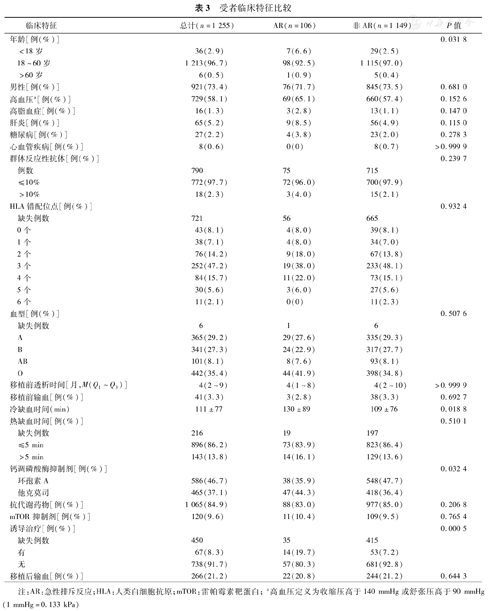
受者临床特征比较
受者临床特征比较
| 临床特征 | 总计(n=1 255) | AR(n=106) | 非AR(n=1 149) | P值 | |
|---|---|---|---|---|---|
| 年龄[例(%)] | 0.031 8 | ||||
| <18岁 | 36(2.9) | 7(6.6) | 29(2.5) | ||
| 18~60岁 | 1 213(96.7) | 98(92.5) | 1 115(97.0) | ||
| >60岁 | 6(0.5) | 1(0.9) | 5(0.4) | ||
| 男性[例(%)] | 921(73.4) | 76(71.7) | 845(73.5) | 0.681 0 | |
| 高血压a[例(%)] | 729(58.1) | 69(65.1) | 660(57.4) | 0.152 6 | |
| 高脂血症[例(%)] | 16(1.3) | 3(2.8) | 13(1.1) | 0.147 0 | |
| 肝炎[例(%)] | 65(5.2) | 9(8.5) | 56(4.9) | 0.115 0 | |
| 糖尿病[例(%)] | 27(2.2) | 4(3.8) | 23(2.0) | 0.278 3 | |
| 心血管疾病[例(%)] | 8(0.6) | 0(0) | 8(0.7) | >0.999 9 | |
| 群体反应性抗体[例(%)] | 0.239 7 | ||||
| 例数 | 790 | 75 | 715 | ||
| ≤10% | 772(97.7) | 72(96.0) | 700(97.9) | ||
| >10% | 18(2.3) | 3(4.0) | 15(2.1) | ||
| HLA错配位点[例(%)] | 0.932 4 | ||||
| 缺失例数 | 721 | 56 | 665 | ||
| 0个 | 43(8.1) | 4(8.0) | 39(8.1) | ||
| 1个 | 38(7.1) | 4(8.0) | 34(7.0) | ||
| 2个 | 76(14.2) | 9(18.0) | 67(13.8) | ||
| 3个 | 252(47.2) | 19(38.0) | 233(48.1) | ||
| 4个 | 84(15.7) | 11(22.0) | 73(15.1) | ||
| 5个 | 30(5.6) | 3(6.0) | 27(5.6) | ||
| 6个 | 11(2.1) | 0(0) | 11(2.3) | ||
| 血型[例(%)] | 0.507 6 | ||||
| 缺失例数 | 6 | 1 | 6 | ||
| A | 365(29.2) | 29(27.6) | 335(29.3) | ||
| B | 341(27.3) | 24(22.9) | 317(27.7) | ||
| AB | 101(8.1) | 8(7.6) | 93(8.1) | ||
| O | 442(35.4) | 44(41.9) | 398(34.8) | ||
| 移植前透析时间[月,M(Q1~Q3)] | 4(2~9) | 4(1~8) | 4(2~10) | >0.999 9 | |
| 移植前输血[例(%)] | 41(3.3) | 3(2.8) | 38(3.3) | 0.692 7 | |
| 冷缺血时间(min) | 111±77 | 130±89 | 109±76 | 0.018 8 | |
| 热缺血时间[例(%)] | 0.510 1 | ||||
| 缺失例数 | 216 | 19 | 197 | ||
| ≤5 min | 896(86.2) | 73(83.9) | 823(86.4) | ||
| >5 min | 143(13.8) | 14(16.1) | 129(13.6) | ||
| 钙调磷酸酶抑制剂[例(%)] | 0.032 4 | ||||
| 环孢素A | 586(46.7) | 38(35.9) | 548(47.7) | ||
| 他克莫司 | 465(37.1) | 47(44.3) | 418(36.4) | ||
| 抗代谢药物[例(%)] | 1 065(84.9) | 88(83.0) | 977(85.0) | 0.206 8 | |
| mTOR抑制剂[例(%)] | 120(9.6) | 11(10.4) | 109(9.5) | 0.765 4 | |
| 诱导治疗[例(%)] | 0.000 5 | ||||
| 缺失例数 | 450 | 35 | 415 | ||
| 有 | 67(8.3) | 14(19.7) | 53(7.2) | ||
| 无 | 738(91.7) | 57(80.3) | 681(92.8) | ||
| 移植后输血[例(%)] | 266(21.2) | 22(20.8) | 244(21.2) | 0.644 3 | |
注:AR:急性排斥反应;HLA:人类白细胞抗原;mTOR:雷帕霉素靶蛋白;a高血压定义为收缩压高于140 mmHg或舒张压高于90 mmHg(1 mmHg=0.133 kPa)
肾移植术后,106例(8.4%)受者发生AR,而27例(2.2%)受者发生BPAR。BPAR受者根据Banff分期,0.7%(9/1 255)受者显示为ⅠA级,0.1%(1/1 255)受者为ⅠB级,0.6%(8/1 255)受者为ⅡA级,其余受者未明确分级。在移植术后6个月,AR和非AR组中血清肌酐水平分别为(132.00±50.17)μmol/L和(112.40±30.23)μmol/L(P<0.000 1),两组临床资料比较详见表3。AR组接受不同种类的CNI患者中,他克莫司比例高于环孢素(44.3%比35.9%,P=0.032 4)。
多因素分析表明,根据受者性别、血型、HLA、PRA、RBCT病史和移植前的透析时间校正后,受者年龄和CIT显著影响AR的发生,CIT较长的年轻患者更容易发生AR(表4)。多因素分析还显示,受者年龄、采用不同种类的CNI和mTOR抑制剂显著影响BPAR的发生(表4)。
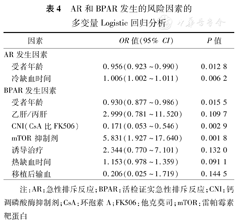
AR和BPAR发生的风险因素的多变量Logistic回归分析
AR和BPAR发生的风险因素的多变量Logistic回归分析
| 因素 | OR值(95% CI) | P值 | |
|---|---|---|---|
| AR发生因素 | |||
| 受者年龄 | 0.956(0.923~0.990) | 0.012 8 | |
| 冷缺血时间 | 1.006(1.002~1.011) | 0.006 2 | |
| BPAR发生因素 | |||
| 受者年龄 | 0.930(0.877~0.986) | 0.015 5 | |
| 乙肝/丙肝 | 2.999(0.781~11.520) | 0.109 7 | |
| CNI(CsA比FK506) | 0.171(0.053~0.546) | 0.002 9 | |
| mTOR抑制剂 | 5.831(1.927~17.640) | 0.001 8 | |
| 诱导治疗 | 2.344(0.770~7.101) | 0.132 0 | |
| 热缺血时间 | 1.153(0.978~1.359) | 0.091 1 | |
| 移植后输血 | 0.206(0.025~1.719) | 0.144 5 | |
注:AR:急性排斥反应;BPAR:活检证实急性排斥反应;CNI:钙调磷酸酶抑制剂;CsA:环孢素A;FK506:他克莫司;mTOR:雷帕霉素靶蛋白
325例(25.9%)患者发生不良事件,其中,17例(1.4%)患者出现严重不良事件。16例(1.3%)患者发生移植术后新发糖尿病(new-onset diabetes mellitus, NODM),165例(13.1%)患者出现严重感染,106(8.4%)例患者发生AR,11例(0.9%)患者发生CNI相关肾毒性(经活检证实),而10例患者(0.8%)被诊断为移植后肿瘤。AR受者严重感染的发生率明显高于无AR受者[38.7%(41/106)比10.8%(124/1 149),P<0.000 1],肿瘤和NODM的发生率在AR和非AR组间差异无统计学意义[0比0.9%(10/1 149),2.8%(3/106)比1.1%(13/1 149),均P>0.05]。在106例AR的患者中,7例(6.6%)死亡,而在1 149例非AR患者中,有10例(0.9%)死亡,差异有统计学意义(P<0.000 1)。
本研究结果显示,受者年龄、CIT是AR发生的风险因素,而受者年龄、使用不同种类的CNI和使用mTOR抑制剂是BPAR发生的风险因素。而AR组接受不同种类的CNI患者中,他克莫司比例高于环孢素。
CIT在肾移植中起着关键性作用。CIT延长是肾功能受损相关的一个早期风险因素。然而,关于CIT对于肾移植长期预后影响的报道存在不同说法。有结果表明CIT延长是肾移植后DGF的一个风险因素,但对移植物存活并没有影响[10]。但是Bahde等[11]报道,CIT延长不仅是DGF的风险因素,同时可能也会降低移植物存活率风险因素。AR是影响移植肾功能和长期存活的一个早期影响因素。Sert等[7]对死者供体肾移植受者CIT与AR和DGF的相关性进行了研究,发现受者CIT与AR并没有明显的相关性,然而本研究结果显示,AR发生的受者CIT不仅明显高于未发生AR的受者,同时多因素分析结果还表明CIT是AR的一个风险因素,这一情况可能与移植物供体的差异有关。此外,受者性别、体质量指数、既往移植史、伴随感染或疾病等都不影响AR发生[12]。我们的数据显示受者性别、血型、HLA不匹配、PRA、RBCT病史和移植前透析时间对肾移植AR的发生没有影响,与既往结果[12]一致。我们的数据支持van der Vliet等[13]在肾移植中应该尽量减小CIT的建议。
本研究的结果表明,受者年龄是AR的一个重要风险因素,年轻患者中具有更高AR风险。王振等[14]的研究结果也显示,中国人群中老年供者年轻受者是AR的独立危险因素。印度肾移植人群的研究结果也显示了类似的结果,他们发现AR的发生率似乎在年老供者组要低于年轻供者组[15]。同样,Dempster等[16]提供的证据表明,65岁以上老年患者在肾移植后同样也能获得较好的临床结局。对于移植物的存活情况,虽然印度人群的研究结果指出老年受者以及接受来自60岁或以上供者的患者移植物存活率最低[15],但Kwon等[17]的研究结果显示年龄并不是肾移植后移植物长期存活的一个独立风险因素。
基于巴利昔单抗、兔抗胸腺细胞球蛋白和IL-2受体拮抗剂是肾移植中预防AR的主要诱导治疗方案。一项随机试验证明诱导治疗可以降低AR和BPAR的发生率[18],而改善全球肾脏病预后组织(KDIGO)临床实践指南建议诱导治疗作为肾移植患者起始免疫抑制治疗方案[19]。但是,本研究表明,与非AR组相比,AR组中更高比例患者接受了诱导治疗,这可能是由于诱导治疗大量数据缺失,不能准确地分析诱导治疗的影响。
关于他克莫司与环孢素A对于肾移植AR的影响,既往研究显示,与环孢素A相比,他克莫司对于肾移植后AR的预防作用以及远期临床结局效果更优[20,21]。叶琴等[22]通过对31篇随机对照试验进行了荟萃分析,同样发现他克莫司抑制肾移植后AR优于环孢素A的效果。本研究中,未发现CNI类抗排斥药物与BPAR发生的相关性,这可能是因为BPAR患者的样本量太少以及包含了其他的混杂因素。另外以上研究并非针对活体肾移植患者,因此在活体肾移植人群当中他克莫司、环孢素A和AR之间的关系还需要进一步的研究。
本研究发现,血型、移植前透析时间和RBCT史对AR的发生没有影响。既往研究中,Chung等[23]报道移植前较长时间的透析与系统性红斑狼疮患者肾移植术后较高的AR发生率相关。移植前输血被认为是抗体介导的排斥反应和移植失败的一个风险因素[6,24]。本研究结果显示,只有3.3%患者接受移植前输血,因此推测,没有这一因素的影响可能是由于样本量太小。NODM、严重感染和肿瘤是肾移植术后的重要不良事件。诱导治疗会增加感染和肿瘤发展的可能性。本研究中,13.1%的受者发生严重感染,AR组中的发生率要高于非AR组(38.7%比10.8%);总体上,0.8%的受者进展为癌症而1.3%的患者进展为NODM。此研究中恶性肿瘤的发生率要比Lim等[25]报道的6.5%的受者进展为肿瘤的发生率要低。这一情况可能由于本研究中长期随访的人数较少,同时患者对移植后肿瘤发生的认识还不够,可能会影响肿瘤的检出率。患有AR的受者以及接受T细胞清除抗体治疗的受者比没患有AR的患者具有更高的患癌症的风险[25]。Schweer等[26]的研究中,16.7%的患有移植后糖尿病的患者曾接受抗排斥激素冲击治疗,并转换为他克莫司治疗。然而,本研究未观察到用药与NODM明显的相关性,可能也与对NODM的重视度低和检出率低有关。
本研究有几个局限性:首先,本研究是一个亚组分析而不是一个随机对照试验,因此,患者选择偏倚和不可测量的干扰因素可能会影响结果。其次,我们的研究结果是否适合其他中心,也是未知的。最后,患者群体,特别是接受诱导治疗的患者的样本量比较小,其可能影响结果的准确性。这些问题都需要在未来的研究中加以解决。
总之,年轻受者和CIT延长是活体肾移植后发生AR的风险因素,医治年轻患者的医师能意识到这一点是非常重要的。减少CIT有益于改善肾移植患者的AR的发生。



























