
研究肝型、脑型肝豆状核变性(WD)患者脑部结构性损伤、功能活动水平、金属沉积方面的差异。
选取2013年7月至2016年5月中山大学附属第一医院WD患者40例(脑型20例,肝型20例),健康对照20名。进行弥散张量成像(DTI)、静息态功能磁共振(rs-fMRI)、磁敏感呈像(SWI)、金属代谢检查。选取苍白球、尾状核头、壳核、丘脑、小脑、黑质、红核为感兴趣区(ROI)。在DTI上测定RIO的部分各向异性值(FA),λ值;测定各核团之间联系纤维的数目、FA值。在rs-fMRI测定ROI的ALFF值和ERHO值。在SWI上测量ROI相位值(CP)。将肝型、脑型WD患者影像学指标和金属代谢指标进行对比分析。
肝型WD患者多个核团、核团之间联系纤维DTI指标较脑型有差异。脑型尾状核、丘脑ALFF值低于肝型(P=0.037,0.040);尾状核REHO值低于肝型(P=0.029)。脑型WD患者右侧尾状核、左侧壳核SWI相位值较肝型WD患者低(P=0.020,0.23)。肝型WD患者血清铁含量较正常增高(P=0.013),肝型WD患者尿铜高于脑型(P=0.021)。
肝型WD患者脑部核团存在结构性损伤,有神经元自发性活动和协调性损伤及金属异常沉积。肝型患者脑部的结构性和功能性损伤较脑型患者轻微,而金属沉积与脑型的差异不显著。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝豆状核变性(Wilson disease, WD),是一种常染色体隐性遗传的铜代谢障碍疾病。特征是铜蓝蛋白合成不足以及胆道排铜障碍。以肝硬化、脑部尤其是基底节变性、角膜K-F环以及肾损害等为主要表现。根据患者的临床症状,可将WD患者分为肝型(以肝硬化症状为主,无明显神经、精神症状)、脑型[以神经症状和(或)精神症状为主要表现,肝脏症状轻微]和混合型。肝型患者脑部是否有金属沉积及结构性损伤,肝型患者为何没有出现明显神经症状,这些问题目前没有明确的认识。本研究通过肝脑型WD患者影像学及金属代谢方面的对比,分析了肝脑型WD患者在脑部金属沉积、结构性损伤方面的区别,试图解释肝型WD患者没有出现神经症状的原因。
收集2013年7月至2016年5月中山大学附属第一医院未经治疗的住院WD患者,入选15~25岁的肝型或脑型WD患者,均符合肝豆状核变性诊断标准[1]:铜蓝蛋白<0.2 g/L,24 h尿铜>100 μg,角膜K-F环阳性,有阳性家族史。排除标准:混合型WD患者(同时具有明显肝硬化症水和神经/精神症状的患者)。入组WD患者40例(脑型20例,肝型20例)。选取与患者年龄相匹配的健康志愿者20名。所有对象均签署知情同意书,经医院伦理委员会批准。
对WD患者、健康对照进行血清铁、血清铁饱和度、血清铜、尿铜、肝功能的检测。金属指标通过原子吸收分光光度计火焰法测定。
肝型WD患者进行Child肝功能分级。
采用1.5T Philips Achieva Nova Dual Plus超导MR扫描仪,8通道SENSE Head线圈。横断面SE T1WI (TR 488 ms,TE 15 ms),横断SE T2WI(TR 3 600 ms,TE 100 ms),FOV 250 mm×250 mm,矩阵256×256,层厚7 mm,层间隔0.7 mm,NSA=2 。DTI采用单次激发自旋回波成像序列,32个扩散编码方向,TR 9 500 ms,TE 70 ms,FOV 250 mm×250 mm,矩阵128×128,层厚2 mm,层间隔0 mm,NSA=1,扩散加权系数(b值)分别为0、1 000 s/mm2。
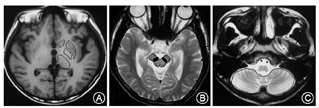
选取苍白球、尾状核头、壳核、丘脑、小脑、黑质6个感兴趣区(ROI)。ROI的设置由两位不知道分组情况的神经影像学医师进行(图1)。各个感兴趣区在显示最清楚的层面固定位置进行选取。分别测量各感兴趣区ADC值、FA值以及弥散张量矩阵的三个特征值λ1、λ2、λ3。

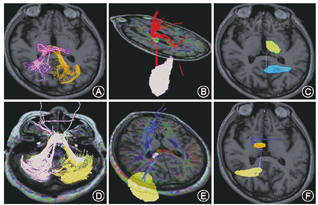
利用DTI-FiberTrack软件对DTI图像进行分析处理。用脑白质扩散张量成像连续示踪纤维分配技术,进行各ROI之间联系纤维束的重建。测定联系纤维的数目,测定各联系纤维FA值。
对WD患者和健康对照进行SWI检查。采用1.5T Philips Achieva Nova Dual Plus超导MR扫描仪和8通道SENSE Head线圈。扫描序列是3D-FFE序列,TR/TE 60 ms/40 ms,NSA 1,FOV 240 mm×240 mm,FA 18,分辨率1 mm×1 mm×0.5 mm,回波转移(echo shift):on。SWI扫描得到的相位数据传输到离机电脑,使用SPIN软件对原始相位图像进行高通滤波,使用64×64的低通滤波器,用原始图像除以滤波后的K空间数据得到校正相位图。SWI采集时分别获得强度和相位的信息,得到强度图和相位图。分别测量各感兴趣区的CP值。
使用SIEMENS 3.0T MAGNETOM Verio MRI扫描仪和8通道SENSE Head线圈。受检者静息平卧,固定头部,用棉花塞耳以降低噪音。获取解剖图像用三维快速扰相梯度翻转恢复(3D mprage)序列。TR/TE 1 900 ms/2.52 ms,FOV 250 mm×250 mm,矩阵246×256,层厚1 mm,层距0.5 mm,扫描时间4.18 min。fMRI扫描序列采用平面回波成像梯度回波(EPI GRE)序列:TR/TE 2 000 ms/30 ms,FOV 192 mm×192 mm,矩阵64 ×64,层数36,层厚3 mm,层距0.75 mm,扫描时间6.46 min,采集次数200。
图像预处理使用统计参数图(SPM5)软件进行。保留静息状态时间序列190个时间点的数据,剔除前10个时点,进行DICOM格式转换,头动校正,层面定时。将图像配准到标准蒙特利尔空间,重新采样3 mm各向同性的体素,以8 mm×8 mm×8 mm全宽半高对图像数据进行高斯平滑。
通过REST软件对静息态fMRI进行ALFF分析和REHO分析。测定苍白球、壳核、尾状核、丘脑的ALFF值和REHO值。采用线性回归方法将预处理后的数据去除其线性趋势。为了减少低频漂移和高频生理性噪音,通过Hamming带通滤波,对提取的时间曲线进行处理,提取ALFF值。为了得到每个体素标准化后的ALFF值,将每个体素的ALFF值除以全脑平均ALFF值。将标准化后的高分辨力3D T1加权图像平均后,形成全脑的平均结构图。利用XjView软件确定对应MNI坐标上有统计意义脑区的具体解剖位置。
用 ±s记录检查结果。WD患者与健康对照的影像学指标比较用t检验。肝、脑型患者指标比较用t检验和方差分析法。用SPSS 13.0软件进行统计学分析。
±s记录检查结果。WD患者与健康对照的影像学指标比较用t检验。肝、脑型患者指标比较用t检验和方差分析法。用SPSS 13.0软件进行统计学分析。
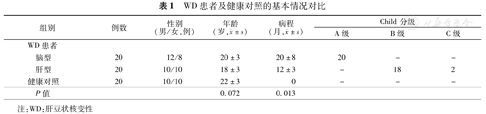
肝、脑型WD患者与健康对照的年龄差异无统计学意义(表1)。
WD患者及健康对照的基本情况对比
WD患者及健康对照的基本情况对比
| 组别 | 例数 | 性别(男/女,例) | 年龄(岁, ±s) ±s) | 病程(月, ±s) ±s) | Child分级 | ||
|---|---|---|---|---|---|---|---|
| A级 | B级 | C级 | |||||
| WD患者 | |||||||
| 脑型 | 20 | 12/8 | 20±3 | 20±8 | 20 | - | - |
| 肝型 | 20 | 10/10 | 18±3 | 12±3 | - | 18 | 2 |
| 健康对照 | 20 | 10/10 | 22±3 | 0 | - | - | - |
| P值 | 0.072 | 0.013 | |||||
注:WD:肝豆状核变性
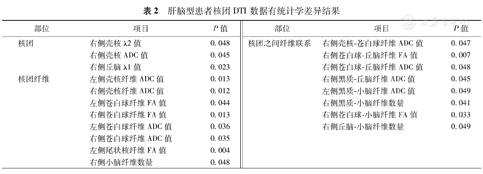
通过独立样本t检验,肝脑型患者多个核团、核团纤维、核团之间联系纤维DTI数据差异有统计学意义(表2,图2)。
肝脑型患者核团DTI数据有统计学差异结果
肝脑型患者核团DTI数据有统计学差异结果
| 部位 | 项目 | P值 | 部位 | 项目 | P值 |
|---|---|---|---|---|---|
| 核团 | 右侧壳核λ2值 | 0.048 | 核团之间纤维联系 | 右侧壳核-苍白球纤维ADC值 | 0.047 |
| 右侧壳核ADC值 | 0.045 | 右侧苍白球-丘脑纤维FA值 | 0.007 | ||
| 右侧丘脑λ1值 | 0.023 | 右侧苍白球-丘脑纤维ADC值 | 0.048 | ||
| 核团纤维 | 左侧壳核纤维ADC值 | 0.013 | 右侧黑质-丘脑纤维ADC值 | 0.045 | |
| 右侧壳核纤维ADC值 | 0.012 | 左侧黑质-小脑纤维ADC值 | 0.049 | ||
| 左侧苍白球纤维FA值 | 0.044 | 右侧黑质-小脑纤维数量 | 0.041 | ||
| 右侧苍白球纤维FA值 | 0.013 | 右侧苍白球-小脑纤维FA值 | 0.033 | ||
| 左侧苍白球纤维ADC值 | 0.036 | 右侧丘脑-小脑纤维数量 | 0.049 | ||
| 右侧苍白球纤维ADC值 | 0.035 | ||||
| 左侧尾状核纤维FA值 | 0.004 | ||||
| 右侧小脑纤维数量 | 0.048 |

WD患者肝功能等级与以下DTI指标有相关性:左侧尾状核纤维FA值(t=-0.734,P=0.004);右侧苍白球-丘脑纤维FA值(t=-0.988,P=0.003)。
脑型WD患者双侧黑质、丘脑、尾状核、壳核和小脑的相位值较健康对照降低(黑质t=3.48,2.24,P=0.023,0.046;丘脑t=1.90,2.44,P=0.036,0.039;尾状核t=3.51,1.44,P=0.047,0.031;壳核t=5.03, 4.90, P=0.015,0.033;小脑t=1.76,1.22,P=0.026,0.042(表3)。
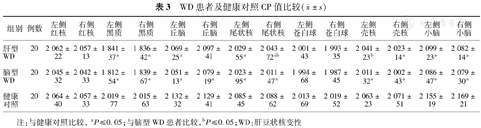
WD患者及健康对照CP值比较( ±s)
±s)
WD患者及健康对照CP值比较( ±s)
±s)
| 组别 | 例数 | 左侧红核 | 右侧红核 | 左侧黑质 | 右侧黑质 | 左侧丘脑 | 右侧丘脑 | 左侧尾状核 | 右侧尾状核 | 左侧苍白球 | 右侧苍白球 | 左侧壳核 | 右侧壳核 | 左侧小脑 | 右侧小脑 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 肝型WD | 20 | 2 062±22 | 2 057±13 | 1 841±37a | 1 836±42a | 2 069±25a | 2 097±41 | 2 029±55a | 2 043±72ab | 2 001±43 | 1 993±35 | 2 041±23b | 2 023±14a | 2 099±23a | 2 082±14a |
| 脑型WD | 20 | 2 045±32 | 2 042±33 | 1 812±54a | 1 839±67a | 2 051±13a | 2 079±19a | 2 023±95a | 2 011±47a | 1 994±68 | 1 987±45 | 2 011±32a | 2 002±43a | 2 086±47a | 2 079±30a |
| 健康对照 | 20 | 2 064±40 | 2 057±33 | 2 019±77 | 2 015±63 | 2 132±32 | 2 129±41 | 2 085±45 | 2 088±62 | 2 013±69 | 2 019±52 | 2 063±23 | 2 071±51 | 2 155±19 | 2 169±21 |
注:与健康对照比较,aP≤0.05;与脑型WD患者比较,bP≤0.05;WD:肝豆状核变性
肝型WD患者双侧黑质的相位值较健康对照降低,t=2.64,2.14,P=0.033,0.048;左侧丘脑的相位值较正常降低,t=1.54,P=0.044;双侧尾状核的相位值较正常降低,t=2.36,2.97,P=0.043,0.039;右侧壳核的相位值较正常降低,t=2.14,P=0.029;双侧小脑的相位值较正常降低,t=1.26,0.37,P=0.016,0.030。CP值与肝功能等级无相关性。
通过独立样本t检验,脑型WD患者右侧尾状核、左侧壳核SWI相位值较肝型WD患者低(P值分别为:0.020,0.23,图3)。

肝型WD患者血清铁含量较健康对照高(P=0.013);脑型和肝型WD患者总铁结合力低于正常(P=0.031,0.022);肝型WD患者尿铜高于脑型患者(P=0.021,表4)。
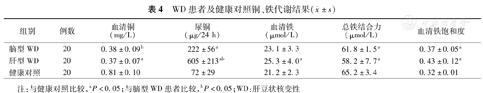
WD患者及健康对照铜、铁代谢结果( ±s)
±s)
WD患者及健康对照铜、铁代谢结果( ±s)
±s)
| 组别 | 例数 | 血清铜(mg/L) | 尿铜(μg/24 h) | 血清铁(μmol/L) | 总铁结合力(μmol/L) | 血清铁饱和度 |
|---|---|---|---|---|---|---|
| 脑型WD | 20 | 0.38±0.09b | 222±56a | 23.1±3.3 | 61.8±1.5a | 0.37±0.05a |
| 肝型WD | 20 | 0.37±0.07a | 605±213ab | 25.3±4.0a | 58.2±7.7a | 0.43±0.12a |
| 健康对照 | 20 | 0.81±0.10 | 72±29 | 21.2±2.3 | 65.2±3.4 | 0.32±0.01 |
注:与健康对照比较,aP<0.05;与脑型WD患者比较,bP<0.05;WD:肝豆状核变性
通过t检验,脑型尾状核、丘脑ALFF值低于肝型WD患者(P=0.037,0.040);脑型尾状核REHO值低于肝型WD患者(P=0.029,表5)。

肝、脑型WD患者ALFF、REHO值表( ±s)
±s)
肝、脑型WD患者ALFF、REHO值表( ±s)
±s)
| 指标 | 组别 | 例数 | 尾状核 | 苍白球 | 壳核 | 丘脑 |
|---|---|---|---|---|---|---|
| ALFF | 脑型WD | 20 | 4.7±1.3a | 6.6±0.9 | 6.0±0.8a | 5.3±1.0a |
| 肝型WD | 20 | 7.0±3.1b | 5.6±1.6a | 5.8±2.1a | 7.9±3.0b | |
| 健康对照 | 20 | 8.2±0.6 | 7.0±0.8 | 7.3±0.8 | 7.6±0.5 | |
| REHO | 脑型WD | 20 | 5.0±0.7a | 6.8±1.2 | 8.1±0.9 | 7.3±0.7a |
| 肝型WD | 20 | 7.5±2.4b | 7.0±2.0 | 7.5±2.1 | 8.2±2.2 | |
| 健康对照 | 20 | 8.4±0.7 | 7.8±0.6 | 7.4±2.0 | 8.2±0.9 |
注:与健康对照比较,aP<0.05;与脑型WD患者比较,bP<0.05;WD:肝豆状核变性
DTI可用于纤维束追踪,显示脑白质纤维束的走行情况,是观察和追踪脑白质纤维束的非侵性检查方法[2,3]。DTI的指标中,FA、λ值可量化反映轴索髓鞘损伤的情况[4]。既往研究发现,DTI在帕金森病(PD)、多系统萎缩(MSA)、进行性核上性麻痹(PSP)、阿尔茨海默病(AD)等多种疾病早期诊断、疾病进展和治疗效果的评估有重要意义[5,6]。我们发现肝型WD患者在核团、核团投射纤维以及核团之间的联系纤维存在DTI指标异常,如FA值降低、纤维数量下降。提示肝型WD患者,在锥体外系核团以及核团之间的联系纤维存在脱髓鞘和轴索损伤等结构性损伤。但是肝型WD患者在核团、核团纤维以及核团之间联系纤维的DTI指标,与脑型患者存在较多差异,提示肝型患者脑部纤维联系的损伤程度低于脑型患者。锥体外系核团及联系纤维损伤程度低,可能是肝型患者尚未出现神经症状的原因之一。
静息态磁共振是分析静息状态下,脑部神经元自发性功能活动的方法。其中REHO法和ALFF法分别从全脑局部时间序列的相似性、脑自发活动水平的程度方面进行研究[7]。本研究发现,肝型WD患者皮质下核团如苍白球、壳核的ALFF值低于正常,提示肝型WD患者脑部核团神经元自发性活动水平降低,肝型WD患者脑部存在功能活动的下降。同时,肝、脑型WD患者在某些核团的ALFF值和REHO值有差异。这提示从功能角度,肝型WD患者脑部核团神经元活动性的损伤与脑型患者存在差异。
在本研究中,肝脑型患者在金属代谢方面具有差异。未治疗的肝型患者尿铜高于脑型患者,这可能与肝型WD患者肝内铜含量高有关。铜蓝蛋白是一种亚铁氧化酶,铁需要铜蓝蛋白氧化才能和转铁蛋白结合。由于铜蓝蛋白的异常,WD可能存在铁代谢的异常。我们发现,肝型WD患者血清铁增高,证实WD患者有铁代谢异常。同时肝型WD患者血清铁稍高于脑型患者,其原因有可能与肝型WD患者肝功能异常明显,铜蓝蛋白异常较脑型明显,导致血清铁增高明显。
SWI是检测脑部金属沉积的有效方法,铁、锰、铜和钙可被SWI检测出来。SWI可定量测量物质的磁敏感效应引起的相位值的改变,从而间接估计该物质的含量,可作为测定物质浓度的非侵入性方法[8,9,10,11,12]。WD患者脑病核团相位值改变可能是铜和铁共同作用的结果。我们通过SWI研究发现,肝型WD患者黑质、尾状核、壳核、丘脑、小脑等部位的SWI相位值较正常降低,提示这些核团有金属的沉积。有研究认为肝型和脑型WD脑铜含量无差别[13]。在我们对脑型和肝型SWI相位值的比较中可见,脑型WD患者在壳核、尾状核等部位的相位值低于肝型,提示肝型WD患者脑部某些核团金属含量低于脑型。但是肝脑型WD患者核团SWI相位值的差异并不显著,肝型WD患者脑部金属沉积量与脑型相比并无太大差异。导致肝型WD患者未出现神经症状的原因,可能并不是肝型患者脑部金属沉积少,而是脑部结构性损伤不显著。但为何肝型患者脑部金属沉积明显,而结构性损伤较轻,原因尚不明确。可能除了金属沉积之外,还有其他原因,导致WD患者脑部的结构性损伤,这尚需进一步研究证实。另外,肝型WD患者脑部金属沉积与肝功等级无关,肝功能情况不会影响金属在脑部的沉积。
综上,通过DTI和rs-fMRI的研究可知,肝型WD患者脑部核团存在结构性损伤,有神经元自发性活动和协调性损伤。通过SWI研究可知,肝型WD患者脑部核团有金属异常沉积。通过与脑型患者的比较可知,肝型患者脑部的结构性和功能性损伤较脑型患者轻微,而金属沉积与脑型的差异不显著。肝型患者未出现明显神经症状的原因,可能是其脑部结构性损伤尚未达到可出现神经症状的程度。



























