
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2型多发性内分泌腺瘤(multiple endocrine neoplasia type 2,MEN2)是以甲状腺、肾上腺髓质和甲状旁腺等神经内分泌细胞发生肿瘤或增生为主要特征的癌症综合征,呈常染色体显性遗传,外显率高,发病年龄早。MEN2包括2种亚型:MEN2A和MEN2B[1]。发病率约为1/30 000[1,2,3]。
MEN2A[在线人类孟德尔遗传数据库(OMIM):171400]又称Sipple综合征,约占MEN2的95%[1]。分为4种变异型[1]:(1)经典型MEN2A;(2)MEN2A伴皮肤苔藓淀粉样变(cutaneous lichen amyloidosis,CLA);(3)MEN2A伴先天性巨结肠症(hirschsprung disease, HSCR);(4)家族性甲状腺髓样癌(familial medullary thyroid carcinoma,FMTC;OMIM:155240)。经典型MEN2A的临床主要表现为2种或以上特定的内分泌肿瘤:甲状腺髓样癌(medullary thyroid carcinoma,MTC;发生率95%~100%)、肾上腺嗜铬细胞瘤(pheochromocytom,PHEO;50%)和甲状旁腺功能亢进(hyperparathyroidism,HPT;20%~30%)。MEN2A患者起始发病可表现为甲状腺C细胞增生(C-cell hyperplasia, CCH)或MTC,双侧、多中心性。典型MTC先证者在35岁前可有颈部肿块或颈痛、血清降钙素(Ct)和(或)癌胚抗原升高、腹泻(30%)等,较散发性MTC发病相对较早[1]。MEN2A-PHEO一般在MTC后发生或伴发,13%~27%的PHEO先于MTC发生,大多位于肾上腺内(99.1%),常呈双侧(61.3%)、多中心,恶性罕见(0.4%)[1,2,3,4]。临床表现可为阵发或持续性高血压(68.9%),血或尿中儿茶酚胺及其代谢产物升高可以是疾病的唯一异常[1,4]。MEN2A-HPT症状大多轻微或伴发高钙尿症和肾结石[1,2,3]。少部分MEN2A患者伴发肩背部区域(T2~T6)瘙痒性CLA(9%)[5]或伴发HSCR(7%)[5]。FMTC约占MEN2的15%,临床诊断FMTC需在多代家族成员间MTC是其唯一的临床传递形式,或家族中至少4人以上患有MTC且不伴其他内分泌腺肿瘤[1,2,3,5]。
MEN2B(OMIM:162300)又称Wagenmann-Froboese综合征,约占MEN2的5%[1]。MEN2B患者很早就表现为侵袭性MTC,20%的MEN2B患儿在1岁内可出现典型临床表型:双侧甲状腺多发肿块或伴颈部淋巴结肿大。其他症状包括PHEO(50%)、舌前背、腭、咽黏膜神经节瘤(70%~100%)和胃肠道弥漫性神经节瘤(40%~90%)、眼部异常(上睑缘外翻,泪液分泌减少)、角膜增厚(60%~90%)和马方综合征样体征(75%)等,或伴发无临床意义的甲状旁腺瘤/增生[1,2,3]。
原癌基因RET(OMIM:164761)定位于人类染色体10q11.2,含21个外显子,编码含1 114个氨基酸的酪氨酸激酶受体。典型的RET蛋白包括一个巨大的胞外区、一个跨膜区和一个胞内激酶区,与胶质细胞衍生神经营养因子(GDNF)家族配体GDNF、neurturin、persephin和artemin相互作用,转导细胞分化和生长信号,通过细胞遗传学重排激活成为致癌基因。种系水平RET突变可导致起源于神经嵴细胞的MEN2的发生,目前已发现超过166种RET变异体,其中70余种RET突变体可引起MEN2的发生(http://www.arup.utah.edu/database/MEN2/MEN2_welcome.php)。与MEN2相关的RET突变大多为杂合点突变,突变热区主要集中于RET基因第5、8、10、11和13~16外显子。95%的MEN2A为RET胞外区第10和11外显子突变[1,2,3],表现为半胱氨酸残基被替换,形成畸变同源二聚体,导致胞内酪氨酸激酶的组成性激活。MEN2B几乎均为RET胞内结构域的第15和16外显子突变[1,2,3,5],突变位于酪氨酸激酶的催化核心,造成RET激酶主要以单体形式表现的组成性激活。MEN2临床表型与RET基因突变型相关性[1,5]见表1。
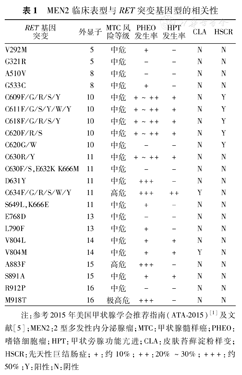
MEN2临床表型与RET突变基因型的相关性
MEN2临床表型与RET突变基因型的相关性
| RET基因突变 | 外显子 | MTC风险等级 | PHEO发生率 | HPT发生率 | CLA | HSCR |
|---|---|---|---|---|---|---|
| V292M | 5 | 中危 | + | - | N | N |
| G321R | 5 | 中危 | - | - | N | N |
| A510V | 8 | 中危 | - | - | N | N |
| G533C | 8 | 中危 | + | - | N | N |
| C609F/G/R/S/Y | 10 | 中危 | +~++ | + | N | Y |
| C611F/G/S/Y/W/Y | 10 | 中危 | +~++ | + | N | Y |
| C618F/G/R/S/Y | 10 | 中危 | +~++ | + | N | Y |
| C620F/R/S | 10 | 中危 | +~++ | + | N | Y |
| C620G/W | 10 | 中危 | - | - | N | Y |
| C630R/Y | 11 | 中危 | +~++ | + | N | N |
| C630F/S,E632K K666M | 11 | 中危 | - | - | N | N |
| D631Y | 11 | 中危 | +++ | - | N | N |
| C634F/G/R/S/W/Y | 11 | 高危 | +++ | ++ | Y | N |
| S649L,K666E | 11 | 中危 | + | - | N | N |
| E768D | 13 | 中危 | - | - | N | N |
| L790F | 13 | 中危 | + | - | N | N |
| V804L | 14 | 中危 | + | + | N | N |
| V804M | 14 | 中危 | + | + | Y | N |
| A883F | 15 | 高危 | +++ | - | N | N |
| S891A | 15 | 中危 | + | + | N | N |
| R912P | 16 | 中危 | - | - | N | N |
| M918T | 16 | 极高危 | +++ | - | N | N |
然而,文献[1,2,3,4,5]报道和本课题组[6,7]均发现,同一类型RET突变,可存在不同的MEN2A亚型和疾病进展。较常见的C634R/Y可导致经典MEN2A或FMTC;C634R/Y子代可出现比亲代更早、更复杂的表型,如子代伴有PHEO,而亲代不伴PHEO。相同或不同RET基因型间,诸如C634、V804M伴CLA或不伴CLA;在RET第10外显子尤其C620突变者中可伴发HSCR,呈现RET突变的两面性(获得功能和失去功能突变)。口服小分子多靶点酪氨酸激酶抑制剂如凡德他尼等治疗转移性MTC,疗效可存在明显差异,反映了MEN2发生进展除遗传背景因素影响外,可能还存在其他致病或修饰因子和(或)个体体细胞二次突变打击,如体细胞RAS等驱动基因突变或Sprouty1等抑癌基因高度甲基化的共同影响。
依据MEN2的表型可做出临床诊断,但MEN2的精准诊断需基于种系RET突变检测,后者是诊断MEN2的金标准,也是与散发MTC/PHEO/HPT的本质区别所在[1,3,8]。国际MTC诊治指南:美国甲状腺协会(ATA)-2015 [1]、欧洲甲状腺学会(ETA)-2012 [3]和美国国家综合癌症网(NCCN)-2010[8]均推荐对所有首诊MTC患者进行RET突变检测,对突变者的其他家族成员进行RET突变筛查:(1)MTC患者一生中进行一次RET突变检测可明确是否为MEN2;(2)循MEN2患者进行家系调查和RET突变筛查可发现RET突变者在没有出现MEN2临床症状前得以早期明确诊断;(3)依据RET突变危险分级整合Ct水平等,对MEN2患者实施早期规范治疗或监视随访;(4)有别于无症状散发MTC患者,大多限于体检发现或经穿刺活检病理明确诊断后才进行治疗;(5)5.6%~9.0%的MEN2A为De novo RET突变[5],90%的MEN2B为De novo RET-M918T所致[9],有利于此部分原先考虑"散发MTC"诊断的修正及其子代的治疗或监视;(6)MEN2相关伴随疾病的及早准确诊治;(7)有利于MEN2的预防。MEN2临床筛查和临床早期干预措施见表2。
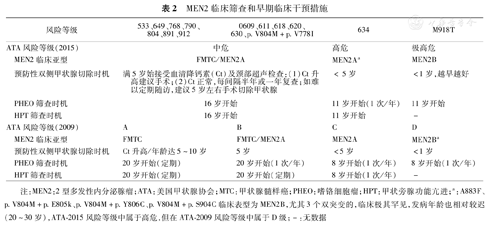
MEN2临床筛查和早期临床干预措施
MEN2临床筛查和早期临床干预措施
| 风险等级 | 533、649、768、790、804、891、912 | 0609、611、618、620、630、p.V804M+p.V778I | 634 | M918T | |
|---|---|---|---|---|---|
| ATA风险等级(2015) | 中危 | 高危 | 极高危 | ||
| MEN2临床亚型 | FMTC/MEN2A | MEN2Aa | MEN2B | ||
| 预防性双侧甲状腺切除时机 | 满5岁始接受血清降钙素(Ct)及颈部超声检查:(1)Ct升高建议手术;(2)Ct正常,每间隔半年或一年复查;如难以定期随访,建议5岁左右手术切除甲状腺 | < 5岁 | <1岁,越早越好 | ||
| PHEO筛查时机 | 16岁开始 | 11岁开始(1次/年) | 11岁开始 | ||
| HPT筛查时机 | 16岁开始 | 11岁开始 | - | ||
| ATA风险等级(2009) | A | B | C | D | |
| MEN2临床亚型 | FMTC | FMTC/MEN2A | MEN2A | MEN2Ba | |
| 预防性双侧甲状腺切除时机 | Ct升高/年龄达5~10岁 | 5岁 | <5岁 | <1岁 | |
| PHEO筛查时机 | 20岁开始(定期) | 20岁开始(1次/年) | 8岁开始(1次/年) | 8岁开始(1次/年) | |
| HPT筛查时机 | 20岁开始(定期) | 20岁开始(定期) | 8岁开始(1次/年) | - | |
注:MEN2:2型多发性内分泌腺瘤;ATA:美国甲状腺协会;MTC:甲状腺髓样癌;PHEO:嗜铬细胞瘤;HPT:甲状旁腺功能亢进;a:A883F、p.V804M+p.E805k、p.V804M+p.Y806C、p.V804M+p.S904C临床表型为MEN2B,尤其3个双突变的,临床极其罕见,发病年龄也相对较迟(20~30岁),ATA-2015风险等级中属于高危,但在ATA-2009风险等级中属于D级;-:无数据
然而,由于检测血清Ct方法等的差异,国内外尤其国人尚未形成诊断MTC的统一血清学Ct参考阈值[1,10]。而如何精确界定MEN2-MTC发生和MTC淋巴结转移的Ct阈值(基础和激发Ct阈值)关系到RET突变者的CCH/MTC早期甄别和精准诊治:界定最佳手术时机[精细化判断什么时候实施预防性甲状腺全切除(PTT)],选择恰当手术范围(是否并行预防性Ⅵ区或侧颈部淋巴结切除),实施个体化的精准治疗,提高MEN2-MTC的无瘤存活率和总生存率,或进行有效的临床前动态监视[5,10,11]。此外,整合RET突变者的血/尿3-甲氧基肾上腺素和去甲3-O-甲基肾上腺素,结合薄层CT扫描和131I-间碘苄胍检查,诊断符合率可达98%以上,进而可提高包括无症状PHEO患者的检出率。但国内常检测的是血/尿儿茶酚胺,其阳性率仅约60%,影响MEN2-PHEO术前精准定性诊断[4,12]。
至于RET突变的检测或筛查,需伦理委员会核准、知情同意,采集外周血2~5 ml提取DNA,RET基因PCR扩增、鉴定、纯化,先对RET突变热区进行直接测序,如无突变,需补充RET非热区突变检测[1,3]。近年来,基于下一代的外显子组和目标区域捕获测序技术,对有多个外显子(如>15个)且无同源重复序列的特定基因的全编码区、非翻译区(UTR)及两侧翼区的测序提供了准确、快捷、实用的测序方法[13,14]。本课题组[6,7,12,13,14,15]在前期52个MEN2家系中发现19种RET突变基因型:C634F/G/R/S/W/Y、C620R/S、C618G/R/S/Y、C611Y、L790F、V804M、S891A、M918T、634Y/V292M/R67H/R982C和V292M/R67H/R982C,绝大多数位于RET突变热区[1,3]。此外,本课题组采用下一代目标区域捕获测序技术还发现V69M、A98T、R114H、Q194H、T278N、A1105V和A1068S/A1068V这7种RET罕见变异体和2种非热区可疑新突变(另文报道)。提示该技术有利于开展对包括MEN2在内的单基因遗传性疾病的基因型-表型的相关性研究[1,13,14]。
由于MEN2-MTC对放、化疗均不敏感,目前认为手术是唯一能治愈MTC的方法。按1998年的TNM分期,Ⅰ、Ⅱ、Ⅲ和Ⅳ期MTC的10年特异生存率分别为100%、93%、71%和21%;伴远处转移者(IVC期)其1、5、10年的生存率仅为51%、26%和10%[1,2,3]。临床上当患者出现MTC症状就诊时,大多已有颈部淋巴结转移,此时即使接受广泛的颈部手术,术后仅10%可获得治愈[1,2,5]。如术前无症状且MTC直径<1.0 cm、Ct<150 ng/L及颈部无转移,往往患者预后极好。如患者术后基础/激发Ct均检测不到,其10年特异MTC生存率几乎达100%[1,5]。MEN2的早诊断、早治疗是提高患者无瘤生存率、减少MEN2-MTC病死率的根本方法,同时还可减少或避免患者因MTC复发和(或)转移而实施多次颈部手术,以及可能导致的甲状旁腺功能低下及喉返神经损伤等并发症。由于RET突变者其一生中患MTC风险几乎达100%,故基于种系RET突变检测的早期MEN2诊断显得尤为重要(98%的MEN2存在RET突变)[1,3,8]。基于预防性切除一个器官的原则[5]:(1)相对于MEN2来说,进行RET突变检测即有了一个可靠的方法来识别MTC发生于患者的一个特定器官(甲状腺);(2)甲状腺切除后有经得起检验的合适功能替代(优甲乐等);(3)切除甲状腺后给患者带来的风险较小;(4)切除甲状腺后有一个敏感方法来确定患者是否已治愈和(或)MTC残留(Ct及超声等检查)。RET突变者的PTT是目前预防或治愈MEN2-MTC最有效方法。Elisei等[11]认为ATA-A~C级的PTT时机应在激发Ct试验阳性时实施,且独立于RET突变类型和患者年龄。而Pelizzo等[16]认为ATA-B~C级仍应参照ATA-2009指南推荐5岁内实施PTT。最近,修正后的ATA-2015[1]调整了RET分级[ATA-MOD(中危)、H(高危)和HST(极高危)]及危险分层外科手术时机,强调颈部超声检查及Ct检测,尤其强调了Ct水平正常的MEN2患者定期随访的重要性(表2)。本课题组[7,10]也发现ATA-A~B级(ATA-MOD)及Ct正常者,可积极随访监视;而ATA-C~D级(H~HST)且年龄>5岁,均已存在CCH/MTC伴Ct升高,应积极实施PTT[6,10]。至于预防性颈部淋巴结切除的时机和切除范围,ATA-2015仍建议ATA-MOD~H(A~C)和Ct<40 ng/L,应避免Ⅵ区淋巴结切除,而Elisei等[11]认为Ct< 60 ng/L,本课题组[10]发现Ct<71.4 ng/L时,MEN2A-MTC仍局限于甲状腺内,可避免预防性Ⅵ区淋巴结切除;并当Ct低浓度时,化学发光免疫法较放射免疫法测定具有更高的灵敏性及准确性(100%比40%,P<0.001);认为基于RET整合Ct水平检测,更有利于MEN2A-MTC的早期诊断和早期个体化精准治疗。
有关MEN2-PHEO的治疗,Castinetti等[4]和本课题组联合全球30家研究单位,分析了563例MEN2-PHEO的临床资料发现,PHEO患者大多为RET第11和10外显子突变(占92.8%),保留肾上腺皮质功能的肾上腺切除术(ASS)术后复发风险为2.6%[平均随访(10±9.5)年],ASS可明显减少肾上腺全切除术后患者出现的Addison样或终生激素依赖(87%比43%,P=0.03),认为腹腔镜下的ASS是治疗MEN2-PHEO优先术式选择。通常,至少单侧均原位保留15%~30%或至少保留一侧1/3正常肾上腺组织,患者术后可避免激素替代[4,12,15]。ATA-2015指南[1]也推荐处置MEN2-PHEO应优先选择腹腔镜下的ASS。但需注意:(1)对于MEN2-PHEO患者,术前均需口服足够的α-受体阻滞剂和积极扩容,可减少或避免术中出现血压激烈波动。(2)并发MEN2相关肿瘤时应先行PHEO切除术,以免在其他手术时诱发高血压危象。(3)患者在接受双侧PHEO切除术前、术后一段时间,需补充一定量的糖皮质激素,并根据其术后血清皮质醇和促肾上腺皮质激素(ACTH)水平,调整考虑是否需要激素替代,可防止或减少患者术后Addison危象。(4)MEN2-PHEO女性患者,最好在计划怀孕前3个月或已妊娠的早、中期处置PHEO。(5)术前明确诊断,术中精确切除肿瘤并尽可能保留正常肾上腺组织(尽管部分多发性和体积巨大的PHEO患者最终难免实施了肾上腺全切术),有利于减少肿瘤残存率和复发率,可有效减少或防止MEN2-PHEO的临床危害[1,2,3,4,6,15]。
ATA-2015指南[1]推荐存在下列特征的患者,建议进行遗传学咨询和种系RET突变检测:(1)"散发"MTC患者;(2)遗传性MTC患者的一级亲属;(3)婴幼儿存在典型MEN2B患者及其父母;(4)MEN2A-CLA患者;(5)伴发HSCR和RET基因10号外显子突变的婴幼儿童;(6)有临床症状支持HSCR并伴发MEN2A的成人者。
此外,临床上可通过提取孕妇羊水中脱落细胞、绒毛组织或富集分离孕妇外周血胎儿细胞或DNA,进行RET突变的有创或无创产前诊断,或进行植入前遗传学诊断(PGD)[1]:提取MEN2夫妻体外受精培养3 d形成的卵裂球(8个细胞)中的1~2个卵裂球细胞进行RET基因诊断,选取没有RET突变的胚胎,植入子宫,可从根本上消除MEN2的发生。本课题组与上海交通大学合作,胚胎植入前利用基于下一代测序技术对胚胎单个细胞实施全RET测序诊断,已顺利产下一例父亲为MEN2A(RET-C634Y)的"PGD健康女婴" ,随访至今已6个月(另文报道)。
总之,基于RET突变检测,可精确诊断MEN2;实施产前和植入前基因诊断,预防(preventive)MEN2发生(一级预防);整合Ct等生化水平,可预测(predictive)MEN2的进展,进而实施早期个性化(personalized)精准(precision)医疗(二级预防);着力提高对MEN2的认识和认知水平,是当前一个急迫的课题,需要更广泛的人员(医务人员和患者及其家属)和相关组织机构的共同参与(participatory),进而可全面促进(promotion)MEN2的综合诊治水平的提高(包括综合补救治疗的三级预防)。重视MEN2的"6P诊治策略"的分子诊断和管理,有效实践转化医学和精准医学,可最大限度地避免或减少MEN2的临床危害。


























