
探讨利奈唑胺治疗耐甲氧西林金黄色葡萄球菌(MRSA)血流感染的效果及安全性。
回顾性分析2010年1月至2014年4月浙江大学医学院附属第一医院确诊的52例MRSA血流感染患者的临床资料。按照利奈唑胺治疗方案分为初始治疗组(19例)和替换治疗组(33例)。比较分析两组患者临床特征、发热持续时间、临床有效率、细菌清除率、28 d病死率、药物不良反应等。
52例MRSA血流感染患者中复杂性血流感染比例高达82.7%(43/52);发热为最常见临床表现,占86.5%(45/52)。初始治疗组治疗前肾功能不全占68.4%(13/19);替换治疗组替换原因:持续发热或反复发热占69.7%(23/33)、糖肽类使用后肾功能损害占12.1%(4/33)、治疗期间出现新发MRSA感染病灶占18.2%(6/33)。初始治疗组与替换治疗组的治疗有效率[78.9%(15/19)比81.8%(27/33)]、发热持续时间[4(3,15)比12(5,24)d]、28 d病死率[15.8%(3/19)比9.1%(3/33)]、不良反应发生率[15.8%(3/19)比12.1%(4/33)]差异均无统计学意义(均P>0.05)。
利奈唑胺治疗MRSA血流感染临床效果好且较安全。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
金黄色葡萄球菌是引起菌血症常见的革兰阳性致病菌,尤其是耐甲氧西林金黄色葡萄球菌(MRSA),治疗棘手、严重影响患者的预后。万古霉素是MRSA血流感染的一线治疗药物,但因为肾毒性、组织渗透性差、缓慢的杀菌活性、最低抑菌浓度漂移等因素限制了其临床使用,临床上存在不少使用替代药物治疗MRSA血流感染的病例,其中利奈唑胺是最常用的替代药物之一。然而一项应用利奈唑胺与万古霉素治疗金黄色葡萄球菌导管相关血流感染的开放随机对照试验显示利奈唑胺组较对照组死亡风险更高[1],美国食品和药物管理局对使用利奈唑胺治疗MRSA所致的导管相关血流感染进行了警示[2]。同样2011年美国感染性疾病学会成人及儿童MRSA感染临床实践指南也未推荐利奈唑胺用于MRSA菌血症的治疗[3]。本研究回顾性分析初始使用利奈唑胺治疗MRSA血流感染52例患者的病例资料,探讨利奈唑胺治疗MRSA血流感染的疗效及安全性。
浙江大学医学院附属第一医院2010年1月至2014年4月临床确诊的52例MRSA血流感染患者。
(1)入选标准:血培养至少1次MRSA阳性、符合血流感染诊断标准、利奈唑胺治疗时间≥48 h、临床资料齐全。(2)排除标准:利奈唑胺治疗时间<48 h,临床信息资料不足,不能除外临床污染菌,治疗期间合并使用其他对MRSA有效的抗菌药物者。
收集包括人口特征、基础疾病、MRSA血流感染发生时的高危因素、临床特征、血培养以外培养阳性的部位、感染性休克发生率、综合治疗措施、临床治疗反应、发热持续时间、28 d病死率、药物不良反应等临床资料。
按照患者接受的利奈唑胺治疗方案分为初始治疗组(19例)和替换治疗组(33例)。初始治疗组指在MRSA血流感染诊断明确时选择利奈唑胺为初始治疗药物,替换治疗组指以糖肽类抗生素(万古霉素或替考拉宁)为初始治疗,≥3 d后替换为利奈唑胺。
细菌鉴定采用法国生物梅里埃公司VITEK-2细菌鉴定仪及配套革兰阳性菌鉴定卡GP鉴定菌种,质控菌株为金黄色葡萄球菌ATCC25923。采用法国生物梅里埃公司VITEK-2细菌鉴定仪配套革兰阳性菌药敏卡GP13进行药敏试验,判断折点采用2013年美国临床实验室标准化(CLSI)标准[4]。
(1)临床疗效:根据2004年公布的抗生素药物临床应用指导原则[5],通过治疗前后对患者症状、体征、实验室检查结果进行了比较。按治愈、显效、进步、无效4级评定临床疗效。治愈:治疗后症状体征实验室检查和病原学检查均恢复正常;显效:治疗后病情好转,但上述4项中有一项未完全恢复正常;进步:用药后病情好转,但不够明显;无效:用药后72 h后病情无明显进步或加重者。治愈、显效、进步总称为临床有效,无效为临床失败。(2)细菌学疗效判断标准:清除指治疗后病原菌消失;假设清除为治疗后病情显效,但未分离到病原菌或未行血培养;替换为原始分离的致病菌被清除,但培养出新的致病菌,无临床症状;未清除指治疗结束时细菌培养仍呈阳性。清除、假设清除及替换视为有效,未清除被视为无效。
感染性休克:诊断按照美国胸科医师学会和危重病医学会联席会议提出的标准[6],原发感染灶指体内在血流感染前其他部位有感染表现,且分离出MRSA。原发感染灶不明定义为不能证明其他部位有MRSA感染。感染灶分类[7]:(1)可根除感染灶:脓肿引流、手术切除心内膜赘生物、体内植入物的去除(尿管、起搏器、胃管、静脉置管、胸腔、腹腔、ERCP引流管、人工假体)。(2)不可根除感染灶:呼吸道感染、尿路感染、不能引流的皮肤软组织感染、骨髓炎、关节炎、胃肠道感染以及不明原因者。感染灶未根除包括感染灶不可根除以及可根除但未进行根除的患者。(3)简单性血流感染[8]:导管相关血流感染者在拔除导管后的1~4 d内行血培养并且培养阴性、72 h退热、超声心动图无阳性发现、关节以及血管系统无假体植入、无迁徙性病灶的依据。不符合简单性感染者即可诊断复杂性血流感染。
统一记录原始数据,采用SPSS 19.0统计学软件进分析,符合正态分布的连续变量以 ±s表示,组间比较采用t检验;非正态分布数据以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以构成比或百分率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;非正态分布数据以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以构成比或百分率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
符合入选标准的52例患者的基本资料见表1。52例均为院内获得性感染,其中复杂性血流感染比例高达82.7%(43/52),发生感染前2周内接受侵入性操作比例达76.9%(40/52)。患者均患有1种或多种基础疾病,以心血管疾病最常见,其次为肝、肾系统疾病等。诊断明确前经验性使用抗生素包括青霉素类、头孢菌素、喹诺酮类及碳青霉烯类等。最常见的临床表现为发热,其次为局部脓肿和咳嗽咳痰。
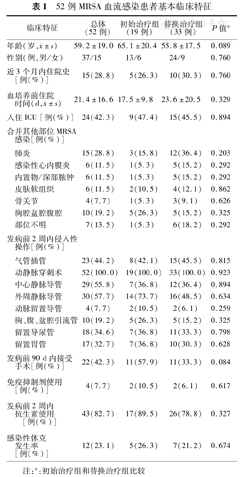
52例MRSA血流感染患者基本临床特征
52例MRSA血流感染患者基本临床特征
| 临床特征 | 总体(52例) | 初始治疗组(19例) | 替换治疗组(33例) | P值a | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 59.2±19.0 | 65.1±20.4 | 55.8±17.5 | 0.089 | |
| 性别(例,男/女) | 37/15 | 13/6 | 24/9 | 0.760 | |
| 近3个月内住院史 [例(%)] | 15(28.8) | 5(26.3) | 10(30.3) | 0.760 | |
血培养前住院 时间(d, ±s) ±s) | 21.4±16.6 | 17.5±9.8 | 23.6±20.5 | 0.329 | |
| 入住ICU [例(%)] | 24(42.3) | 9(47.4) | 15(45.5) | 0.894 | |
| 合并其他部位MRSA 感染[例(%)] | |||||
| 肺炎 | 15(28.8) | 3(15.8) | 12(36.4) | 0.203 | |
| 感染性心内膜炎 | 6(11.5) | 1(5.3) | 5(15.2) | 0.292 | |
| 内置物/深部脓肿 | 6(11.5) | 1(5.3) | 5(15.2) | 0.292 | |
| 皮肤软组织 | 6(11.5) | 2(10.5) | 4(12.1) | 0.862 | |
| 骨关节 | 4(7.7) | 1(5.3) | 3(9.1) | 0.626 | |
| 胸腔盆腔腹腔 | 10(19.2) | 5(26.3) | 5(15.2) | 0.325 | |
| 部位不明 | 7(13.5) | 1(5.3) | 6(18.2) | 0.292 | |
| 发病前2周内侵入性 操作[例(%)] | |||||
| 气管插管 | 23(44.2) | 8(42.1) | 15(45.5) | 0.815 | |
| 动静脉穿刺术 | 52(100.0) | 19(100.0) | 33(100.0) | 0.923 | |
| 中心静脉导管 | 29(55.8) | 7(36.8) | 12(36.4) | 0.894 | |
| 外周静脉导管 | 30(57.7) | 14(73.7) | 16 (48.5) | 0.634 | |
| 动脉留置导管 | 4(7.7) | 2(10.5) | 2(6.1) | 0.259 | |
| 胸、腹、盆腔引流管 | 10(19.2) | 5(26.3) | 5(15.2) | 0.325 | |
| 留置导尿管 | 18(34.6) | 7(36.8) | 11(33.3) | 0.798 | |
| 留置胃管 | 17(32.7) | 7(36.8) | 10(30.3) | 0.628 | |
| 发病前90 d内接受 手术[例(%)] | 22(42.3) | 11(57.9) | 11(33.3) | 0.084 | |
| 免疫抑制剂使用 [例(%)] | 4(7.7) | 2(10.5) | 2(6.1) | 0.617 | |
| 发病前2周内 抗生素使用[例(%)] | 43(82.7) | 17(89.5) | 26(78.8) | 0.327 | |
| 感染性休克 发生率 [例(%)] | 12(23.1) | 5(26.3) | 7(21.2) | 0.674 | |
注:a:初始治疗组和替换治疗组比较
(1)初始治疗组:选择利奈唑胺作为初始治疗药物的患者19例,其中68.4%(13/19)的患者治疗前存在肾功能异常,合并其他部位MRSA感染的占47.4%(9/19)。包括肺炎3例,感染性心内膜炎1例,腹腔、切口、髋关节、椎管植入物感染各1例,多处迁徙性病灶1例(血液、腹腔引流液、痰、咽拭子、腹透液均培养出MRSA)。利奈唑胺平均治疗时间16.0 d。治疗失败换用其他药物有2例,1例换用替考拉宁最终死亡,1例换用万古霉素治疗有效。(2)替换治疗组:33例患者使用糖肽类作为初始治疗后替换为利奈唑胺。糖肽类抗生素使用时间3~37 d,平均10.3 d。替换时间多见于疗程3~5 d,占45.5%(15/33);其次为6~14 d,占30.3%(10/33);≥20 d后替换者占12.1%(4/33)。(3)替换原因包括:①69.7%(23/33)患者临床治疗失败,包括持续发热不退,以及体温好转过程中再次发热,其中有3例出现感染性休克、4例合并肾功能受损;②4例治疗期间发生肾功能损伤;③4例治疗过程中出现心脏瓣膜赘生物,其中1例合并肺炎以及感染性休克、1例出现脑脓肿;④2例局部脓肿控制不佳。替换后利奈唑胺使用平均时间为20.8 d。
原发感染灶不明的病例7例,28 d死亡0例;感染部位明确病例45例,占86.5%(45/52),其中28 d死亡6例(12.2%),两组差异无统计学意义(P=1.000)。病灶不可清除26例,占50%,28 d死亡4例(15.4%);病灶可清除26例,28 d死亡2例(7.7%),两组差异无统计学意义(P=0.668)。可清除病灶包括导管感染、椎管植入物感染、心内膜赘生物、术后切口感染、可切排的皮肤软组织感染,腹腔、胆道、胸腔感染。26例病灶可清除病例中,18例进行病灶清除,28 d死亡1例(5.6%);8例未进行病灶清除,28 d死亡1例(12.5%),两组间差异无统计学意义(P=0.469)。替换治疗组中有84.8%(28/33)患者合并MRSA肺炎、感染性心内膜炎赘生物、肝脏、肾周、腹腔、硬膜外等局部脓肿,这些患者疗效差、持续高热或反复发热与存在血流以外的感染病灶、不能充分引流有关,这成为使用利奈唑胺替换糖肽类抗生素的重要原因。
(1)临床疗效评价:①发热持续时间:52例患者发热持续时间为9(4,20)d,初始治疗组较替换治疗组稍短,但两组间差异无统计学意义(P=0.056);②临床有效:初始治疗组与替换治疗组临床有效率相仿,两组差异无统计学意义;③28 d死亡:52例患者7 d死亡0例,14 d死亡2例(3.8%),28 d死亡6例(11.5%);利奈唑胺初始治疗组和替换治疗组28 d病死率差异无统计学意义(P=0.782)(表2)。(2)细菌学疗效评价:①7 d细菌清除率:13例清除、20例假设清除、替换1例、未清除15例、1例出院未评价,2例治疗失败、未留标本,7 d细菌清除率65.4%(34/52);②14 d细菌清除率:清除14例、假设清除27例、未清除9例、2例治疗失败未留标本,14 d细菌清除率78.8%(41/52)。
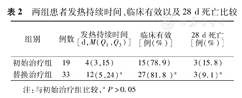
两组患者发热持续时间、临床有效以及28 d死亡比较
两组患者发热持续时间、临床有效以及28 d死亡比较
| 组别 | 例数 | 发热持续时间[d,M(Q1,Q3)] | 临床有效[例(%)] | 28 d死亡[例(%)] |
|---|---|---|---|---|
| 初始治疗组 | 19 | 4(3,15) | 15 (78.9) | 3(15.8) |
| 替换治疗组 | 33 | 12(5,24)a | 27 (81.8 )a | 3(9.1)a |
注:与初始治疗组比较,aP>0.05
两组患者出现血小板下降4例,皮疹2例,肝功能损害1例。总体初始治疗组不良反应发生率为15.8%(3/19),替换治疗组不良反应发生率为12.1%(4/33),两组差异无统计学意义(P>0.05)。
金黄色葡萄球菌尤其是MRSA是临床重要的致病菌,可导致皮肤软组织感染、菌血症、感染性心内膜炎、脑膜炎等,原因与侵入性操作、手术、皮肤黏膜破损、以及宿主免疫抑制有关[9]。高龄、有基础疾病(肿瘤、糖尿病、肝肾功能不全、心血管疾病等)、机械通气、侵入性操作、住院时间长、入住ICU等均是MRSA血流感染的主要危险因素[10]。本研究纳入的MRSA血流感染病例全部为院内感染,有侵入性操作及重大手术的比例高达80.8%。
万古霉素作为指南一线推荐治疗MRSA血流感染的药物疗效确切,在Ok等[11]的研究中糖肽类抗生素治疗MRSA血流感染的有效率64.2 %,病死率35.8%。Finkelstein等[12]的研究中金黄色葡萄球菌血流感染患者病死率为16%~43%。虽然在中国尚未出现万古霉素耐药的金黄色葡萄球菌,但也观察到万古霉素最低抑菌浓度漂移现象和异质性万古霉素中介的金黄色葡萄球菌,临床上出现了万古霉素治疗MRSA感染失败的病例[13]。美国IDSA指南推荐当持续菌血症超过治疗1周或者疾病初期病情重的患者,感染高万古霉素MIC值金黄色葡萄球菌,无论是否去除感染灶均可考虑使用利奈唑胺等药物替代万古霉素[3]。利奈唑胺其组织浓度较高,不需调整剂量即可用于轻度肝功能异常患者[14],当MRSA血流感染合并其他部位感染,发热持续时间长且治疗效果差,或者疾病初期、治疗过程中合并肝肾功能不全患者,可替换使用利奈唑胺。国内外数个临床试验结果显示利奈唑胺与标准治疗方案对MRSA感染的疗效相仿[15,16,17,18,19]。而在Neuner等[20]对MRSA持续性血流感染的研究中得出了利奈唑胺较标准治疗方案更有优势性的结论。本研究利奈唑胺初始治疗组和替换治疗组的患者临床有效率相当。利奈唑胺治疗期间未发现重大不良反应,4例患者血小板减少,停药后均恢复正常。
MRSA血流感染的治疗除了早期积极的抗菌药物治疗和支持治疗以外,还应尽早明确感染部位并积极清除感染灶,可清除感染灶患者的病死率常低于不可清除的患者[21]。既往研究发现在可清除感染灶患者中,清除病灶者菌血症相关病死率显著低于未清除者[7],而本研究中清除病灶者28 d病死率虽低于未清除者,但差异无统计学意义。原因可能与本研究复杂性血流感染患者较多、感染灶不能完全清除有关。因此,针对明确可清除感染灶的患者早期手术清创引流是控制感染的最有效手段。
综上所述,利奈唑胺初始或者替换治疗MRSA血流感染临床效果确切且安全性良好。但本研究为单中心、回顾性研究,样本量偏小,缺乏血培养的连续监测以准确评估微生物学转归,需多中心、大样本、前瞻性研究来进一步证实其疗效。



























