
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,45岁,农民,因"反复发热、咳嗽3年,再发加重40 d"于2015年7月18日入院。患者3年前无明显诱因下反复出现发热、咳嗽、咳痰,以干咳为主,体温最高37.8 ℃,每次自行口服消炎药或者至当地医院输液治疗后,发热、咳嗽可好转,具体诊治不详。40 d前患者再次出现发热、咳嗽,以低热为主,发热无明显规律,体温最高38.0 ℃,伴有盗汗、乏力,咳嗽呈干咳,无咳痰、咯血、胸痛、呼吸困难、乏力、纳差、肌肉痛和关节肿痛,并出现双下肢无痛性皮下结节。为进一步治疗遂于2015年6月17日在当地医院住院。胸部CT提示两肺多发小斑片状、大小不等结节状高密度影,右下肺团块状病变内不规则厚壁空洞形成,纵隔多发淋巴结肿大。初步诊断为:(1)两肺继发性肺结核并右下肺空洞形成?(2)肺癌?予四联抗结核(异烟肼、利福平、乙胺丁醇、吡嗪酰胺)15 d后发热、咳嗽无明显好转,行支气管检查和右肺上叶支气管黏膜活检和刷检术,支气管检查镜下考虑右上支气管、左下支气管结核可能性大,黏膜活检病理报告为"镜下见干酪样坏死,但未见结核结节,未见异型细胞、癌细胞,抗酸染色(-)" 。继续给予四联抗结核治疗15 d及抗真菌(氟康唑)、抗感染(头孢西丁)治疗,发热、咳嗽症状无缓解。7月8日查血结核杆菌特异性细胞免疫反应(-),随后予停抗结核治疗。因患者反复发热、咳嗽仍无明显好转,体温峰值较前升高,最高体温39.0 ℃,偶有咳黄痰,无咯血、呼吸困难。遂于7月18日转入我院治疗。患者发病以来体质量下降7.5 kg,睡眠、食欲尚可。既往否认鼻炎鼻窦炎,无肺结核及结核病接触史,否认糖尿病史。
入院体检:体温37.6 ℃,脉搏80次/min,呼吸20次/min,血压114/88 mmHg(1 mmHg=0.133 kPa)。全身浅表淋巴结未扪及肿大。鼻咽部检查未见异常,鼻窦检查未见异常。双肺呼吸音清,未闻及干湿啰音及胸膜摩擦音。心脏及腹部查体无特殊。四肢无畸形、无杵状指(趾),下肢无水肿。双下肢可触及散在大小不等的无痛性皮下结节,最大径约1.0 cm,表面无红肿、皮疹,质韧,无触痛,活动性尚可。
辅助检查:白细胞计数8.80×109/L,中性粒细胞百分比78.6%,淋巴细胞11.1%,单核细胞8.0%,嗜酸性粒细胞1.7%,嗜碱性粒细胞0.6%,红细胞计数5.59×1012/L,血红蛋白139 g/L,血小板267×109/L。血气分析:pH值7.47,氧分压69.0 mmHg,二氧化碳分压34.9 mmHg。超敏C-反应蛋白62.09 mg/L,红细胞沉降率27 mm/1 h。乳酸脱氢酶373 U/L(正常范围109~245 U/L),血清铁蛋白447.70 μg/L(正常范围30~400 μg/L),D-二聚体559 μg/L(正常范围0~450 μg/L)。呼吸系统肿瘤标志物中癌胚抗原正常,糖基抗原CA125 152.90 U/ml(正常范围0~35 U/ml)、非小细胞肺癌抗原细胞角质蛋白21-1片段4.11 μg/L(正常范围0~3.30 μg/L)和神经元特异性烯醇化酶23.89 μg/L(正常范围0~23 μg/L)。大便找到肝吸虫卵。尿常规、空腹血糖、肝肾功能、凝血功能、艾滋病抗体、丙肝抗体、梅毒检查均正常。类风湿因子、自身抗体谱、T细胞亚群、B细胞、自然杀伤(NK)细胞、IgA、IgG、IgM、甲状腺功能测定均正常。细菌毒素测定、降钙素原、血清真菌β-葡聚糖(G)测定、血清半乳甘露聚糖(GM)试验、血清呼吸道病原学11项检测均正常。痰涂片3次找细菌、真菌及抗酸杆菌均(-),痰细菌培养、真菌培养2次均(-)。肺通气功能各项指标基本正常,轻度弥散功能障碍;残气/肺总量百分比值基本正常。腹部彩超显示肝内胆管壁增厚、二级以上胆管轻度扩张,考虑肝吸虫感染,胰脾未见异常。鼻窦CT未见异常。初步诊断:两肺弥漫性病变性质待查(肺结核?真菌?肉芽肿性疾病?)。
诊治经过:入院后先后予抗感染(头孢美唑、左氧氟沙星、泰能)、止咳化痰及对症支持治疗,患者咳嗽无明显缓解,仍是反复发热,最高体温为38.4 ℃。7月20日行纤支镜检查,镜下见左支气管通畅,充血,左下基底段开口处可见白色膜状物覆盖;右支气管充血,右上叶开口狭窄,黏膜充血、水肿,镜子不能进入,(检查中因患者术中血氧饱和度低至85%,心率升至140次/min,未能活检)(图1A,图1B)。支气管肺泡灌洗液找到少量革兰阳性球菌,未找到真菌、抗酸杆菌及恶性细胞,肺泡灌洗液细菌真菌培养均(-),支气管镜下刷检涂片未找到抗酸杆菌和恶性细胞。骨髓活检病理提示反应性增生骨髓象,增生低下。三系细胞均减少,粒红比例大致正常;散在分叶核巨核细胞及浆细胞,未见明确肿瘤性病变,特殊染色:银(-)、铁(-)、过碘酸雪夫(PAS)染色(-)、吉姆萨染色(-),未见明确肿瘤性病变。7月23日我院病理科会诊外院病理切片:(右肺上叶)可见坏死组织(凝固性坏死),间质大量淋巴细胞样细胞浸润(图1C)。考虑诊断:肺结核?真菌?肺癌?于7月23日加予抗真菌(伏立康唑)和四联抗结核治疗1周,体温高峰较前下降,最高37.6 ℃,复查胸部CT病灶无明显吸收。7月28日胸部CT提示两肺多发结节,空洞病灶,以两下肺为主,两肺下叶见3个团块状高密度影,较大约6.1 cm×6.2 cm,内见厚壁空洞,右肺下叶较大病灶可见壁内结节,其余空洞内可见液平面,影像学诊断考虑真菌感染可能,未除外不典型肺TB(图1D~F)。7月29日行B超引导下经皮肺穿,病理提示(右肺)为炎性实变性病变,炎性纤维组织增生,伴有坏死,抗酸及PAS染色均(-)(图1G)。7月30日停用伏立康唑后体温高峰较前升高,最高体温39.2 ℃,7月31日改用两性霉素B抗真菌和四联抗结核治疗,仍有反复发热,8月4日加予伊曲康唑联合两性霉素B抗真菌,患者发热、咳嗽症状无明显好转。8月4日行左小腿皮下结节活检,病理提示表皮大致正常,脂肪间隔增宽,血管增生扩张、充血,大量淋巴细胞、中性粒细胞浸润,可见渐进性坏死,部分脂肪细胞囊性坏死,免疫组化:T细胞、CD8/CD4均(+),B细胞、CD3、核增殖相关抗原Ki-67、CD30均(-),表现为坏死性脂膜炎改变(图1H)。8月10日胸部CT提示两肺结节影较前增多,原右肺上叶后段团块影增大(图1I~K)。8月10日再次行B超引导下经皮肺穿,病理提示(右肺)镜下组织内较多炎性细胞,同时有较多核稍深染、扭曲,胞质淡染的细胞,组织内有灶性坏死,免疫组化:CD20(-)、CD79a(-)、配对盒蛋白(Pax)5(-)、CD3(++)、CD5(++)、CD7(+++)、T细胞内抗原1(+++)、CD56(-)、CD4(+++)、Ki-67:50%~60%细胞(+);原位杂交:人类疱疹病毒Ⅳ型(EBV)编码核糖核酸(EBERs)(+),见部分中等大小细胞,T细胞受体(TCR)重排(-);病理学诊断:EBV相关性淋巴增殖性疾病(EBV-LPD)(多型性)(图1L~P)。8月14日完善EBV检查:EBV壳抗原IgA抗体(±)、EBV核心抗原IgA抗体(-)。血TCR重排(-)。8月15日起予甲泼尼龙40 mg/d静脉滴注,8月17日开始予醋酸泼尼松片30 mg/d口服;用激素3 d后患者体温下降,皮下结节缩小。患者拒绝转血液科,放弃进一步治疗,8月18日自动出院,1个月后死亡。最终诊断:EBV-LPD(肺、皮肤受累),结合病理考虑为T/NK细胞型(EBV-T/NK-LPD)。
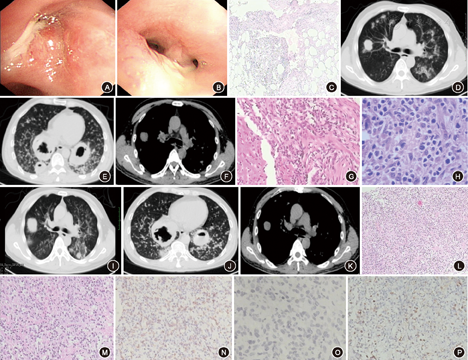

注:2015年7月20日支气管镜检查:右上叶开口狭窄,黏膜充血、水肿(A),左下基底段开口处可见白色膜状物覆盖(B);7月23日会诊外院右肺上叶病理切片:间质大量淋巴细胞样细胞浸润(C);7月28日胸部CT检查:两肺多发小斑片状、大小不等结节状高密度影,以下肺明显(D),两下肺团块状病变内不规则后壁空洞形成(E),纵隔未见肿大淋巴结(F);7月29日超声引导下经皮肺穿活检病理学检查(HE ×400):炎性实变性病变,炎性纤维组织增生,伴有坏死,抗酸及PAS染色(-)(G);8月4日左小腿皮下结节活检病理学检查(HE ×400):大量淋巴细胞、中性粒细胞浸润,可见渐进性坏死,部分脂肪细胞囊性坏死(H);8月10日胸部CT检查:治疗后两肺病灶较前增多,团块影增大(I),左下肺结节较前增多,右下肺团块状病变稍吸收好转(J),纵隔淋巴结未见明显增大(K);8月10日超声引导下经皮肺穿活检病理学检查(HE):镜下组织内有较多炎性细胞,同时有较多核稍深染、扭曲,胞质淡染的细胞,组织内有灶状坏死(图L、M分别为×200、×400);免疫组化(SP ×400):CD3(++)(N),CD56(-)(O),EBERs(+)(P)
•EBV-T/NK-LPD成人罕见,系统性EBV-T/NK-LPD可以累及全身多器官,最常累及肝脾,其次为淋巴结、骨髓等,以肺部受累为主要表现者罕见。
•本例缺乏肝脾肿大、肝功能异常、血细胞减少、骨髓造血细胞减少等EBV-LPD主要器官受累及临床表现,仅表现为反复发热,慢性咳嗽和皮下结节,肺部影像学表现为双肺多发结节伴厚壁空洞,临床症状和影像学表现不典型。
•本例最初就诊时曾反复抗感染治疗,患者自觉症状均有所缓解,主要表现为不规则发热、肺部结节,极易误诊感染性疾病或转移瘤。
•EBV-T/NK-LPD为一组临床表现和病理学异质性很强的疾病谱,病程可表现为急性或慢性;大部分成人患者病程呈暴发性,预后极差。
•医师对于多系统受累及出现的皮下结节应当有充分的认识及重视,应重视病程中出现的新症状或体征,并请相关科室会诊,及时皮肤活检。
•诊治过程中应及早行病变部位活检。当治疗效果不佳、对原诊断存有疑惑时应反复活检以明确诊断。
•系统性EBV-T/NK-LPD可累及全身多器官,初期极易误诊,临床预后差,部分可转化为淋巴瘤。
EBV-LPD多见于儿童,尤其见于幼儿,成人罕见,国际上仅有个例报道[1]。该病可分为B细胞型和T/NK细胞型,其中T/NK细胞型仅见于东亚和南美部分国家;诊断标准包括:(1)严重疾病(如高热、肝脾肿大等)病程超过6个月;(2)血清EBV抗体滴度增高,抗EBV壳抗原IgG>5 120,抗EBV早期抗原IgG≥640,或抗EBV核抗原抗体<2,和(或)EBV-DNA负荷(拷贝数)升高;(3)主要器官受累及的组织学证据,如间质性肺炎、骨髓造血细胞减少、色素膜炎、淋巴结炎、持续性肝炎或脾大;(4)受感染组织中EBV阳性T/NK细胞数量增多[1,2,3]。
本例患者缺乏肝脾肿大、肝功能异常、血细胞减少、骨髓造血细胞减少等EBV-LPD主要器官受累及临床表现,肺脏受累也不是典型间质性肺炎影像学表现等,但结合血清EBV检测提示有病毒感染、受感染组织中EBV抗体异常和病理组织学证据,皮肤、肺部病理无肿瘤性生长和淋巴瘤依据,病理中发现了大量淋巴细胞浸润,核异形、核分裂象少见的病理学特征,原位杂交中还发现了少量的EBERs,免疫组化特异T细胞标记(+),患者肺组织、血液TCR基因重排(-),淋巴瘤诊断尚不能成立,符合EBV-T/NK-LPD诊断。EBV壳抗原IgA抗体(±),予泼尼松治疗后症状较前缓解,皮下结节缩小,考虑治疗有效,故考虑EBV-LPD(肺、皮肤受累)诊断明确。
EBV-LPD临床表现有显著异质性。部分患者仅有局限性皮肤损害,临床表现为种痘样水疱病和蚊叮超敏综合征,预后较好;表现为系统性EBV-T/NK-LPD者预后不佳。大部分成人患者病程呈暴发性,临床表现为多器官损害,病程中可出现威胁生命的严重并发症,包括:噬血细胞综合征、恶性淋巴瘤、弥漫性血管内凝血、肝功能衰竭、消化道溃疡或穿孔、冠状动脉瘤、中枢神经系统浸润、心肌炎、间质性肺炎和白血病[4,5,6],预后极差。该疾病最常累及肝脾,其次为淋巴结、骨髓等,肺部受累较少见。文献报道累及肺部多表现为间质性肺炎、纵隔淋巴结肿大和胸腔积液[4,7,8,9]。本例患者肺部最先累及,且为最主要受累脏器,影像学表现为多发结节伴有空洞,无肝脾肿大、肝功能异常,无淋巴结肿大、血小板减少和贫血,误诊为结核、肺部真菌、肺部脓肿,予强有力抗感染、抗真菌、抗结核治疗均未见明显缓解,临床表现不能用其他已知慢性疾病解释,经反复肺组织病理活检方明确诊断。因此成人EBV-LPD临床诊断不能完全依赖一次病理组织结果,当结合临床特征、血清EBV-DNA和病理组织等发现异常淋巴细胞及EBV组织内感染的证据时,应尽早积极进行病变部位组织病理活检及免疫表型诊断,使患者获得较早诊治时机。
部分EBV-LPD可进展为EBV相关的淋巴瘤[10]。EBV-LPD患者最初诊断常难精确区分EBV相关淋巴增殖为恶性或良性,淋巴瘤的诊断需斟酌,需跟踪疾病的转归。一些皮肤淋巴瘤比如皮下脂膜炎型淋巴瘤[11],也与EBV潜伏感染相关,且常提示治疗效果不佳。本例在病程中出现双下肢散在多发的无痛性皮下结节,病理提示为"坏死性脂膜炎" ,考虑为皮肤受累,需要警惕可能存在最终发展成为淋巴瘤的可能。
该病目前缺乏规范而有效的治疗方案,异基因干细胞移植可能是目前最有效的治疗手段,早期病例使用抗病毒、免疫调节剂有一定效果。多数病例预后不好。治疗有效的病例多局限在个别临床报告,且多为暂时缓解,很少有彻底根治的病例[12]。若患者后期复查达到淋巴瘤的诊断,按照淋巴瘤治疗[1]。
综上所述,首要表现在肺部的EBV-T/NK-LPD罕见,既可以呈慢性惰性病程,也可呈明显侵袭性,易误诊或漏诊,且治疗反应不佳,预后差。对于不明原因的持续发热、难治性肺炎、临床表现与影像学不一致,尤其病变累及多个系统的患者,应考虑到本病可能。早期积极进行病变部位组织病理活检对于明确诊断意义重大。


























