
探讨精索静脉曲张患者的精索脉管数目与静脉曲张相关指标的关系,为精索静脉曲张的术前评估和手术治疗提供参考。
选取2015年5月至2016年7月于上海市第一人民医院接受显微镜下左侧精索静脉结扎术的156例精索静脉曲张患者进行回顾性分析,记录静脉曲张程度和术中发现的左侧精索脉管数目,按照患者精索内动脉(ISA)数目把患者分为单根动脉组(55例)、双根动脉组(63例)和多根动脉组(38例),探讨各精索脉管数目之间的相关性,比较各组患者精索静脉曲张程度、睾丸体积、术前精液参数、术前性激素水平以及手术时间和住院天数等有无差异。
精索静脉曲张患者ISA数目与精索内静脉数目(ISV)(r=0.210;P=0.008)和淋巴管数目(r=0.224;P=0.005)呈正相关;淋巴管数目与同侧引带静脉数目(r=0.172;P=0.032)和ISV数目(r=0.296,P=0.000)呈正相关。多根动脉组的ISV数目多于单根动脉组[(10.58±4.28)比(8.22±3.10)根,P=0.003],且其淋巴管数目[(4.11±1.90)根]多于双根动脉组[(3.76±1.40)根,P=0.020]和单根动脉组[(3.13±1.52)根,P=0.007]。另外,Ⅱ度精索静脉曲张患者的ISV数目多于Ⅲ度精索静脉曲张的患者[(9.74±3.90)比(8.33±3.10)根,P=0.013]。单根动脉组、双根动脉组和多根动脉组3组患者的静脉曲张程度以及手术前后精液参数、性激素水平、睾丸体积、手术时间以及住院天数等指标差异无统计学意义。
精索脉管之间存在数量相关性,特别是Ⅱ度精索静脉曲张并伴有多根ISA的患者往往具有更多的ISV和淋巴管,这类患者手术中在保护ISA的同时应更加注意尽可能将曲张的ISV结扎完全并保护淋巴管以防止复发和术后并发症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
精索静脉曲张是导致男性不育的常见原因之一,随着显微外科手术的进步,显微镜下精索静脉结扎术被越来越多的临床医生所采用,其中又以腹股沟下的显微镜下精索静脉结扎术对于患者的生精功能改善最为有利[1]。为了提高治愈率,减少复发和并发症,手术中需要彻底结扎曲张的精索内静脉(internal spermatic veins, ISV)、精索外静脉以及引带静脉并充分保护精索内动脉(internal spermatic artery, ISA)和淋巴管[2]。以往的研究表明,总体上精索静脉自下而上数目逐渐减少,不同个体之间数目差异很大[3,4],本研究旨在探讨不同临床分级患者腹股沟下段水平精索脉管之间的数量关系以及它们和术前睾丸体积、精液参数以及性激素水平的关系,以便为疾病评估和手术治疗提供参考。
选取2015年5月至2016年7月于上海交通大学附属第一人民医院接受腹股沟下途径显微镜下左侧精索静脉结扎术的156例精索静脉曲张伴不育患者作为研究对象进行回顾性分析,入组患者年龄11~53岁,平均年龄(30±6)岁。参照Dubin和Amelar系统,根据体格检查和B超将患者按精索静脉曲张程度分为两组,其中Ⅱ度曲张组69例,Ⅲ度曲张组87例。另外,按照术中探查的左侧ISA数目将患者分为单根动脉组(55例)、双根动脉组(63例)和多根动脉组(左侧精索发现≥3个ISA)(38例)。各组患者间的年龄[Ⅱ度曲张组、Ⅲ度曲张组:(30±5)比(30±7)岁;单根动脉组、双根动脉组、多根动脉组:(30±7)比(30±6)比(31±5)岁]、身高[Ⅱ度曲张组、Ⅲ度曲张组:(171±6)比(171±6)cm;单根动脉组、双根动脉组、多根动脉组:(172±6)比(171±6)比(171±6)cm]、体重[Ⅱ度曲张组、Ⅲ度曲张组:(62.0±7.4)比(62.4±6.2)kg;单根动脉组、双根动脉组、多根动脉组:(62.7±6.8)比(61.9±8.1)比(61.6±7.7)kg]等一般临床资料的差异均无统计学意义。
所有患者均接受了显微镜下腹股沟下途径的精索静脉结扎术,在患者接受全身麻醉,于外环下行3~4 cm斜形切口,沿精索走行方向纵行切开皮肤、皮下组织,逐层分离至腹外斜肌腱膜外环口处,钝性分离暴露精索并提拉至出切口表面固定。将睾丸从切口挤出,观察并结扎曲张的引带静脉和精索外静脉后还纳睾丸。在显微镜(型号:蔡司公司ZEISS OPMI VARIO 700)8~15倍视野下,分离切开提睾肌及精索外筋膜及提睾肌,将视野下的每根脉管都用宽约1~2 mm的橡胶皮条保护标记,使用术中多普勒探头明确脉管性质,充分保护ISA和淋巴管后,使用钛夹逐根断扎标记的ISV。检查无出血后关闭筋膜,充分止血后,牵拉睾丸使精索复位,分层关闭切口[5]。
术中记录结扎和保护的精索相关脉管数目,包括引带静脉、精索外静脉、ISV、ISA与淋巴管,手术结束时根据使用的橡皮条带和钛夹的数目对脉管计数进行核实,无论粗细,结扎每根ISV消耗2个钛夹和1根橡皮条带,其余脉管消耗1根橡皮条。所有手术均采用显微镜自带录像系统进行录像,术后根据录像核对相关数据。
对患者进行体格检查,患者进行体格检查确定精索静脉的临床分级之后,并采用彩色多普勒超声检查确定曲张血管的直径与反流程度。测量患者保持平静呼吸时蔓状静脉丛的最大内径作为ISV最大内径,嘱患者做Valsalva动作并记录反流时间。睾丸体积根据公式V=0.52×(上下径×左右径×前后径)得出。超声检查均采用同一标准、同型号仪器完成(型号:BK公司FLEX FOCUS 500)。
使用Stata 12.0软件进行数据统计分析。正态分布资料采用 ±s表示,两独立样本间均数比较采用t检验,三组独立样本间均数比较采用单因素方差分析;偏态分布资料采用M(Q1~Q3)表示,三组独立样本间比较采用Kruskal-Wallis检验。率的比较采用Pearson χ2检验比较。使用Spearman秩相关分析验证各精索脉管之间数目的相关性。所有检验均为双侧检验。P<0.05定义为差异有统计学意义。
±s表示,两独立样本间均数比较采用t检验,三组独立样本间均数比较采用单因素方差分析;偏态分布资料采用M(Q1~Q3)表示,三组独立样本间比较采用Kruskal-Wallis检验。率的比较采用Pearson χ2检验比较。使用Spearman秩相关分析验证各精索脉管之间数目的相关性。所有检验均为双侧检验。P<0.05定义为差异有统计学意义。
156例患者的左侧脉管数目分别为ISA:(2.05±1.14)根;ISV:(8.96±3.53)根;精索外静脉:(1.50±1.03)根;引带静脉:(1.54±1.20)根;淋巴管:(3.62±1.61)根。Spearman秩相关分析表明上述脉管中,ISA数目分别与同侧ISV和淋巴管数目呈正性相关(r=0.210、0.224,P=0.008、0.005),而与同侧引带静脉数目和精索外静脉数目无相关性(r=-0.027、0.013,P=0.739、0.868);淋巴管数目与同侧引带静脉和ISV数目呈正相关(r=0.172、0.296,P=0.032、0.000),而与同侧精索外静脉数目无相关性(r=-0.082,P=0.307)。
单根动脉组、双根动脉组和多根动脉组3组之间ISV和淋巴管数目差异均有统计学意义,多根动脉组的ISV数目多于单根动脉组(P=0.003),淋巴管数目多于双根动脉组(P=0.020)和单根动脉组(P=0.007)(表1)。
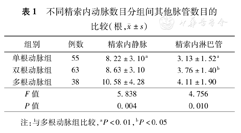
不同精索内动脉数目分组间其他脉管数目的比较(根, ±s)
±s)
不同精索内动脉数目分组间其他脉管数目的比较(根, ±s)
±s)
| 组别 | 例数 | 精索内静脉 | 精索内淋巴管 |
|---|---|---|---|
| 单根动脉组 | 55 | 8.22±3.10a | 3.13±1.52a |
| 双根动脉组 | 63 | 8.63±3.10 | 3.76±1.40b |
| 多根动脉组 | 38 | 10.58±4.28 | 4.11±1.90 |
| F值 | 5.838 | 4.756 | |
| P值 | 0.004 | 0.010 |
注:与多根动脉组比较,aP<0.01,bP<0.05
Ⅱ度曲张组患者的ISV数目多于Ⅲ度曲张组患者(t=2.510,P=0.013),其他脉管的数目在两组患者之间差异没有统计学意义(表2)。
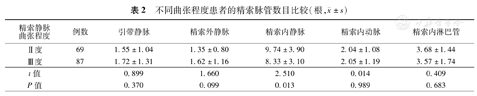
不同曲张程度患者的精索脉管数目比较(根, ±s)
±s)
不同曲张程度患者的精索脉管数目比较(根, ±s)
±s)
| 精索静脉曲张程度 | 例数 | 引带静脉 | 精索外静脉 | 精索内静脉 | 精索内动脉 | 精索内淋巴管 |
|---|---|---|---|---|---|---|
| Ⅱ度 | 69 | 1.55±1.04 | 1.35±0.80 | 9.74±3.90 | 2.04±1.08 | 3.68±1.44 |
| Ⅲ度 | 87 | 1.72±1.31 | 1.62±1.16 | 8.33±3.10 | 2.05±1.19 | 3.57±1.74 |
| t值 | 0.899 | 1.660 | 2.510 | 0.014 | 0.409 | |
| P值 | 0.370 | 0.099 | 0.013 | 0.989 | 0.683 |
单根动脉组、双根动脉组、多根动脉组组间术前睾丸体积、性激素水平、住院天数、手术时间及术后3个月精液改善率差异均无统计学意义(表3)。
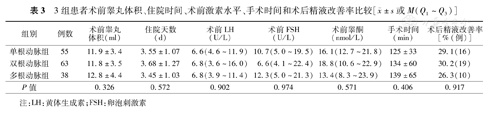
3组患者术前睾丸体积、住院时间、术前激素水平、手术时间和术后精液改善率比较[ ±s或M(Q1~Q3)]
±s或M(Q1~Q3)]
3组患者术前睾丸体积、住院时间、术前激素水平、手术时间和术后精液改善率比较[ ±s或M(Q1~Q3)]
±s或M(Q1~Q3)]
| 组别 | 例数 | 术前睾丸体积(ml) | 住院天数(d) | 术前LH(U/L) | 术前FSH(U/L) | 术前睾酮(nmol/L) | 手术时间(min) | 术后精液改善率[%(例)] |
|---|---|---|---|---|---|---|---|---|
| 单根动脉组 | 55 | 11.9±3.4 | 3.55±1.07 | 6.6(4.6~11.9) | 10.7(5.0~19.5) | 16.1(12.7~21.8) | 125±33 | 29.1(16) |
| 双根动脉组 | 63 | 11.8±3.5 | 3.68±1.27 | 6.8(3.6~16.0) | 6.6(4.1~22.4) | 18.8(10.6~22.9) | 134±60 | 30.2(19) |
| 多根动脉组 | 38 | 12.8±4.4 | 3.45±1.03 | 6.8(3.9~11.4) | 12.3(5.0~21.3) | 13.4(8.3~23.9) | 139±65 | 26.3(10) |
| P值 | 0.326 | 0.572 | 0.902 | 0.974 | 0.571 | 0.406 | 0.917 |
注:LH:黄体生成素;FSH:卵泡刺激素
标准的腹股沟下水平处的显微镜下精索静脉结扎术有3个手术区域,在提睾肌/输精管区域结扎提睾肌静脉,保护输精管及其伴行动静脉、淋巴管和生殖股神经的分支;在精索内需要结扎ISV,保护ISA以及淋巴管;在睾丸表面需要剥脱曲张的静脉并结扎曲张的引带静脉,术后睾丸/附睾的静脉回流完全依靠输精管静脉[6]。为了达到上述要求,需要术者充分掌握精索相关解剖,以往国外的研究表明,精索脉管在腹股沟管下水平处的变异较大,比如:ISV数目常常在0~21根,精索外静脉在0~13根,ISA数目常为1或2根[7],但本中心的手术观察结果发现入组患者的精索外静脉在0~7根,ISA数在1~8根。
目前显微镜下的精索静脉结扎术被认为是治疗此种疾病的"金标准",但仍有2.6%~2.8%的复发率,0~1.4%的睾丸萎缩发生率和1.4%~2.8%的阴囊水肿发生率[8],其中精索静脉曲张复发主要与精索静脉侧支漏扎有关,睾丸萎缩主要与误扎动脉导致睾丸血供不足有关,而阴囊水肿的发生主要与术中误扎或损伤淋巴管有关。所以,如何充分掌握患者各种精索脉管的数目往往是手术者最为关心的问题,目前术中的选择性ISV造影是判断精索静脉变异的可靠方法[9],术中多普勒超声是区分精索内动静脉的可靠方法[10],而目前除显微镜下通过形态辨认外,尚无较为公认的可靠方法来评估淋巴管数目情况。另外,术中静脉造影和术中多普勒超声的普及率还有待进一步提高,同时开展两者的医疗机构更是少之又少,于是,根据术中容易确认的精索脉管以及精索静脉曲张程度等指标大致判断精索动静脉和淋巴管数目将有利于手术者对手术难度以及患者术后并发症和静脉曲张复发的风险进行初步评估。根据本研究结果,患有Ⅱ度精索静脉曲张并伴有多根ISA的患者,往往具有更多的ISV和淋巴管,所以这类患者的手术难度相对较大,复发和术后并发症的发生风险也较其他患者高,所以在术中应当花费更多的时间和精力以确保充分保护了动脉和淋巴管并完全结扎精索内、外静脉和引带静脉。
关于不同个体之间精索脉管数目差异产生的原因,目前主流观念认为,血管/淋巴管的形成一方面受到相对严格的遗传上的控制,另一方面也存在着一些随机的变异,这包括细胞的迁移和血管形态的变化。在胚胎血管生成阶段最关键的因素是血管内皮生长因子(VEGF)及其受体(VEGFR)家族,有研究指出,VEGFR-2基因的缺失会导致纯合子动物致死性的内皮细胞分化障碍和血管生成受阻[11];而VEGFR-1缺乏则导致内皮细胞过度增殖形成多而杂乱的小血管[12];VEGFR-3则对淋巴管的形成至关重要。值得注意的是,VEGF因子与其受体之间不是严格一一配对的关系,如VEGFC的受体是VEGFR-2和VEGFR-3。所以,不同血管和淋巴管形成过程中有可能受到一整套复杂系统的同时调控而表现出数量的相关性,而本研究也证实了这一点:(1)ISA的数目与ISV、淋巴管数目之间呈正性相关;(2)淋巴管数目与引带静脉、ISV和ISA数目间呈正相关。本研究的另一个统计结果显示:Ⅱ度静脉曲张患者的ISV数目显著多于Ⅲ度曲张的患者,这一点在国外也有类似的报道,并指出虽然Ⅱ度曲张的ISV数目多于Ⅲ度曲张患者的ISV,但其平均内径小于Ⅲ度曲张患者的ISV[3],而ISV的数目与精索静脉曲张的发生以及发展演变是否具有一定的相关性值得进一步研究。
另外,本研究也有一定的不足,首先,入选的研究对象均为接受了显微镜下精索静脉结扎术的患者而不是健康人群,所得数据具有一定的局限性;其次,虽然本研究所有入组病例均未发生切口血肿和阴囊水肿等短期术后并发症,但不同分组之间精索静脉曲张复发和睾丸萎缩等远期并发症是否有差异尚需进一步跟进随访。



























