
探讨新辅助化疗后淋巴结癌残留的激素受体阴性乳腺癌辅助化疗方案的选择对生存的影响。
回顾性分析北京大学肿瘤医院乳腺癌预防治疗中心2002年1月至2012年12月收治的激素受体阴性且腋窝淋巴结转移的原发性乳腺癌病例。其中完成了4~8个周期新辅助化疗以及包含淋巴结清扫的乳腺癌根治性手术,术后病理证实仍有淋巴结癌残留的患者共110例。根据术后有无辅助化疗分为A组(辅助化疗组)和B组(无辅助化疗组)。
全部患者均为女性,中位发病年龄54.5岁(IQR:47~59岁)。无事件中位随访时间61个月(IQR:51~88个月)。A组82例(74.5%),5年无病生存(DFS)率76.2%(95%CI:66.8%~85.6%)、无远位转移生存(DDFS)率78.9%(95%CI:69.5%~88.3%)、总生存(OS)率81.0%(95%CI:72.4%~89.6%);B组28例(25.5%),5年DFS率57.6%(95%CI:38.6%~76.6%)、DDFS率60.4%(95%CI:41.2%~79.6%)、OS率60.0%(95%CI:40.6%~69.4%)。多因素分析显示,B组发生远处转移的风险为A组的5.256倍(95%CI:1.14~24.17),P=0.033;死亡风险为A组的7.478倍(95%CI:1.58~35.30),P=0.011。
新辅助化疗后腋窝阳性淋巴结癌残留的受体阴性乳腺癌患者,可能从术后辅助化疗中获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
病理证实腋窝淋巴结阳性的乳腺癌患者具有新辅助化疗的指征。腋窝淋巴结与乳腺原发病灶的病理完全缓解率是评价新辅助化疗(NCT)疗效的重要指标[1]。免疫组化分子分型亦与新辅助化疗的疗效相关[2]。当新辅助化疗疗效不满意时,雌激素受体(ER)、孕激素受体(PR)阳性的患者可以选择术后辅助内分泌治疗;人类表皮生长因子受体2(HER-2)阳性的患者可以在术后加用靶向治疗。而三阴性乳腺癌,以及ER/PR阴性、HER-2阳性但拒绝接受靶向治疗的患者,当NCT疗效不满意时,辅助治疗方案的选择一直是研究的难点。本研究以ER/PR阴性,且仅以化疗作为全身治疗手段的乳腺癌患者为对象,挑选出新辅助化疗后仍有腋窝淋巴结癌残留的病例序列,分析术后有无辅助化疗对这类患者预后的影响。
收集北京大学肿瘤医院乳腺癌预防治疗中心数据库中自2002年1月至2012年12月空芯针穿刺组织病理学确诊为浸润性乳腺癌,并且同侧腋窝淋巴结因影像学异常[3],在B超引导下经穿刺组织病理或细胞病理学证实癌转移的患者资料。选择完成了4~8个周期新辅助化疗以及包含淋巴结清扫的乳腺癌根治性手术,且有完整临床资料的连续病例824例。其中符合ER/PR/HER-2阴性、或者ER/PR阴性且HER-2阳性但不接受靶向治疗的患者共237例。术后病理证实仍有淋巴结癌残留的110例判定为新辅助化疗疗效不满意。这组病例中,无事件1年内未随访且随访时间短于60个月者9例,失访率8.2%。无事件中位随访时间61个月(IQR:51~88个月)。
ER和PR:<10%癌细胞核着色,定义为激素受体阴性(HR-);HER-2:癌细胞中胞膜无着色为(-),<10%的癌细胞胞膜着色为(+);≥10%且<30%的癌细胞胞膜着色为(++);≥30%的癌细胞显示一致的、强的、完整的胞膜着色为(+++)。(-)或(+)为阴性,(++)为不确定状态,(+++)为阳性。HER-2(++)行荧光原位杂交(FISH)检测复核有无HER-2基因扩增。Ki-67:≤20%定义为低表达,>20%为高表达。肿瘤原发灶未见浸润性癌残留表示为:ypT0/is ypN+;肿瘤原发灶有浸润性癌残留表示为:ypT≥1mi ypN+。
新辅助化疗方案包含蒽环和紫杉两类,其中单方案为4个周期,两方案续贯为6~8个周期。辅助化疗方案均为不同于新辅助治疗方案的单一方案4个周期,包含蒽环、紫杉以及异长春花碱类。药物剂量为:表柔吡星100 mg/m2+环磷酰胺600 mg/m2,d1,q21d×4;紫杉醇80 mg/m2,d1,q7d×12;长春瑞滨25 mg/m2,d1、8,q21d×4。本研究中免疫组化提示HER-2阳性的患者共43例(39.1%),在治疗前均被告知靶向治疗的重要性,但仍由于费用昂贵等原因选择放弃靶向治疗。全部患者在NCT结束之后,进行了包含腋窝淋巴结清扫的乳腺癌根治性手术。术后进行辅助化疗的82例患者(74.5%),定义为A组;28例患者(25.5%)未进行术后化疗,定义为B组。78例(70.9%)患者术后6个月内接受了胸壁及锁骨上淋巴引流区放疗,剂量为50 Gy/25 f;保留乳房手术患者接受全乳及瘤床加量放疗,其中全乳照射剂量为46 Gy/23 f或50 Gy/25 f,瘤床加量剂量为14 Gy/7 f或10 Gy/5 f。
无病生存(DFS)时间:从新辅助化疗开始至首次出现乳腺癌相关事件的时间。事件包含局部复发、远处转移、第二原发癌,以及乳腺癌相关性死亡。无远位转移生存(DDFS)时间:从新辅助化疗开始至首次出现远处转移病灶或乳腺癌相关死亡的时间。总生存(OS)时间:从新辅助化疗开始至患者死亡的时间。
采用SPSS 22.0进行统计分析,临床资料的统计变量以均数、标准差或中位数、四分位间距(IQR),分类变量以百分比表示。组间基本特征的比较采用χ2检验或Fisher精确概率法;生存曲线描绘及生存率估计采用Kaplan-Meier法,组间生存曲线比较采用log-rank检验进行。采用Cox比例风险模型进行多因素分析,采用Enter法纳入临床上有可能影响结果的因素。所有检验均为双侧检验,以P<0.05为差异有统计学意义。
患者为年龄29~69岁女性,中位发病年龄54.5岁(IQR:47~59岁)。无事件中位随访时间61个月(IQR:51~88个月),随访更新至2016年8月。临床基线特征资料见表1。
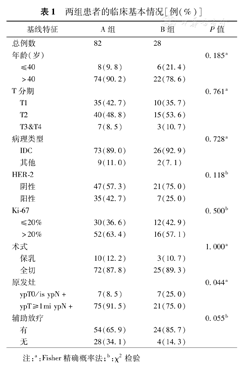
两组患者的临床基本情况[例(%)]
两组患者的临床基本情况[例(%)]
| 基线特征 | A组 | B组 | P值 | |
|---|---|---|---|---|
| 总例数 | 82 | 28 | ||
| 年龄(岁) | 0.185a | |||
| ≤40 | 8(9.8) | 6(21.4) | ||
| >40 | 74(90.2) | 22(78.6) | ||
| T分期 | 0.761a | |||
| T1 | 35(42.7) | 10(35.7) | ||
| T2 | 40(48.8) | 15(53.6) | ||
| T3&T4 | 7(8.5) | 3(10.7) | ||
| 病理类型 | 0.728a | |||
| IDC | 73(89.0) | 26(92.9) | ||
| 其他 | 9(11.0) | 2(7.1) | ||
| HER-2 | 0.118b | |||
| 阴性 | 47(57.3) | 21(75.0) | ||
| 阳性 | 35(42.7) | 7(25.0) | ||
| Ki-67 | 0.500b | |||
| ≤20% | 30(36.6) | 12(42.9) | ||
| >20% | 52(63.4) | 16(57.1) | ||
| 术式 | 1.000a | |||
| 保乳 | 10(12.2) | 3(10.7) | ||
| 全切 | 72(87.8) | 25(89.3) | ||
| 原发灶 | 0.044a | |||
| ypT0/is ypN+ | 7(8.5) | 7(25.0) | ||
| ypT≥1mi ypN+ | 75(91.5) | 21(75.0) | ||
| 辅助放疗 | 0.055b | |||
| 有 | 54(65.9) | 24(85.7) | ||
| 无 | 28(34.1) | 4(14.3) | ||
注:a:Fisher精确概率法;b:χ2检验
110例患者,出现远处转移事件27例(24.5%),第二原发癌2例(1.8%),对侧乳腺新发癌1例(0.9%),死亡25例(22.7%)。全部事件均发生在治疗结束后,事件在各组的具体分布见表2。A组82例(74.5%),5年DFS率76.2%(95%CI:66.8%~85.6%)、DDFS率78.9%(95%CI:69.5%~88.3%)、OS率81.0%(95%CI:72.4%~89.6%);B组28例(25.5%),5年DFS率57.6%(95%CI:38.6%~76.6%)、DDFS率60.4%(95%CI:41.2%~79.6%)、OS率60.0%(95%CI:40.6%~69.4%)。A组与B组的生存曲线见图1。
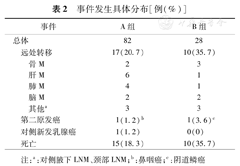
事件发生具体分布[例(%)]
事件发生具体分布[例(%)]
| 事件 | A组 | B组 | ||
|---|---|---|---|---|
| 总体 | 82 | 28 | ||
| 远处转移 | 17(20.7) | 10(35.7) | ||
| 骨M | 2 | 3 | ||
| 肝M | 6 | 1 | ||
| 肺M | 4 | 1 | ||
| 脑M | 2 | 2 | ||
| 其他a | 3 | 3 | ||
| 第二原发癌 | 1(1.2)b | 1(3.6)c | ||
| 对侧新发乳腺癌 | 1(1.2) | 0(0) | ||
| 死亡 | 15(18.3) | 10(35.7) | ||
注:a:对侧腋下LNM、颈部LNM;b:鼻咽癌;c:阴道鳞癌
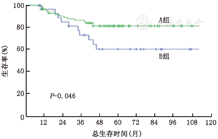

DFS、DDFS、OS的多因素分析见表3。结果显示:A、B两组之间,DFS、DDFS、OS差异均有统计学意义(P<0.05)。在校正了其他相关影响因素后,相对于A组,B组发生远处转移的风险为5.256倍,P=0.033(图2A),死亡风险为7.478倍,P=0.011(图2B)。
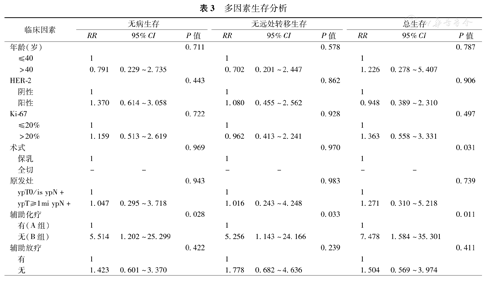
多因素生存分析
多因素生存分析
| 临床因素 | 无病生存 | 无远处转移生存 | 总生存 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| RR | 95%CI | P值 | RR | 95%CI | P值 | RR | 95%CI | P值 | |||
| 年龄(岁) | 0.711 | 0.578 | 0.787 | ||||||||
| ≤40 | 1 | 1 | 1 | ||||||||
| >40 | 0.791 | 0.229~2.735 | 0.702 | 0.201~2.447 | 1.226 | 0.278~5.407 | |||||
| HER-2 | 0.443 | 0.862 | 0.906 | ||||||||
| 阴性 | 1 | 1 | 1 | ||||||||
| 阳性 | 1.370 | 0.614~3.058 | 1.080 | 0.455~2.562 | 0.948 | 0.389~2.310 | |||||
| Ki-67 | 0.722 | 0.928 | 0.497 | ||||||||
| ≤20% | 1 | 1 | 1 | ||||||||
| >20% | 1.159 | 0.513~2.619 | 0.962 | 0.413~2.241 | 1.363 | 0.558~3.331 | |||||
| 术式 | 0.969 | 0.970 | 0.031 | ||||||||
| 保乳 | 1 | 1 | 1 | ||||||||
| 全切 | - | - | - | - | - | - | |||||
| 原发灶 | 0.943 | 0.983 | 0.739 | ||||||||
| ypT0/is ypN+ | 1 | 1 | 1 | ||||||||
| ypT≥1mi ypN+ | 1.047 | 0.295~3.718 | 1.016 | 0.243~4.248 | 1.271 | 0.310~5.218 | |||||
| 辅助化疗 | 0.028 | 0.033 | 0.011 | ||||||||
| 有(A组) | 1 | 1 | 1 | ||||||||
| 无(B组) | 5.514 | 1.202~25.299 | 5.256 | 1.143~24.166 | 7.478 | 1.584~35.301 | |||||
| 辅助放疗 | 0.422 | 0.239 | 0.411 | ||||||||
| 有 | 1 | 1 | 1 | ||||||||
| 无 | 1.423 | 0.601~3.370 | 1.778 | 0.682~4.636 | 1.504 | 0.569~3.974 | |||||


新辅助化疗适用于腋窝淋巴结阳性的乳腺癌患者。肿瘤原发灶以及腋窝淋巴结的病理完全缓解是评价患者预后的重要指标[4,5]。未达到病理完全缓解的患者中,三阴性乳腺癌患者预后最差[6]。对于单纯以化疗为全身治疗手段的乳腺癌病理类型,在NCT疗效不佳的情况下,术后是否需要额外的辅助化疗一直存在争议[7]。本研究的多因素分析显示:对于NCT后,腋窝淋巴结癌残留的ER/PR阴性乳腺癌患者,若仅以化疗作为唯一全身治疗手段,则术后有辅助化疗的患者(A组),DFS、DDFS、OS均优于术后无辅助化疗患者(B组)(P<0.05)。
多项前瞻性随机对照临床研究证实,曲妥珠单抗可以显著提高HER-2阳性或FISH检测基因扩增的乳腺癌患者的无病生存率和总生存率[8,9]。但国内有许多HER-2阳性患者因为曲妥珠单抗高昂的费用而放弃应用靶向治疗。本研究中纳入了43例(39.1%)HER-2阳性,且在末次随访之前均未应用靶向治疗的患者。这部分患者与三阴性乳腺癌患者一样,仅以化疗作为唯一的全身治疗手段。从多因素分析的结果来看,NCT后,淋巴结有癌残留的三阴性乳腺癌患者与不进行靶向治疗的HER-2阳性患者,预后相似(DFS、DDFS、OS,P>0.05)。
本研究中进行保留乳房手术患者13例(11.8%),均未出现复发转移相关事件,多因素分析显示OS明显优于全乳切除手术患者(P<0.05)。与我中心既往研究结果相似[10]。但本研究为回顾性研究,两组间存在手术方式选择的偏倚。
虽然本研究纳入的患者均进行了新辅助化疗,但是化疗药物和周期数并不统一,这也造成了A、B两组间的不均衡。部分辅助化疗的计划仅仅是为了补足总共8个周期的化疗疗程。但是从研究结果中可以看到ER/PR阴性,NCT后腋窝淋巴结癌残留的患者,在继续辅助化疗之后,获得了较好预后的趋势。最终此结论仍需要证据级别更高,且新辅助化疗方案齐整的前瞻性随机对照研究结果来论证。



























