
探讨不同麻醉方式对于肝细胞癌(HCC)术后预后的影响。
选取中国医学科学院肿瘤医院2006年1月至2008年1月行手术治疗并获完整随访的HCC患者共185例。美国麻醉医师协会分级(ASA)Ⅰ~Ⅲ级,体质指数(BMI)为(22.8±4.6) kg/m2。其中,男169例,平均年龄56岁;女16例,平均年龄53岁。根据麻醉方式不同,将185例患者分为全凭静脉麻醉组53例,吸入麻醉组132例。近期随访对比术后疼痛及麻醉不良反应发生率,疼痛评分采用数字分级法(NRS),远期随访对比两组患者预后情况。
全凭静脉麻醉组术后2 h NRS为2.0(0~2.0)分,疼痛程度明显低于吸入麻醉组的3.0(1.0~3.0)分,差异有统计学意义(Z=-3.261,P=0.001),而两组术后24 h的NRS分别为3.0(2.0~5.0)分和3.0(3.0~4.0)分,疼痛程度差异无统计学意义(Z=-0.035,P=0.972)。两组在术后镇静、恶心呕吐、躁动等不良反应发生率方面差异亦无统计学意义(均P>0.05)。Kaplan-Meier单因素分析显示,两种麻醉方式对于无复发生存率及总生存率差异均无统计学意义(均P>0.05)。Cox多因素分析亦显示两种麻醉方式不是影响HCC预后的独立影响因素。
不同麻醉方式对于HCC长期预后无影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞癌(HCC)为全球第五大常见恶性肿瘤,每年约有74.8万新发病例,我国发病人数占全世界肝癌人数的50%以上[1]。由于HCC发病率高、预后差,因此HCC相关的基础研究及临床诊治一直是医学研究的热点。目前很多文献报道术中麻醉方式及阿片类药物使用可能影响肿瘤预后,本研究通过对比HCC术中常用的全凭静脉麻醉(TIVA)及吸入麻醉两种麻醉方式的临床资料,探讨麻醉方式对于肝细胞癌预后的影响。
选取中国医学科学院肿瘤医院2006年1月至2008年1月行手术治疗并获得完整随访的HCC患者共185例,术后均经病理诊断证实为HCC。术前评估:美国麻醉医师协会分级(ASA)Ⅰ级53例,Ⅱ级124例,Ⅲ级8例。体质指数(BMI)为(22.8±4.6) kg/m2。男169例,平均年龄(56±11)岁;女16例,平均年龄(53±11)岁。Child-Pugh分级为A级182例(98.4%),B级3例(1.6%)。中位肿瘤直径为3.8(0.5~15.0)cm。术后病理提示:组织学分级Ⅰ~Ⅱ级134例(72.4%),Ⅱ~Ⅲ级51例(27.6%)。肿瘤多发或伴有卫星灶者35例(18.9%),有病理脉管瘤栓者18例(9.7%)。肝硬化程度:无-轻度肝硬化95例(51.4%),中度及重度肝硬化90例(48.6%)。按照第7版TNM分期标准,Ⅰ期136例(73.5%),Ⅱ期24例(13.0%),Ⅲ期23例(12.4%),Ⅳ期2例(1.1%);巴塞罗那分期(BCLC):0期8例(4.3%),1期147例(79.5%),2期18例(9.7%),3期12例(6.5%)。
根据麻醉方式不同,将185例患者分为全凭静脉麻醉组53例,吸入麻醉组132例。两组麻醉诱导方式相同,均采用丙泊酚1.5~2.0 mg/kg、芬太尼2~4 μg/kg或舒芬太尼0.2~0.4 μg/kg、罗库溴铵(荷兰Organon公司) 0.9 mg/kg,气管插管后行机械通气,潮气量8~10 ml/kg,吸呼比1∶2,通气频率12次/min,维持PET CO2 30~35 mmHg (1 mmHg=0.133 kPa)。全凭静脉麻醉组术中维持使用静脉输注丙泊酚(意大利AstraZeneca公司) 4~6 mg·kg-1·h-1和瑞芬太尼(湖北宜昌人福药业有限公司) 8~12 μg·kg-1·h-1。吸入麻醉组术中维持使用七氟烷(美国Baxter公司),呼气末浓度1.5%~2.0%。两组每隔45~60 min间断采用芬太尼(1~2 μg/kg)或舒芬太尼(0.1~0.2 μg/kg)加强术中镇痛,间断静脉注射罗库溴铵0.3 mg/kg维持肌松。术后镇痛采用患者自控镇痛(PCA),药物配方为:芬太尼10~25 μg/h或舒芬太尼4~6 μg/h。如有中重度疼痛,则给予补救镇痛药物凯纷100 mg。
术后2 h及24 h随访患者不良反应发生情况及疼痛程度。疼痛评分采用数字分级法(NRS),用数字0~10对患者疼痛程度进行评估。将疼痛程度分为:轻度疼痛(1~3分),中度疼痛(4~6分),重度疼痛(7~10分)。
随访截止至2013年1月,共获得完整随访病例185例。随访时间3~66个月,中位随访时间为45个月。
采用SPSS 20.0软件进行统计分析。应用K-S法检验样本的分布特征。近似正态分布计量资料采用 ±s表示,两组间的比较采用独立样本t检验;非正态分布的计量资料采用M(P25~P75)表示,两组间的比较采用Mann-Whitney秩和检验;计数资料比较采用χ2检验。生存曲线的绘制采用Kaplan-Meier法。预后影响因素的单因素分析采用Log-Rank检验,多因素分析采用Cox比例风险模型。显著性检验均为双侧检验,P<0.05为差异有统计学意义。
±s表示,两组间的比较采用独立样本t检验;非正态分布的计量资料采用M(P25~P75)表示,两组间的比较采用Mann-Whitney秩和检验;计数资料比较采用χ2检验。生存曲线的绘制采用Kaplan-Meier法。预后影响因素的单因素分析采用Log-Rank检验,多因素分析采用Cox比例风险模型。显著性检验均为双侧检验,P<0.05为差异有统计学意义。
两组资料在男女构成比、中位年龄、ASA分级、BMI、酗酒史、临床症状、肿瘤大小、Child-Pugh分级、血清乙肝表面抗原(HBsAg)及丙型肝炎病毒(HCV)抗体、Edmandson病理分级、病理脉管瘤栓、肝硬化程度、麻醉时间、术中出血、术中输血、BCLC分期及TNM分期等方面差异均无统计学意义(均P>0.05)。结果见表1。
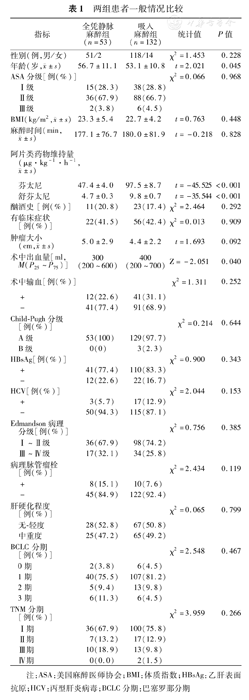
两组患者一般情况比较
两组患者一般情况比较
| 指标 | 全凭静脉麻醉组(n=53) | 吸入麻醉组(n=132) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 性别(例,男/女) | 51/2 | 118/14 | χ2=1.453 | 0.228 | |
年龄(岁, ±s) ±s) | 56.7±11.1 | 53.1±10.8 | t=2.021 | 0.045 | |
| ASA分级[例(%)] | χ2=0.066 | 0.968 | |||
| Ⅰ级 | 15(28.3) | 38(28.8) | |||
| Ⅱ级 | 36(67.9) | 88(66.7) | |||
| Ⅲ级 | 2(3.8) | 6(4.5) | |||
BMI(kg/m2, ±s) ±s) | 23.3±5.4 | 22.7±4.2 | t=0.763 | 0.448 | |
麻醉时间(min, ±s) ±s) | 177.1±76.7 | 180.0±81.9 | t=-0.218 | 0.828 | |
阿片类药物维持量 (μg·kg-1·h-1,  ±s) ±s) | |||||
| 芬太尼 | 47.4±4.0 | 97.5±8.7 | t=-45.525 | <0.001 | |
| 舒芬太尼 | 4.7±0.3 | 9.8±0.7 | t=-35.544 | <0.001 | |
| 酗酒史[例(%)] | 11(20.8) | 23(17.4) | χ2=2.464 | 0.292 | |
| 有临床症状[例(%)] | 22(41.5) | 56(42.4) | χ2=0.013 | 0.909 | |
肿瘤大小(cm, ±s) ±s) | 5.0±2.9 | 4.4±2.2 | t=1.693 | 0.092 | |
| 术中出血量[ml,M(P25~P75)] | 300(200~600) | 400(200~700) | Z=-2.051 | 0.040 | |
| 术中输血[例(%)] | χ2=1.311 | 0.252 | |||
| + | 12 | (22.6) | 41 | (31.1) | |
| - | 41 | (77.4) | 91 | (68.9) | |
| Child-Pugh分级[例(%)] | χ2=0.214 | 0.644 | |||
| A级 | 53(100) | 129(97.7) | |||
| B级 | 0(0) | 3(2.3) | |||
| HBsAg[例(%)] | χ2=0.900 | 0.343 | |||
| + | 41(77.4) | 110(83.3) | |||
| - | 12(22.6) | 22(16.7) | |||
| HCV[例(%)] | χ2=2.044 | 0.153 | |||
| + | 3(5.7) | 17(12.9) | |||
| - | 50(94.3) | 115(87.1) | |||
| Edmandson病理 分级[例(%)] | χ2=0.756 | 0.385 | |||
| Ⅰ~Ⅱ级 | 36(67.9) | 98(74.2) | |||
| Ⅲ~Ⅳ级 | 17(32.1) | 34(25.8) | |||
| 病理脉管瘤栓 [例(%)] | χ2=2.434 | 0.119 | |||
| + | 8(15.1) | 10(7.6) | |||
| - | 45(84.9) | 122(92.4) | |||
| 肝硬化程度[例(%)] | χ2=0.065 | 0.799 | |||
| 无-轻度 | 28(52.8) | 67(50.8) | |||
| 中重度 | 25(47.2) | 65(49.2) | |||
| BCLC分期[例(%)] | χ2=2.548 | 0.467 | |||
| 0期 | 2(3.8) | 6(4.5) | |||
| 1期 | 40(75.5) | 107(81.2) | |||
| 2期 | 5(9.4) | 13(9.8) | |||
| 3期 | 6(11.3) | 6(4.5) | |||
| TNM分期 [例(%)] | χ2=3.959 | 0.266 | |||
| Ⅰ期 | 36(67.9) | 100(75.8) | |||
| Ⅱ期 | 7(13.2) | 17(12.9) | |||
| Ⅲ期 | 10(18.9) | 13(9.8) | |||
| Ⅳ期 | 0(0.0) | 2(1.5) | |||
注:ASA:美国麻醉医师协会;BMI:体质指数;HBsAg:乙肝表面抗原;HCV:丙型肝炎病毒;BCLC分期:巴塞罗那分期
术后2 h随访结果提示,全凭静脉麻醉组疼痛程度明显低于吸入麻醉组(P=0.001),而两组患者术后24 h疼痛程度差异无统计学意义。两组患者在术后镇静、恶心呕吐、躁动等不良反应发生率方面的差异亦无统计学意义(均P>0.05)。结果见表2。
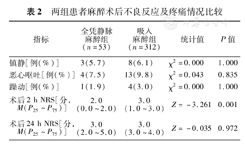
两组患者麻醉术后不良反应及疼痛情况比较
两组患者麻醉术后不良反应及疼痛情况比较
| 指标 | 全凭静脉麻醉组(n=53) | 吸入麻醉组(n=312) | 统计值 | P值 |
|---|---|---|---|---|
| 镇静[例(%)] | 3(5.7) | 8(6.1) | χ2=0.000 | 1.000 |
| 恶心呕吐[例(%)] | 4(7.5) | 13(9.8) | χ2=0.043 | 0.835 |
| 躁动[例(%)] | 1(1.9) | 4(3.0) | χ2=0.000 | 1.000 |
| 术后2 h NRS[分,M(P25~P75)] | 2.0(0.0~2.0) | 3.0(1.0~3.0) | Z=-3.261 | 0.001 |
| 术后24 h NRS[分,M(P25~P75)] | 3.0(2.0~5.0) | 3.0(3.0~4.0) | Z=-0.035 | 0.972 |
到随访截止,185例患者中死亡64例,中位生存时间50.5个月。全凭静脉麻醉组术后1、3、5年生存率分别为90.6%、72.4%和44.7%;吸入麻醉组术后1、3、5年生存率分别为91.3%、74.6%和65.1%(P=0.073)(图1)。185例患者中复发93例,中位无复发生存时间40.9个月。全凭静脉麻醉组术后1、3、5年无复发生存率分别为78.6%、53.7%和34.6%;吸入麻醉组术后1、3、5年无复发生存率分别为72.0%、57.3%和53.3%(P=0.313)(图2)。
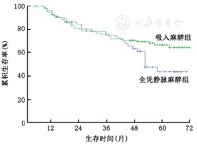

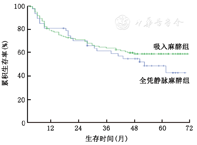

Kaplan-Meier单因素分析显示:肿瘤直径>5 cm、肿瘤多发、中重度肝硬化、围手术期输血、BCLC及TNM分期较晚是影响肝癌患者术后总生存率的不良预后因素。而肿瘤多发、中重度肝硬化、围手术期输血、BCLC及TNM分期较晚是影响肝癌患者术后无复发生存的不良预后因素(表3)。Cox多因素分析显示:肝硬化程度及TNM分期是影响HCC患者生存的独立危险因素。另外,肝硬化程度、围手术期输血以及TNM分期是影响HCC患者无复发生存的独立危险因素(表4)。
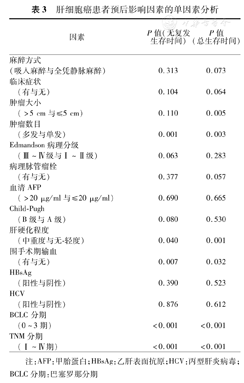
肝细胞癌患者预后影响因素的单因素分析
肝细胞癌患者预后影响因素的单因素分析
| 因素 | P值(无复发生存时间) | P值(总生存时间) | |
|---|---|---|---|
| 麻醉方式 | |||
| (吸入麻醉与全凭静脉麻醉) | 0.313 | 0.073 | |
| 临床症状 | |||
| (有与无) | 0.104 | 0.064 | |
| 肿瘤大小 | |||
| (>5 cm与≤5 cm) | 0.110 | 0.005 | |
| 肿瘤数目 | |||
| (多发与单发) | 0.001 | 0.003 | |
| Edmandson病理分级 | |||
| (Ⅲ~Ⅳ级与Ⅰ~Ⅱ级) | 0.063 | 0.283 | |
| 病理脉管瘤栓 | |||
| (有与无) | 0.377 | 0.057 | |
| 血清AFP | |||
| (>20 μg/ml与≤20 μg/ml) | 0.690 | 0.665 | |
| Child-Pugh | |||
| (B级与A级) | 0.080 | 0.530 | |
| 肝硬化程度 | |||
| (中重度与无-轻度) | 0.040 | 0.001 | |
| 围手术期输血 | |||
| (有与无) | 0.007 | 0.032 | |
| HBsAg | |||
| (阳性与阴性) | 0.390 | 0.523 | |
| HCV | |||
| (阳性与阴性) | 0.876 | 0.612 | |
| BCLC分期 | |||
| (0~3期) | <0.001 | <0.001 | |
| TNM分期 | |||
| (Ⅰ~Ⅳ期) | <0.001 | <0.001 | |
注:AFP:甲胎蛋白;HBsAg:乙肝表面抗原;HCV:丙型肝炎病毒;BCLC分期:巴塞罗那分期
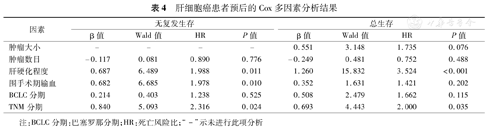
肝细胞癌患者预后的Cox多因素分析结果
肝细胞癌患者预后的Cox多因素分析结果
| 因素 | 无复发生存 | 总生存 | ||||||
|---|---|---|---|---|---|---|---|---|
| β值 | Wald值 | HR | P值 | β值 | Wald值 | HR | P值 | |
| 肿瘤大小 | - | - | - | - | 0.551 | 3.148 | 1.735 | 0.076 |
| 肿瘤数目 | -0.117 | 0.081 | 0.890 | 0.776 | -0.249 | 0.481 | 0.752 | 0.488 |
| 肝硬化程度 | 0.687 | 6.489 | 1.988 | 0.011 | 1.260 | 15.832 | 3.524 | <0.001 |
| 围手术期输血 | 0.682 | 6.685 | 1.978 | 0.010 | 0.352 | 1.631 | 1.421 | 0.202 |
| BCLC分期 | 0.214 | 0.403 | 1.238 | 0.525 | 0.508 | 2.479 | 1.662 | 0.115 |
| TNM分期 | 0.840 | 5.093 | 2.316 | 0.024 | 0.693 | 4.443 | 2.000 | 0.035 |
注:BCLC分期:巴塞罗那分期;HR:死亡风险比;"-"示未进行此项分析
近年来肝癌外科技术不断改进,多元化的肝癌治疗模式不断创新,肝癌的治疗效果稳步提高,但是HCC根治性切除后仍有很高的复发率。有研究显示,HCC根治性切除后5年复发率高达60%以上[2],HCC术后复发转移已成为进一步延长患者生存、改善预后的主要障碍。如何降低HCC术后复发转移,提高总生存率成为目前肝癌研究领域的热点。手术创伤不仅可以引发肿瘤细胞脱落而播散入外周血,还可通过影响患者体内代谢水平、神经内分泌、炎症反应及免疫抑制,从而上调恶性肿瘤分子通路引发肿瘤复燃[3]。因此,目前越来越多的研究集中于如何降低术中手术应激创伤,而麻醉方式的选择及镇痛等相关药物应用亦成为研究的热点。
基础研究表明,一些麻醉药物不但可以促进肿瘤细胞转化和永生,引发肿瘤细胞增殖、血管形成及凋亡,也可加重机体免疫抑制,从而促进肿瘤复发转移[4]。
吸入麻醉药对于肿瘤的影响一直存在争议,很多研究表明吸入性麻醉药可能通过促进肿瘤细胞增殖、转移[5]及抑制NK细胞功能[6]从而促进肿瘤增殖;但也有研究表明吸入麻醉药的基因毒性将会抑制术后肿瘤细胞的复发转移[7]。而大多数文献认为以丙泊酚为代表的静脉麻醉药物可通过提高NK细胞活性、抑制环氧合酶2型和肿瘤细胞内PGE2的形成,从而抑制肿瘤转移[8]。2016年1项涉及11 395例肿瘤患者的大宗回顾性研究显示,对肿瘤患者而言,全凭静脉麻醉方式预后明显好于吸入麻醉(P<0.001),单因素分析显示吸入麻醉药物死亡风险比(HR)为1.59,多因素分析显示吸入麻醉药HR为1.46[9]。我们的研究结果显示:Kaplan-Meier单因素分析结果表明麻醉方式对于HCC总生存及无复发生存无统计学差异。Cox多因素分析结果表明麻醉方式对于HCC总生存及无复发生存亦无统计学差异。目前关于麻醉方式与预后的研究尚无定论,我们的研究结果将为以后观点的争论提供一些依据。当然,我们的研究也存在尚需完善的地方:(1)由于七氟烷本身的镇痛作用,两组麻醉很难控制同样的镇痛效果。动物模型显示,疼痛将引发自然杀伤细胞减少和肿瘤进展,良好的镇痛将降低肿瘤转移发生率[10],因此不同镇痛效果可能干扰两组麻醉方式对于预后的影响。(2)本研究属于回顾性分析,两组病例入组标准和实验方法无统一标准,因此在以后的工作中尚需完善前瞻性研究以提高结论的可信度。
既往很多文献报道:相比于七氟烷,丙泊酚在术后24 h内具有更好的镇痛效果[11,12]。这可能由于挥发性麻醉药可以浓度依赖的方式激活感受器电位(TRP-A1),从而导致痛觉过敏[13]。我们的结果显示,TIVA组在术后早期具有良好的镇痛效果,而对于术后24 h两组效果无显著差异。这可能由于术后24 h以后,患者使用的止痛泵及外科输液计划中的各类止痛药物产生干扰,因此影响了两组麻醉方式镇痛效果的评定。
另外,很多文献证实输血可导致非特异性免疫抑制进而促进恶性肿瘤术后复发转移[14]。在肝癌中,输血可降低自然杀伤细胞数目从而导致免疫抑制,因此影响肝癌预后[15]。我们的研究结果显示围手术期输血是影响无复发生存的独立影响因素(P=0.010)。因此降低围手术期异体血输注也是麻醉管理的重点,主要包括以下几点:(1)改进手术技能及设备;(2)选择合理的麻醉技术(如控制性降压等)和凝血药物;(3)术前自身血液储备;(4)术中稀释性自身输血;(5)血液回收技术;(6)严格掌握输血适应证。
综上所述,不同麻醉方式对于HCC预后的影响无统计学差异。另外,与吸入麻醉相比,全凭静脉麻醉对于患者术后短期内镇痛效果明显,但对于远期镇痛效果及其他术后麻醉不良反应发生率方面无统计学差异。



























