
研究Wnt/β-catenin信号通路在0.5 GyX线促进成骨细胞分化中扮演的重要作用及分子机制。
成骨细胞接受0.5 Gy线照射后流式细胞仪检测细胞凋亡,通过检测检测骨分化标志物Col1α、ALP、OCN蛋白表达水平评估成骨细胞分化情况,应用实时聚合酶链反应(real-time PCR)及免疫印迹检测Wnt信号通路中关键分子的表达,评估特异性抑制剂XAV939阻断Wnt/β-Catenin通路后0.5 Gy X线照射对成骨细胞分化的影响。
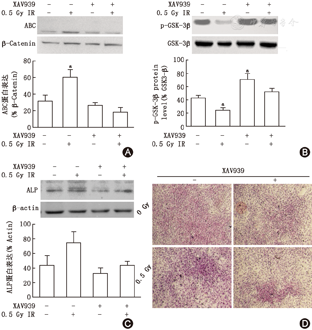
0.5 GyX线照射导致MC3T3-E1细胞骨分化标志物蛋白表达发生动态变化。0.5 GyX线照射后4 d成骨细胞Col1α蛋白表达水平下降(34.5%±5.8%, t=9.912,P<0.001),照射后10 d表达增加(162.5%±6.5%,t=2.673,P<0.05)。OCN在照射后4 d下降约83%(t=3.968,P<0.01),10 d和14 d明显增加,分别为(39.5%±4.1%,t= 3.219,P<0.05)、(79.4%±7.50%, t= 6.708,P<0.001)。ALP的表达水平在7 d(79.7%±22.3%,t=6.257, P<0.001)和10 d(128.3%±6.1%,t= 4.340, P<0.01)时明显增加。X线照射后7 d成骨细胞Wnt3a、LPR5及TCF-4的mRNA表达水平分别增加1.7倍(t= 6.573, P<0.001)、1.1倍(t= 5.323, P<0.05)和1.4倍(t= 3.054, P<0.05);而磷酸化GSK-3β降低42.1%(t= 4.460, P<0.01),稳定活化形式β-Catenin(ABC,脱磷酸β-Catenin)增加1.9倍(t= 3.528, P<0.05)。应用Wnt/β-catenin特异性抑制剂XAV939可以阻断X射线照射导致的ALP表达水平及活性增加。
低剂量X线照射通过Wnt/β-catenin信号通路增加成骨细胞骨分化标志物的表达、促进其分化成熟。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Wnt信号通路在骨代谢过程中具有重要调控作用,其通过不同机制调节成骨细胞增殖与分化[1]。经典Wnt通路中LRP、Wnt3a和Wnt3等可以活化胞内信号分子β-Catenin,并结合核内转录因子TCF以调控靶基因转录,促进成骨细胞分化及骨形成[2]。研究表明,低剂量X线照射可以促进成骨细胞分化及骨折愈合,但具体机制尚不清楚[3,4,5]。近期研究表明,0.5 GyX线照射导致成骨细胞基因表达谱的变化从而发挥一系列生物效应,同时也提示Wnt通路可能参与了这些生物过程[6]。本研究主要探讨Wnt/β-Catenin信号通路在低剂量X线照射促进成骨细胞分化过程中扮演的作用及机制。
胎牛血清及改良α-MEM培养基(Gibco公司);细胞碱性磷酸酶染色试剂盒(南京建成);Annexin V-FITC/PI凋亡试剂盒(Molecular Probes公司);抑制剂XAV939(Selleck公司);兔抗Ⅰ型胶原(Col1α)一抗、兔抗碱性磷酸酶(ALP)一抗、兔抗β-actin一抗(Abcam公司);兔抗骨钙素(OCN)一抗、兔抗脱磷酸β-Catenin一抗(Millipore公司);兔抗β-Catenin(6B3β)一抗、兔抗GSK-3β (27C10)一抗、兔抗p-GSK-3 (Ser9)一抗(CST公司);HRP标记山羊抗兔二抗(Abcam公司);ECL试剂盒(BioInd公司);RevertAid™ M-MuLV逆转录试剂盒(Fermentas)公司,SsoFast™ EvaGreen Mix(BIO-RAD公司);目的基因上下游引物(Invitrogen公司)。
MC3T3-E1小鼠颅骨前骨细胞购自中国科学院上海细胞研究院细胞资源库。细胞培养于含10%胎牛血清(FBS)、100 U/ml青霉素和链霉素的改良α-MEM培养基,37 ℃,5% CO2培养,每3 d换液。诱导成骨分化时,更换成骨诱导条件培养基(含L-抗坏血酸50 μg/ml、β-甘油磷酸钠10 mmol/L、地塞米松10-8 mol/L)。
实验分为假照射组(0 Gy)与实验组(0.5 Gy)。XAV939阻断实验中,在X线照射前选择1 nmol/L XAV939预处理MC3T3-E1细胞,然后分别给予0、0.5 Gy X线照射,即(XAV939+细胞+0 Gy X线)组与(XAV939+细胞+0.5 Gy X线)组。照射方法为:细胞处于对数生长时采用6 mV放射源的医用直线加速器进行X线照射,剂量率为200 cGy,照射时细胞培养瓶下垫放约1 cm厚的组织模拟材料。假照射组除不接受X线照射外,其余处理环节同照射组,包括运送及照射程序。照射当日定义为0 d。
分别收集1、3 d的样本行流失细胞仪凋亡检测。Binding Buffer缓冲液悬浮细胞,调整成1×106个/ml。195 μl细胞悬液加入5 μl细胞凋亡检测试剂(Annexin V-FITC),混匀、室温孵育10 min。洗涤后190 μl Binding Buffer悬浮细胞,加入10 μl PI试剂(20 μg/ml),流式细胞仪分析。Annexin V-/PI-为活细胞:Annexin V+/PI+为坏死细胞和晚期凋亡细胞;Annexin V+/PI-为早期凋亡细胞。
MC3T3-E1细胞按2×105/孔接种于6孔培养板,X线照射后7 d选择Kaplow氏法行ALP染色:吸去细胞上清,磷酸盐缓冲液(PBS)轻洗2次,首先加反应底物覆盖样品,湿盒中37 ℃作用15 min,冲洗后苏木素复染10 min,晾干后观察,紫红色部分为阳性。
按Trizol说明书提取成骨细胞总RNA,测量RNA浓度和纯度,取1 μg样本RNA应用RevertAidTM M-MuLV逆转录试剂盒逆转录合成cDNA。500 ng(1 μl) cDNA加入10 μmol/L的上、下扩增引物各1 μl、SsoFastTM EvaGreen Mix 10 μl按20 μl反应体系在Bio-Rad CFX96系统上进行PCR扩增,引物序列如(表1),每一样品设3复孔。反应条件:95 ℃ 30 s预变性,95 ℃变性5 s、58 ℃-61 ℃退火5 s共40个循环,扩增完成后行溶解曲线检测,验证扩增产物特异性。荧光信号达到所设定的荧光信号阈值对应的循环数为CT值(cycle number at threshold)。采用2-ΔΔCT法进行基因表达水平相对定量,ΔCT=CT目的基因-CT内参基因,ΔΔCT=ΔCT实验组-ΔCT对照组,计算后表示为实验组相对于对照组的倍数。
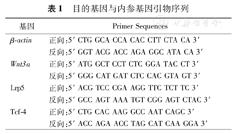
目的基因与内参基因引物序列
目的基因与内参基因引物序列
| 基因 | Primer Sequences |
|---|---|
| β-actin | 正向:5′ CTG GCA CCA CAC CTT CTA CA 3′ |
| 反向:5′ GGT ACG ACC AGA GGC ATA CA 3′ | |
| Wnt3a | 正向:5′ ATG GCT CCT CTC GGA TAC CT 3′ |
| 反向:5′ GGG CAT GAT CTC CAC GTA GT 3′ | |
| Lrp5 | 正向:5′ ACG TCC CGA AGG TTC TCT TC 3′ |
| 反向:5′ GCC AGT AAA TGT CGG AGT CTAC 3′ | |
| Tcf-4 | 正向:5′ CTG CAC AAG GCC AAT CAGC 3′ |
| 反向:5′ ACC AGA ACC TAG CAT CAA GGA 3′ |
分别于照射后4、7、10、14 d收集样本。含蛋白酶抑制剂及磷酸酶抑制剂的细胞裂解液冰上充分裂解细胞,提取样本总蛋白BCA法测蛋白含量。煮沸变性后取40 μg样本蛋白行8%~15% SDS-PAGE电泳并转膜。转膜结束后5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,洗涤后加辣根过氧化物酶标记山羊抗兔二抗室温下轻轻振荡1 h。ECL试剂盒发光显影,膜置入化学免疫发光扫描成像系统拍照并检测印迹条带的光密度值比较分析。
使用SPSS 17.0软件进行统计分析。计量数据结果用 ±s表示。两组之间比较采用t检验,多组之间比较采用单因素方差分析及Student-New-Keuls检验,检验水准为α<0.05。
±s表示。两组之间比较采用t检验,多组之间比较采用单因素方差分析及Student-New-Keuls检验,检验水准为α<0.05。
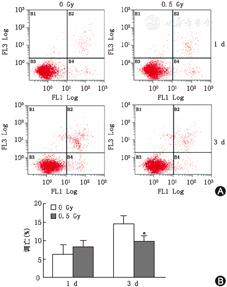
经过0.5 Gy X线照射后的MC3T3-E1细胞分别在第1、3天进行流式细胞仪检测细胞的存活、凋亡及坏死情况,结果显示在照射后1 d时对照组与照射组之间的凋亡率差异无统计学意义,而在照射后第3天,0.5 Gy组和对照组的凋亡率分别为9.8%±1.5%、14.5%±2.18%,差异有统计学意义(t=2.792, P<0.05)(图1)。

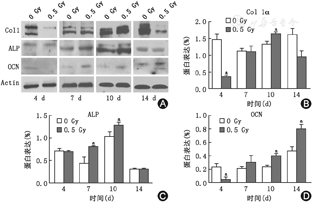
免疫印迹检测成骨细胞骨性标志物蛋白表达水平,MC3T3-E1细胞的骨性标志物的蛋白表达发生动态变化,在分化的中、晚期骨性标志物表达增加,促进其成骨分化(表2,图2)。

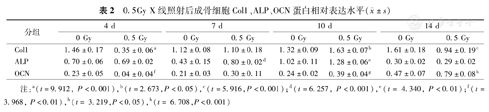
0.5Gy X线照射后成骨细胞Col1、ALP、OCN蛋白相对表达水平( ±s)
±s)
0.5Gy X线照射后成骨细胞Col1、ALP、OCN蛋白相对表达水平( ±s)
±s)
| 分组 | 4 d | 7 d | 10 d | 14 d | ||||
|---|---|---|---|---|---|---|---|---|
| 0 Gy | 0.5 Gy | 0 Gy | 0.5 Gy | 0 Gy | 0.5 Gy | 0 Gy | 0.5 Gy | |
| Col1 | 1.46±0.17 | 0.35±0.06a | 1.12±0.08 | 1.10±0.18 | 1.32±0.09 | 1.63±0.07b | 1.61±0.18 | 0.94±0.19c |
| ALP | 0.70±0.06 | 0.69±0.02 | 0.43±0.15 | 0.80±0.02d | 1.02±0.11 | 1.28±0.06e | 0.30±0.02 | 0.29±0.02 |
| OCN | 0.23±0.05 | 0.04±0.04f | 0.21±0.03 | 0.30±0.11 | 0.24±0.02 | 0.39±0.04g | 0.47±0.07 | 0.79±0.08h |
注:a(t=9.912, P<0.001),b(t=2.673,P<0.05),c(t=5.916,P<0.001);d(t=6.257, P<0.001),e(t= 4.340, P<0.01);f(t=3.968, P<0.01),h(t= 3.219,P<0.05),h(t= 6.708,P<0.001)
Real-time PCR检测0.5 GyX线照射成后Wnt信号通路中关键分子Wnt、LPR5及核转录因子TCF-4的mRNA表达水平显示,在X线照射后第4天Wnt3a、LPR5及TCF-4的表达水平明显降低(图3A~F),其中Wnt3a降低67.0%(t=5.522, P<0.001),LPR5降低64.5%(t=5.184, P<0.001),TCF-4降低71.0%(t=3.400, P<0.05);而在照射后第7天Wnt3a、LPR5及TCF-4的mRNA表达水平分别增加1.7倍(t=6.573, P<0.001)、1.1倍(t=5.323, P<0.05)和1.4倍(t=3.054, P<0.05)。免疫印迹检测结果示0.5 Gy X线照射MC3T3-E1细胞后的早期,活化形式GSK-3β和β-Catenin蛋白表达水平也发生了相应变化(图3G~J);磷酸化GSK-3β在照射后第4天时增加1.4倍(t=2.772, P<0.05),第7天时降低42.1%(t= 4.460, P<0.01);而稳定活化形式β-Catenin在第4天时降低51.5%(t= 2.971, P<0.05),第7天时增加1.9倍(t=3.528, P<0.05)。0.5 Gy X线照在其分化早期Wnt/GSK-3β/β-Catenin信号通路发生了变化,其中在第4天时Wnt信号受到抑制,而在7天时明显得到激活。
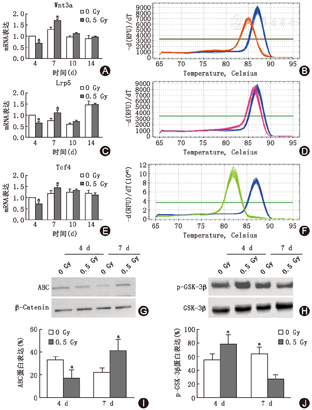

射成骨细胞后4.0.5 Gy X射线通过Wnt/GSK-3β/β-Catenin信号促进成骨细胞分化:用Wnt/β-Catenin抑制剂XAV939(1nM)进行了相关阻断实验显示,在行0.5 Gy X线照射前用XAV939预处理MC3T3-E1细胞可消除X线照射所引起的β-Catenin升高(图4A)及磷酸化GSK-3β降低(图4B)。同样,抑制剂XAV939可消除0.5 GyX线照射所导致的成骨细胞ALP蛋白水平及活性的增加(图4C、D)。Wnt/GSK-3β/β-catenin信号通路直接参与了X线照射促进成骨细胞分化的调控过程。

细胞受到电离辐射后DNA分子中氢键及碱基吸收能量破坏导致双螺旋结构单链或双链断裂,同时启动DNA损伤修复机制[7,8]。Lau等[9]研究发现,2 Gy X线照射小鼠OTC-1成骨细胞24 h后DNA损伤修复可以完成,而7Gy照射后损伤修复的完成时间相对较晚。本结果显示,0.5 Gy X线照射后24 h MC3T3-E1成骨细胞的凋亡与未照射组无明显差异,在照射后3 d时,照射组的细胞凋亡率明显下降,这说明低剂量X线照射成骨细胞具有刺激兴奋效应。Wei等[10]报道,0.3 Gy X线照射神经元干细胞后3 d细胞的凋亡率及坏死率均明显下降。低剂量X线兴奋效应可能与电离辐射的旁效应及非靶效应密切相关。细胞受到低剂量辐射损伤后,在进行DNA修复的过程一些细胞因子的表达也发生了变化,如TGF- 1、IGF-1等,在DNA损伤修复完成后这些细胞因子又会作用于自身或其他细胞,从而影响细胞的生物特性[11]。Xiao等[12]报道,经6 Gy X线照射hFOB成骨细胞的培养上清能增加人造血干细胞的存活率及射线耐受性。本研究结果显示0.5 GyX线促进成骨细胞存活,这可能是由于低水平的X线照射导致的DNA损伤较轻,在早期即可完成DNA损伤修复;另一方面可能是由于辐照导致一些促细胞生长的细胞因子释放减少细胞凋亡。
成骨细胞在分化过程表达Col1、ALP、OCN等基质蛋白,是成骨细胞分化成熟及矿化的重要标志[13,14]。有研究报道,X线照射可以增加成骨细胞分化标志物的表达[15,16]。Matsumura等[15]发现,5 Gy X线照射增加成骨细胞ALP的表达并促进成骨分化。Park等[16]报道,>2 Gy线照射可小鼠颅盖骨原代成骨细胞可增加Col1、ALP、OCN及OPN的mRNA表达水平。高剂量X线辐照后实际是加快了成骨细胞终末分化阶段的完成,在某种意义上讲是成骨细胞老化的表现[9]。这是因为,在较高剂量X线照射后成骨细胞的活性及增殖能力明显受到抑制,且在分化晚期骨分化相关基因的表达反而明显降低[17]。本研究结果显示,0.5 GyX线照射后成骨细胞的凋亡率下降,虽然0.5 GyX线照射成骨细后早期Col1和OCN有暂时的减低,但Col1蛋白表达水平达到峰值的时间较未照射组提前,且ALP、OCN的表达在分化中、晚期明显升高,这说明0.5 GyX线可以促进成骨细胞存活及分化。
Wnt/β-catenin信号通路参与调控成骨细胞增殖与分化过程。经典Wnt通路中胞外因子Wntl、Wnt3a和Wnt3可活化β-catenin并在核内聚集,绑定核内转录因子TCF调控靶基因ALP、OPG、RANKL转录,促进成骨细胞分化成熟及矿化[18,19,20,21]。最近研究报道,经典Wnt信号和非经典Wnt信号参与了4GyX线照射诱导小鼠MSC细胞早期凋亡和晚期老化的过程[22,23]。Wei等[10]研究发现,0.3 GyX线照射通过Wnt/β-catenin信号促进海马神经干细胞增殖及神经发生。虽然这些研究的照射剂量及细胞种类不同,但至少可以说明X线可通过激活Wnt/β-catenin信号通路发挥生物学效应。本研究显示,0.5 GyX线照射成骨细胞后Wnt3a、LRP5、TCF-4的mRAN表达水平增加,同时活化形式β-catenin蛋白水平增加,而负性调控因子p-GSK-3表达水平明显减低。当应用Wnt/β-Catenin抑制剂XAV939预处理成骨细胞,其可阻断0.5 GyX线照射所引起的β-Catenin升高和p-GSK-3降低,同时亦可阻断0.5 GyX线照射所导致的成骨细胞ALP蛋白水平及活性的增加。这正反两方面的关系说明Wnt/GSK-3/β-catenin信号通路直接参与了X线照射刺激成骨细胞分化成熟过程。
综上所述,本研究结果表明低剂量X线照射成骨细胞可产生刺激兴奋效应,这主要表现为细胞凋亡减少及Col1、ALP、OCN的表达增加。此外,低剂量X线照射同时可激活Wnt/β-Catenin信号,参与调控成骨细胞分化过程。提示电离辐射作为一种能量的传导方式,在一定的剂量范围内可促进骨形成,也可能成为治疗如骨折延迟愈合及假体周围骨溶解等骨相关疾病的一种有效方法。由于多条信号通路参与了调控成骨细胞分化过程,因此低剂量X线照射是否对其他信号通路有一定影响,以及不同信号通路之间的相互作用还需要进一步深入研究。



























