
探讨椎动脉夹层动脉瘤(DAVA)的分型及血管内技术治疗策略。
回顾性分析山东大学第二医院神经外科2007年1月至2016年9月采用血管内技术治疗39例DAVA患者的临床资料。根据动脉瘤与小脑后下动脉(PICA)的位置关系分为3型:PICA前型(16例)、PICA中型(9例)和PICA后型(14例);根据对侧椎动脉的血供代偿情况分为代偿型(22例)和非代偿型(17例)。根据上述分型,结合动脉瘤形态及发病形式,综合分析后选择不同的重建性手术或破坏性手术。重建性手术包括支架辅助微弹簧圈栓塞术和单纯支架置入术,破坏性手术采取动脉瘤+载瘤动脉近端栓塞术(CE+PT)。
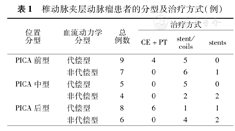
PICA前型16例,其中代偿型9例,4例行CE+PT,5例行支架辅助微弹簧圈栓塞术(stent/coils);非代偿型7例,6例行stent/coils,1例行单纯支架置入术(stents)。PICA中型9例,其中代偿型5例,均行stent/coils,非代偿型4例,2例行stent/coils,2例行stents。PICA后型14例,其中代偿型8例,6例行CE+PT,1例行stent/coils,1例行stents;非代偿型6例,4例行stent/coils,2例行stents。共有10例行CE+PT,23例行stent/coils,6例行stents。围手术期死亡2例,重度残疾1例,围手术期并发症发生率和死亡率分别为7.7%(3/39)和5.1%(2/39);36例患者长期随访显示一次治疗完全栓塞率为77.8%(28/36),长期随访mRS评分:0~2分36例(92.3%),3~6分3例(7.7%)。
基于DAVA与PICA的位置关系、血流动力学、形态学及发病方式而进行的分型对指导血管内治疗方式的选择是安全有效的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
椎动脉夹层动脉瘤(DAVA)是后循环蛛网膜下腔出血(SAH)或缺血的不常见原因,由于其再出血的发病率和死亡率较囊性动脉瘤高而被重视,需及时而有效的治疗。开颅手术由于难度大、风险高,现多采用血管内技术治疗,但尚未形成统一的治疗原则。本研究对血管内技术治疗DAVA患者临床资料进行总结,探讨DAVA的分类及治疗策略。
自2007年1月至2016年9月,山东大学第二医院神经外科应用血管内技术治疗39例症状性DAVA患者,其中男21例,女18例,年龄29~73岁,平均52.2岁。首发症状为突发头痛伴呕吐29例,后循环缺血症状10例。
39例患者术前均行CT、数字减影血管造影(DSA)检查,10例行高分辨率磁共振检查。CT显示29例SAH,10例未见颅内出血。DSA均显示载瘤动脉对称或不对称扩张,伴有近端或远端狭窄,双腔征2例,其中偏侧型28例,全周型11例。高分辨率磁共振显示血管壁内血栓6例,内膜瓣2例。
根据DAVA与PICA的位置关系分为3型:PICA前型:动脉瘤位于PICA近心端;PICA中型:动脉瘤累及PICA起始部;PICA后型:动脉瘤位于PICA远心端且基底动脉未受累及。根据血流动力学情况分为两型:代偿型:对侧椎动脉发育良好,患侧椎动脉闭塞后,可代偿供应双侧后循环血供,球囊闭塞实验(BOT)阴性;非代偿型:对侧椎动脉纤细或发育不良,患侧椎动脉闭塞后,不足以代偿供应双侧后循环血供,BOT阳性。根据形态学表现分为两型:偏侧型:动脉瘤呈囊状,位于椎动脉管壁的一侧,可为1个或多个,范围相对局限;全周型:动脉瘤累及椎动脉管壁横截面的大部或全部,扩张较均匀,在椎动脉长轴方向上其体积可比较局限也可累及较大范围。根据患者的发病形式分为两型:破裂型:以突发头痛为首发症状入院,CT显示蛛网膜下腔出血;未破裂型:以脑缺血、压迫等首发症状入院,CT未见颅内出血。
根据是否保留载瘤动脉通畅分为两类,即保留载瘤动脉的重建性手术和闭塞载瘤动脉的破坏性手术。重建性手术采取支架辅助微弹簧圈栓塞术(stent/coils)以及单纯支架置入术(stents),重叠支架的数目是根据椎动脉夹层的位置、载瘤动脉的曲折程度以及安放完第一个支架后血管造影的结果来确定;破坏性手术采取动脉瘤+载瘤动脉近端栓塞术(CE+PT)。根据DAVA不同分型,给患者提供可选择的治疗方案,然后结合患者及家属的意愿选择不同的治疗方式。
对于意识清楚的患者,采用局麻,6F导引导管插入载瘤动脉,全身肝素化,于椎动脉颅外段,应用不可脱球囊,闭塞载瘤动脉30 min,如出现意识状态改变或头晕等局灶性神经功能缺陷,则为BOT阳性,立即停止实验;如时间持续至30 min无症状,则为BOT阴性。对于昏迷患者,行双侧股动脉穿刺,球囊闭塞同侧椎动脉后,行对侧椎动脉造影,如双侧显影对称,患侧小脑前下动脉及小脑后下动脉均显影良好,患者生命体征平稳,则为BOT阴性,反之则为阳性。
治疗的有效性用动脉瘤的栓塞程度评估,用Raymond分级标准来评价动脉瘤的栓塞程度,治疗的安全性用死亡率、围手术期并发症来评估,用修订的Rankin评分(mRS)来评价患者的临床预后,0~2分为预后好,3~6分为预后差。
本组病例中围手术期死亡2例,重度残疾1例,并发症发生率和死亡率分别为7.7%(3/39)和5.1%(2/39);除上述3例外,36例分别于术后0.5~72个月行DSA检查,平均随访时间13.8个月。动脉瘤一次治疗完全栓塞率77.8%(28/36),复发率22.2%(8/36)。长期随访mRS评分:0~2分36例(92.3%),预后好;3~6分3例(7.7%),预后差。
PICA前型16例,其中代偿型9例,4例行CE+PT,5例行stent/coils;非代偿型7例,6例行stent/coils,1例行stents。PICA中型9例,其中代偿型5例,均行stent/coils,非代偿型4例,2例行stent/coils,2例行stents。PICA后型14例,其中代偿型8例,6例行CE+PT,1例行stent/coils,1例行stents;非代偿型6例,4例行stent/coils,2例行stents。共有10例行CE+PT,23例行stent/coils,6例行stents,表1。偏侧型28例,20例行stent/coils,8例行CE+PT;全周型11例,3例行stent/coils,6例行stents,2例行CE+PT。破裂型29例,17例行stent/coils,2例行stents,10例行CE+PT;未破裂型10例,6例行stent/coils,4例行stents。
椎动脉夹层动脉瘤患者的分型及治疗方式(例)
椎动脉夹层动脉瘤患者的分型及治疗方式(例)
| 位置分型 | 血流动力学分型 | 总例数 | 治疗方式 | ||
|---|---|---|---|---|---|
| CE+PT | stent/coils | stents | |||
| PICA前型 | 代偿型 | 9 | 4 | 5 | 0 |
| 非代偿型 | 7 | 0 | 6 | 1 | |
| PICA中型 | 代偿型 | 5 | 0 | 5 | 0 |
| 非代偿型 | 4 | 0 | 2 | 2 | |
| PICA后型 | 代偿型 | 8 | 6 | 1 | 1 |
| 非代偿型 | 6 | 0 | 4 | 2 | |
PICA前型、PICA后型并发症各发生1例,均为代偿型,采用CE+PT治疗。这2例患者术后均恢复至术前水平,神志清楚,言语正确,四肢活动正常,但当日夜间分别于术后4、7 h发生呼吸骤停,应用呼吸机辅助通气,行CT检查无颅内出血,考虑为脑干缺血。1例治疗后自主呼吸恢复,但呈昏迷状态,重度残疾,1例患者因家属放弃治疗后死亡。PICA中型并发症发生1例,采用stent/coils,术中弹簧圈栓塞时发生动脉瘤破裂出血,抢救无效死亡。
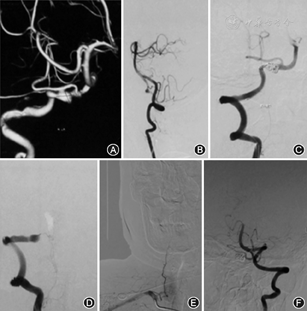
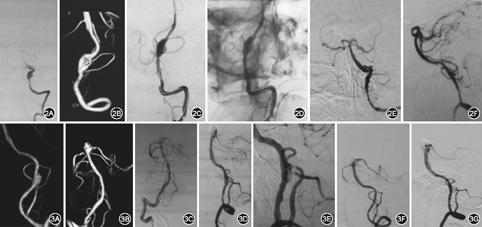
典型病例介绍:例1.患者女,55岁,因突发头痛12 h,加重伴恶心呕吐、意识丧失3 h入院,颅脑CT检查显示SAH,DSA检查显示PICA前型DAVA,行动脉瘤+载瘤动脉近端栓塞术,术后患者神志逐渐转清,言语正确,四肢活动正常,改良RANKIN量表(mRS)评分1分,见图1。例2.患者男,48岁,因突发头晕11 d入院,查体无明显阳性体征,颅脑CT检查未见颅内出血,DSA检查显示,PICA中型DAVA,行3层支架置入术,术后患者症状消失,神志清,言语正确,四肢活动正常,mRS评分0分,见图2。例3.患者男,70岁,因突发剧烈头痛伴恶心、呕吐8 d入院,颅脑CT检查显示SAH,DSA检查显示PICA后型DAVA,行支架辅助微弹簧圈栓塞术,术后患者病情稳定,神志清,言语正确,四肢活动正常,mRS评分0分,见图3。


DAVA在美国和法国的年发病率分别是1/100 000和1.5/100 000[1],发病年龄40~50岁,占后循环动脉瘤的28%,占颅内动脉瘤的3.3%[2,3]。DAVA可表现为SAH、脑干缺血或对周围脑组织的压迫症状,它引起的SAH占所有非创伤性SAH不到10%,而死亡率却占19%~83%,破裂动脉瘤再出血率极高,可达30%~58%[4,5],所以DAVA需要迅速有效的治疗以预防再出血或继续发展。
由于DAVA手术暴露困难,动脉瘤没有明确瘤颈,而且经常有重要穿支动脉起源于动脉瘤,开颅手术风险较大,并发症发生率高,颅内外血管重建的长期随访也显示预后较差[6]。随着介入技术和材料的发展,血管内技术成为治疗DAVA的首选方法,主要包括载瘤动脉近端闭塞、单纯动脉瘤内弹簧圈栓塞等破坏性手术,和支架辅助微弹簧圈栓塞、单纯支架置入、血流导向装置置入以及覆膜支架置入等重建性手术,但对于具体的血管内治疗方式仍存在争议,对椎动脉传统的解剖分段法,或颅内、颅外段分段法对血管内治疗指导意义有限。
本组患者,根据DAVA与PICA的位置关系、对侧椎动脉血流代偿情况、动脉瘤形态及患者发病形式等进行分型,进而采用不同的血管内技术治疗,总的围手术期发症发生率和死亡率分别为7.7%和5.1%,与手术操作相关的并发症为2.6%,92.3%的患者预后好,效果满意。
对于PICA前非代偿型和PICA后非代偿型DAVA需采用重建性手术方式,以保证同侧血供;对于PICA前代偿型和PICA后代偿型DAVA,由于对侧椎动脉可代偿供应双侧后循环血供,所以破坏性手术方式和重建性手术方式均可选择。在采取破坏性手术方式时应慎重,因对侧椎动脉可能发生病变,如动脉粥样硬化性狭窄或血管损伤,或者发生夹层动脉瘤[7],而此时的间接血管对患者来说又尤为重要。本组1例PICA前代偿型和1例PICA后代偿型DAVA,采取破坏性手术后发生脑干缺血。脑干缺血是血管内治疗DAVA术后的主要并发症之一,也是最严重的并发症,一旦发生预后较差。PICA前代偿型DAVA,同侧VA闭塞后PICA需对侧椎动脉逆行供血,短时间虽可耐受BOT,但长时间尤其是患者血压降低时,或发生血流动力学改变时可能发生血供不足。PICA远端的椎动脉大约有5支以上的穿支动脉供应延髓,这些穿动脉的阻塞可能引起延髓梗死[8],PICA后型发生脑干梗死的原因可能为载瘤动脉闭塞长度太长,影响这些穿支动脉的血供导致。这说明,即使BOT阴性也不意味着完全避免延期的脑干梗死[9,10]。所以,对于PICA前代偿型和PICA后代偿型重建性手术方式应作为首选,尤其是预计生存期较长的患者;如重建性手术均存在困难、风险较高或经济条件不允许,则需向患者及家属充分讲明破坏性手术的风险后实施。
对于PICA中型DAVA,无论代偿型还是非代偿型都需选择重建性手术方式,以避免影响PICA血供而导致脑干缺血。本组PICA中型采用stents/coils 7例,stents 2例,无1例发生并发症,但复发比例较高,达4/9。所以,治疗此型DAVA时,在尽量保持PICA流出道通畅的前提下,流出道外弹簧圈应栓塞相对致密,以降低动脉瘤的复发率和围手术期破裂的可能性,但技术上存在一定难度。对于偏侧型DAVA,弹簧圈填入相对简单,重建性手术可采用支架辅助微弹簧圈栓塞;对全周型DAVA,如动脉瘤范围局限而扩张明显,可以行支架辅助微弹簧圈栓塞;如范围较大且呈较对称的梭形扩张,弹簧圈填入困难,可行单纯支架植入术,或者支架置入后弹簧圈疏松填塞。
破裂动脉瘤并发症发生率较高,本组病例并发症全部发生在破裂型。其中2例采用CE+PT发生脑干缺血,1例采用stents/coils发生术中动脉瘤破裂。由于DAVA易再次破裂,死亡率高,很多学者认为如果为代偿型,载瘤动脉闭塞为首选治疗方案,但本组病例显示并发症发生率较高。由于瘤壁脆弱,弹簧圈栓塞过程中,可能刺破瘤壁,发生术中动脉瘤破裂。本组动脉瘤破裂患者,术中为追求致密栓塞,在填塞最后一个微弹簧圈时导致瘤壁穿孔动脉瘤破裂,抢救无效死亡。所以在追求致密栓塞、降低动脉瘤复发与防止动脉瘤破裂之间需权衡利弊,需在保证安全的基础上尽量致密栓塞,栓塞过程中有张力时不苛求完全栓塞,以降低动脉瘤破裂的风险。破裂组动脉瘤2例应用多层支架治疗,术后随访动脉瘤均完全闭塞,这提示单纯支架也可取得较好的治疗效果,而且动脉瘤内未行弹簧圈栓塞,操作相对简单,减少了栓塞时破裂的风险,降低并发症发生率。支架置入围手术期抗血小板聚集药物的应用,也并没有增加动脉瘤的破裂率。多层支架或孔隙率低的支架,由于降低了孔隙率,增加了金属覆盖率,更加有效,So等采用单纯支架置入患者的随访显示,动脉瘤完全闭塞率71.4%,造影改善率86.1%,无一例发生再出血,多层支架组造影改善率明显高于单层支架组。但仍需更大规模的研究及长期随访。
对于未破裂动脉瘤,多因缺血入院,破裂可能性较小,所以保留载瘤动脉的重建性手术更为适宜,支架辅助微弹簧圈栓塞和多层支架置入皆可选,本组未破裂组全部采用重建性手术,无一例发生并发症。
对于存在血管内治疗禁忌证或操作难度较大患者,仍需采取显微神经外科手术治疗。对于椎动脉受累范围较局限的偏侧型动脉瘤可直接手术夹闭;对于椎动脉受累范围较大的动脉瘤或无法直接夹闭的动脉瘤,可考虑行近端载瘤动脉闭塞术,同时结合远端血管搭桥手术,以保证动脉瘤远端血供。但开颅手术风险较大,花费时间长,并发症发生率较高,且颅内外血管重建的长期随访显示预后不佳。



























