
评估纳豆激酶(NK)在降低颈总动脉中膜厚度(CCA-IMT)、颈动脉斑块面积和血脂中的作用,探讨其作用机制和潜在临床应用。
入选病例来自于中山大学附属第三医院中医科门诊,按抽签法随机分为两组(每组41例),NK组:患者每天口服纳豆激酶6 000 FU,ST组:患者每天口服辛伐他汀20 mg,疗程26周。在治疗前和治疗后,采集记录患者的CCA-IMT、颈动脉斑块面积和血脂谱[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)],并进行统计学分析。
入选82例患者,其中76例(NK 39例,ST 37例)按要求完成疗程。经26周治疗后,NK组患者的斑块面积和CCA-IMT显著下降(P<0.01),斑块面积从(0.25±0.12)cm2下降到(0.16±0.10)cm2,而CCA-IMT从(1.13±0.12)mm降到(1.01±0.11)mm, NK组的下降幅度显著大于ST组(P<0.01),NK组和ST组的斑块面积变化率分别是-36.6%与-11.5%; NK能显著降低TG、TC和LDL-C水平(P<0.05),但是与ST组比较,下降幅度相对较小(约为ST组的50%); NK同时有提升HDL-C的作用(P<0.05),而ST对HDL-C水平没有影响。NK组患者降脂幅度与动脉粥样硬化的改善指标没有正相关关系(r=0.35,P=0.09)。
本研究为纳豆激酶有效改善颈动脉粥样硬化的先驱性临床研究。观察结果显示,每天服用NK是控制颈动脉粥样硬化发展的有效方法,效果比辛伐他汀更显著。在管理动脉粥样硬化上,NK可能是潜在的比他汀类更好的选择。NK改善动脉粥样硬化的机制可能与降低血脂没有直接关系,与他汀类药作用机制不同。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心脑血管疾病是人类死亡的头号原因[1],导致冠心病、脑卒中的潜在基本病理过程是动脉粥样硬化(atherosclerosis, AS)。然而,目前治疗和控制AS的有效方法相当有限[1,2]。流行病学研究认为,日本心血管疾病的低发病率和死亡率与食用豆制品包括纳豆(Natto)有关。最近证实,纳豆的高摄入量与心血管疾病总死亡风险和脑卒中病死率降低相关[3]。纳豆最活跃的功能性成分是纳豆激酶(Nattokinase, NK),自从Sumi等[4]在1987年证实了纳豆的纤溶性和从纳豆提取了NK以来,NK的研究有了长足的进展,然而国内的研究大都集中在生产技术和工艺上,只有数量不多的体外应用和动物实验研究[5]。国外早在1990年就小规模观察到NK能增加受试者血浆的纤溶活性[6],并进行了NK用于缺血性脑卒中患者的临床研究[7],随后陆续有相关的报道[8,9,10]。然而,除了中国台湾地区报道过纳豆激酶在29例原发性高胆固醇血症患者中的降脂作用外[9],中国其他地区未报道过NK的临床研究。本研究观察NK对颈动脉粥样硬化和高血脂患者的疗效,探讨其相关的机制和在心脑血管疾病防治中的作用。
研究对象为有颈动脉粥样硬化斑块的高血脂患者。患者的年龄、性别、烟酒史和病史均为自报。所有病例均来自于2014年8月至2016年3月在中山大学附属第三医院中医科门诊就诊的患者。病例入选标准:(1)经彩色多谱勒超声检查首次确诊有单或双侧颈动脉粥样硬化斑块,颈总动脉狭窄≤50%;(2)血脂异常(按1997年中华心血管病学分会《血脂异常防治建议》标准);(3)年龄在45~75岁;(4)入组前1个月未使用过其他治疗血脂异常的药物如他汀类药物;(5)既往无症状性脑卒中或冠心病史;(6)无恶性肿瘤、严重心肝肾疾病;(7)患者知情,并自愿签署知情同意书。本项目经中山大学附属第三医院临床医学伦理委员会批准(批件编号:中大附三医伦[2014]2-92号)。
由于部分患者就诊时已经有治疗的需要,出于医学伦理的考虑,本研究不设安慰剂空白对照组,而用常规他汀降脂治疗作为对照组,入选患者按抽签法随机分为两组:纳豆激酶治疗组(NK组)和辛伐他汀治疗组(ST组)。观察比较口服NK和辛伐他汀两种疗法对颈动脉斑块面积、颈总动脉内中膜厚度(common carotid artery intimal medial thickness,CCA-IMT)和血脂的变化。
在为期26周的研究里,ST组患者服用辛伐他汀分散片20 mg(广州南新制药有限公司),每日一次;而NK组患者口服纳豆激酶片(广州弘肽医疗科技有限公司),日剂量为6 000 FU,分两次服用,早晚各一次。记录不良事件及终点事件(心肌梗死、脑卒中、血运重建以及心血管死亡)。
观察指标为颈动脉粥样硬化的进展(CCA-IMT及颈动脉斑块大小的变化)和血脂变化,记录出现的异常临床表现。这些指标在治疗前和治疗后采集和检测。
采用Phillips IE33彩色多普勒超声诊断仪,探头频率7.5 MHz,检测患者双侧颈总动脉,二维超声观察颈总动脉血管壁、斑块、管腔狭窄率、内中膜厚度(IMT),于颈动脉长轴取IMT最厚处测量。按Spence等[11]的方法测量斑块面积大小。
在治疗前和治疗26周后,采集空腹静脉血,检测血常规及肝肾功能、总胆固醇(TC) 、三酰甘油(TG) 、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
所有需要统计学处理的数据用SPSS 23.0分析,计量资料以 ±SE表示,各组治疗前后比较采用配对t检验,组间两两比较采用q检验,血脂变化的幅度与斑块面积缩小和CC-IMT变薄的相关性采用Spearman等级相关分析,P<0.05为差异有统计学意义。
±SE表示,各组治疗前后比较采用配对t检验,组间两两比较采用q检验,血脂变化的幅度与斑块面积缩小和CC-IMT变薄的相关性采用Spearman等级相关分析,P<0.05为差异有统计学意义。
入选者共计82例,在治疗期间有3例失访,3例有停药记录,完成例数为76例,两组受试者临床特征见表1。
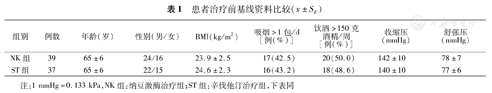
患者治疗前基线资料比较( ±SE)
±SE)
患者治疗前基线资料比较( ±SE)
±SE)
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | BMI(kg/m2) | 吸烟>1包/d[例(%)] | 饮酒>150克酒精/周[例(%)] | 收缩压(mmHg) | 舒张压(mmHg) |
|---|---|---|---|---|---|---|---|---|
| NK组 | 39 | 65±6 | 24/16 | 23.9±2.5 | 17(42.5) | 20(50.0) | 142±10 | 78±7 |
| ST组 | 37 | 65±6 | 22/15 | 24.6±2.3 | 16(43.2) | 18(48.6) | 140±10 | 77±6 |
注:1 mmHg=0.133 kPa,NK组:纳豆激酶治疗组;ST组:辛伐他汀治疗组,下表同
患者服用NK 26周后,CCA-IMT和斑块面积均显著下降(P<0.001),斑块面积减少高达36.6%;NK组的下降幅度显著大于ST组(P<0.05),提示NK比辛伐他汀更有效地改善颈动脉粥样硬化的发展(表2,表3)。
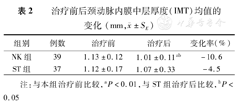
治疗前后颈动脉内膜中层厚度(IMT)均值的变化(mm, ±SE)
±SE)
治疗前后颈动脉内膜中层厚度(IMT)均值的变化(mm, ±SE)
±SE)
| 组别 | 例数 | 治疗前 | 治疗后 | 变化率(%) |
|---|---|---|---|---|
| NK组 | 39 | 1.13±0.12 | 1.01±0.11ab | -10.6 |
| ST组 | 37 | 1.12±0.17 | 1.07±0.33 | -4.5 |
注:与本组治疗前比较,aP<0.01,与ST组治疗后比较,bP<0.05
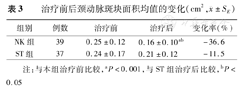
治疗前后颈动脉斑块面积均值的变化(cm2, ±SE)
±SE)
治疗前后颈动脉斑块面积均值的变化(cm2, ±SE)
±SE)
| 组别 | 例数 | 治疗前 | 治疗后 | 变化率(%) |
|---|---|---|---|---|
| NK组 | 39 | 0.25±0.12 | 0.16±0.10ab | -36.6 |
| ST组 | 37 | 0.24±0.17 | 0.21±0.12 | -11.5 |
注:与本组治疗前比较,aP<0.001,与ST组治疗后比较,bP<0.05
两组治疗前后的血脂变化见表4。经26周的疗程后,NK对降低TG、TC和LDL-C有显著的作用(P<0.05),下降幅度分别为7.6%,7.6%和12.7%,与ST组相比,降脂作用相对缓和。ST组辛伐他汀的降脂(降低TG、TC和LDL-C)作用非常显著(P<0.01),幅度大约是NK组的2倍。此外,NK同时还有提升HDL-C的作用(P<0.05),而未观察到辛伐他汀对HDL-C浓度的影响。
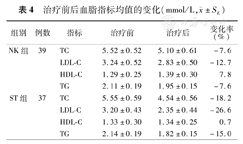
治疗前后血脂指标均值的变化(mmol/L, ±SE)
±SE)
治疗前后血脂指标均值的变化(mmol/L, ±SE)
±SE)
| 组别 | 例数 | 指标 | 治疗前 | 治疗后 | 变化率(%) |
|---|---|---|---|---|---|
| NK组 | 39 | TC | 5.52±0.52 | 5.10±0.61 | -7.6 |
| LDL-C | 3.24±0.52 | 2.83±0.50 | -12.7 | ||
| HDL-C | 1.29±0.25 | 1.39±0.30 | 7.8 | ||
| TG | 2.11±0.19 | 1.95±0.15 | -7.6 | ||
| ST组 | 37 | TC | 5.55±0.59 | 4.54±0.56 | -18.2 |
| LDL-C | 3.20±0.43 | 2.35±0.44 | -26.6 | ||
| HDL-C | 1.33±0.30 | 1.34±0.25 | 0.7 | ||
| TG | 2.14±0.19 | 1.82±0.15 | -15.0 |
为了探讨NK对颈动脉粥样硬化的作用机制,我们分析了其改善颈动脉粥样硬化的作用与血脂变化的关系。统计学分析显示,在NK组里的血脂降低与斑块缩小和CCA-IMT变薄没有明显正相关性(r=0.35,P=0.09)。
本研究通过监测颈动脉斑块面积和CCA-IMT的变化来评估NK在改善动脉粥样硬化中的作用,进而探索其在心脑血管疾病中的应用价值。经26周治疗后,我们的数据显示,NK有效地缩小患者颈动脉斑块面积和CCA-IMT,效果优于辛伐他汀。我们的结果与之前的其他研究者发现是一致的。Kang等[12]在高血脂兔模型上观察到,用NK加上红参8周后,血脂改善、主动脉斑块面积减少。另有研究观察到,NK治疗4周后可抑制兔腹主动脉血管内膜的增生[13];同样是4周的治疗,纳豆提取物显著抑制颈动脉内膜增生,这一作用被认为是NK的抗氧化作用与抗凋亡特性的协同作用结果[14]。可见NK对动脉粥样硬化的抑制作用已经得到证实。
我们还发现,NK对斑块和CCA-IMT的显著抑制效果与血脂水平下降未见有直接关联,提示其缩小斑块面积和降低IMT厚度的作用机制与他汀类不同,因为他汀类对动脉粥样硬化斑块和IMT的作用与降脂密切相关[15]。对于NK改善颈动脉粥样硬化的效果显著大于对照组他汀的科学解析,除了上述的NK抗氧化与抗凋亡作用外,还有如下机制:(1)NK可同时通过不同的路径来增强溶栓和抗凝作用[16],而其抗凝和溶栓活性直接抑制血小板凝聚血栓形成,并可直接有效地改善血液循环[17];(2)NK的抗炎特性在NK组里起积极作用,因为抗炎作用对动脉粥样硬化治疗很重要[18];(3)值得指出是,他汀的降脂作用不一定在短期内导致IMT下降,只有在较晚期的动脉粥样硬化患者中才能观察到他汀降低IMT的作用,而且治疗期在两年以上IMT下降才显著[19]。而本研究只观察了6个月的疗效。此外,他汀疗法对某些高血脂症(如家族性高血脂)患者的颈动脉斑块和IMT没有作用[20]。
我们所观察到的NK降脂作用与在小鼠、大鼠、家兔等动物模型上的观察结果一致[12,21,22]。NK除了显著降低TC、TG和LDL-C水平外,还升高HDL-C。关于NK降脂的机制,有研究证明,NK可以增加肌细胞对脂质尤其是LDL-C的通透性[23],纳豆还可以直接降低TC和TG水平以及抑制LDL的脂质过氧化[24]。有研究表明,纳豆及豆制品里的黄酮类化合物如大豆异黄酮均有降低LDL-C和提高HDL-C的作用[25]。最近发现,当与韩国红参联用时NK的降脂效果更优[12]。我们注意到,有人在高血脂患者观察到NK的降脂作用,但差异无统计学意义[9],这可能与观察时间较短(8周)和使用剂量较低有关。
在过去的30多年里,我国心脑血管疾病的发病率和死亡率猛增[1,2],心血管疾病的总死亡率远高于高收入和中高收入国家,是我们邻国日本的3倍[2]。因此,探索预防和控制心脑血管疾病更有效的方法显得重要和紧迫。本研究为纳豆激酶有效改善颈动脉粥样硬化的先驱性临床研究。我们的结果提示,在治疗动脉粥样硬化时,NK具有比他汀更显著的疗效,值得进行更深入更大规模的临床研究和探讨。鉴于NK具有较好的安全性[26](多项毒理学数据证明)、批量生产容易、成本低、使用便利等特点[27],加上NK非常独特的特征,即NK同时具有纤溶、抗凝[4,28],抗高血压[8,10]、降脂[9]、抗炎抗氧化[24]、神经保护[29]等对心脑血管有益的作用,可以预期,在未来的预防和控制与动脉粥样硬化相关的心脑血管疾病中,NK可能是一个很有潜力的、比他汀更有效、更安全的选择。



























