
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺血栓栓塞症(PTE)是一种常见的疾病,具有潜在致死性,占心血管系统死亡原因第3位[1]。其发病常隐匿,而加重过程又往往非常迅速,未经治疗的PTE患者致死率高达30%,如果临床医生能及时诊断和采取治疗措施,其病死率可降至2%~10%[2]。CT肺动脉造影(CTPA)具有高空间分辨率和扫描速度快的特点,随着其广泛运用,CTPA逐渐取代核素通气灌注显像和肺动脉造影,成为可疑PTE患者的首选影像学检查方法[3],通过CTPA可以观察肺动脉内血栓位置、形态,还可以通过显示栓子在肺动脉内的位置及阻塞程度,评估PTE的严重程度[4]。
通过CT显示栓子在肺动脉内的位置及阻塞程度,运用相关计算所得百分比来表达全部肺动脉管腔被阻塞的程度,所得数值称为肺动脉阻塞指数(PAOI),又称为血栓负荷。采用CTPA技术可以用来指示PTE血栓体积[5],Miller等[6]提出了一种用传统的血管造影方法来评价血栓负荷指数的方法,其后Qanadli等[7]和Mastora等[8]提出的评分系统则以段肺动脉为基础,根据受累肺动脉段的数量和阻塞程度,计算PAOI。评价血栓负荷的主要意义是能定量评估PTE的严重程度,以便于评估PTE的预后。
血栓负荷的评估方法有Miller评分、Walsh评分、Qanadli评分及Mastora评分等,最常用的有Qanadli评分和Mastora评分,均以CTPA显示肺动脉充盈缺损程度进行评分。
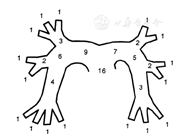

注:右肺动脉分作9个段支气管动脉,左肺动脉分作7个,每个段支气管动脉的血栓阻塞评为1分,段支气管动脉近端动脉血栓阻塞评分等于远端段支气管动脉数量。如右肺下叶基底段动脉血栓,则评为4分;如右肺动脉所有分支中均有血栓,则评为6分;如左肺动脉所有分支中均有血栓,则评为7分
Miller评分范围0~16分。Miller评分中,把右肺动脉分作9个段支气管动脉(上叶3个、中叶2个、下叶4个),左肺动脉分作7个(上叶2个、舌叶2个、下叶3个)。在这些段支气管动脉的任何分支中出现血栓阻塞或充盈缺损均评为1分,段支气管动脉近端动脉血栓阻塞评分等于远端段支气管动脉数量。
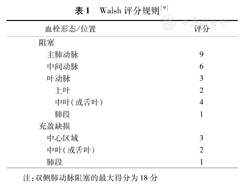
Walsh评分规则[9]
Walsh评分规则[9]
| 血栓形态/位置 | 评分 | ||
|---|---|---|---|
| 阻塞 | |||
| 主肺动脉 | 9 | ||
| 中间动脉 | 6 | ||
| 叶动脉 | 3 | ||
| 上叶 | 2 | ||
| 中叶(或舌叶) | 4 | ||
| 肺段 | 1 | ||
| 充盈缺损 | |||
| 中心区域 | 3 | ||
| 中叶(或舌叶) | 2 | ||
| 肺段 | 1 | ||
注:双侧肺动脉阻塞的最大得分为18分
Walsh评分0~18分,将动脉阻塞程度区分为阻断或充盈缺损,再根据阻塞动脉的部位按左右两侧进行分别评分。
将肺动脉阻塞程度用公式来计算,公式为:[∑(n×d)/40]×100%。n代表肺动脉血栓栓子所在位置的得分(两侧肺动脉各分作10支段支气管动脉,上叶三支,中叶或舌叶各2支,下叶5支,1支肺段动脉出现栓子得1分,亚段动脉栓子等于上一级肺段动脉部分阻塞,记为1分。段以上肺动脉栓子等于其所属肺段动脉总数);d代表栓子阻塞的程度(部分阻塞为1分,完全阻塞为2分)。
也是将PAOI用公式计算得出,但是根据栓子位置及肺动脉阻塞程度来计算。为了对血栓进行评分,评分系统采用分别评价5支纵隔动脉,6支肺叶动脉,20支肺段动脉的方法。5支纵隔动脉包括肺动脉主干、右侧和左侧主肺动脉、右侧和左侧叶间动脉。6支叶动脉包括左右上叶肺动脉、右侧中间叶肺动脉、左舌叶肺动脉、左右下叶肺动脉。20支段肺动脉则包括左右上叶各3支肺段动脉、右中叶和左舌叶各两支肺段动脉、左右下叶各5支肺段动脉。根据各肺动脉管腔横截面阻塞的百分数分级记分(1分,<25%;2分,25%~49%;3分,50%~74%;4分,75%~99%;5分,100%)。评分包括各支动脉的评分之和,每支动脉的最高评分为5分,评分组成包括5支纵隔动脉(评分范围:0~25);6支肺叶动脉(评分范围:0~30),20支肺段动脉(评分范围:0~100)。公式为[∑(n×d)/s]×100%,n代表血栓累及肺动脉数(最小为1,最大为31),d代表栓子阻塞的程度(最小为1,最大为5),s代表最大的阻塞评分(155分)。Mastora评分系统对Qanadli评分法进行补充,较其更加有优势,陈闪闪等[10]指出跨型肺栓塞患者采用Mastora肺动脉栓塞指数评价骑跨型肺栓塞价值优于Qanadli肺动脉栓塞指数。这可能主要是因为Mastora评分系统不是通过近端血管阻塞程度来推测远端血管情况,而近端血管阻塞并不是影响远端血管血流的必要条件,对肺动脉及分支进行各自评分会更加准确。而且,Mastora评分系统采用五制方法对每一支动脉分支进行阻塞等级评估,也提高了准确度。
PTE后RVD是发生急性PTE后30 d内致死的主要原因。PTE患者发生RVD的主要病理生理机制是栓子堵塞肺动脉后,肺动脉阻力增加,导致右心后负荷增加,从而会出现RVD。目前大多数学者认为右室横泾与左室横径比(RV/LV)>1时可考虑RVD,而且这一比值的增加与病死率明显相关。通过CTPA或者心脏超声可以测定RV/LV比值来评价右心功能。而近年来研究表明,血栓负荷对评价PTE患者合并RVD有着重要的临床意义。Tuzovic等[11]采用校正的Miller评分方法,研究认为急性PTE中,右室功能不全的发生与血栓负荷相关。陈闪闪等[10]采用Mastora肺动脉栓塞指数评分,认为与右室功能相关,能够反映肺动脉栓子负荷及右心功能的改变。其他多项研究也表明血栓负荷与PTE患者的RVD指标RV/LV>1有着显著相关性[12,13,14]。在Vedovati等[15]研究中表明,血栓负荷(Qanadli评分)与超声心动图诊断的RVD相关,而与血流动力学状态无关,后者原因可能是因为在急性PTE患者中,血流动力学不仅与PTE相关指标如RVD和血栓负荷有关,也与患者的年龄和并发症等相关。
另外,Vedovati等[16]的研究表明,血栓所处部位和Qanadli评分对预后的判断价值存在差别,体现在其与右室扩张的相关性差别上。例如多个肺段动脉血栓导致右室扩张的可能性并不大,只有更近端的血栓才有可能导致右室扩张。而血栓所处部位又与Qanadli评分相关,多项研究表明血栓负荷与右室扩张有着显著相关性[12,13,14]。造成这种差别的原因可能与血栓负荷分析的复杂性有关,因为研究所选的病例可能存在不一致性,所以血栓负荷预后价值还需要更多的大型研究来确认[13,16]。在慢性PTE患者的研究中[17],发现血栓负荷与右舒张末期容积、右心室直径、RV/LV、右室射血分数等均无相关性。
目前,血栓负荷在评估PTE患者的近期与远期预后价值上存在争议。如van der Meer等[18]研究认为采用Qanadli评分可以帮助判断PTE患者的病死率,Wu等[19]也研究报道了血栓负荷Qanadli评分是PTE患者病死率的重要预测因素,Engelke等[20]研究证实,采用Mastora评分PAOI>21.3%是PTE患者早期死亡的重要预测因子,其风险可增加约6.7倍(P=0.017);而PAOI≤21.3%的患者经规范抗凝后可获得较长期生存率。但随后不少学者做类似研究认为血栓负荷不能评估PTE患者的预后[13,16,21,22]。如Furlan等[13]研究认为,血栓负荷与右心扩张相关,但是却与短期病死率无明显相关性。Ghaye等[23]比较了4种评分方法,没有发现血栓负荷与病死率存在相关性。在Vedovati等[15]研究中表明,血栓负荷(Qanadli评分),与病死率和(或)临床恶化无关。这种相关性被争论了许多年[4,7,18,24,25,26,27],而Vedovati等[15]则认为自己研究纳入的患者数量较大,所以对于判断血栓负荷的临床意义不大这一结论较为准确。在不同研究中出现这种不一致的原因可能与入选人群不同有关,但是也可能反映了这种评分方法的低重复性和较高的组间差异。
慢性血栓栓塞性肺动脉高压(CTEPH)是PTE患者主要慢性并发症。血栓负荷对CTEPH发生发展的预测意义也存在争议。部分学者通过长期随访研究指出,血栓负荷预测CTEPH有一定作用[20,28]。而另一些学者做出的研究得出的结论却不太一致,部分学者通过回顾性分析CTEPH患者,分别采用不同的评分方法,如Qanadli评分和Mastora评分方法,发现两种方法评估的血栓负荷与肺动脉高压均无相关性[17,29]。
Ghanima等[30]、Jeebun等[31]都通过Qanadli评分法证实D-二聚体水平与CTPA的血栓负荷相关。Kucher等[32]研究表明PTE患者采用校正的Mille指数方法,血栓负荷与D-二聚体水平呈正比。国内方春晓等[33]研究结果证实,血浆D-二聚体水平与整体肺动脉PAOI呈正相关,表明D-二聚体水平与CTPA影像所示血栓负荷程度呈正比,即血栓或栓子负荷越多,血浆D-二聚体水平越高,与较低血栓负荷相比,较高栓子负荷能产生较多的纤维蛋白降解产物。
Qanadli和Mastora等评分系统以段肺动脉为基础,根据受累肺动脉段的数量和程度,计算PAOI以估计肺动脉阻塞严重程度。该评分方法在部分研究中能帮助临床医师量化PTE的影响程度,在部分研究中与PTE的预后有直接相关性,但在随后的多项研究中,显示这种评分系统与患者多种预后指标并无明显相关性,可能是因为PTE患者预后与其他临床多种临床因素关系密切。另外,由于这种评分系统比较繁琐,临床广泛应用有一定困难性。已有学者研究计算机自动化测算血栓负荷系统,如Furlan等[13]通过采用新的半自动量化系统,初步研究结果显示其具有令人满意的准确性和可重复性,但仍有待进一步的大规模研究来验证。
虽然血栓负荷在评价PTE患者近期与远期预后情况上尚存在争议,血栓负荷与急性PTE之间相关性的研究结果差异可能与目前血栓负荷在PTE的预后方面的研究比较少,且上述研究的入选标准、病情严重程度等差异有关,需要今后进一步探索血栓负荷对PTE远期预后的价值。在目前还较为缺少急性PTE预后判断指标的情况下,血栓负荷有可能成为一项有潜力的综合判定PTE患者的整体病情的指标,而且随着CT诊断技术的进一步提高,以及在未来更大规模的临床研究结果之上,血栓负荷有可能为PTE的治疗及预后提供更多临床指导意义。


























