
分析胃食管反流病(GERD)患者不同严重程度食管炎的食管动力学功能障碍情况,以及食管炎严重程度与食管动力学功能障碍之间的关系和意义。
将同期行胃镜和高分辨率测压(HRM)的GERD患者按食管炎洛杉矶分型分为非糜烂性胃食管反流病(NERD)组、轻度食管炎组、中度食管炎组和重度食管炎组,各组性别和年龄进行配对,每组各均为80例。非参数检验分析各组上食管括约肌压力、下食管括约肌(LES)压力、LES长度、LES与膈肌脚(CD)高压带距离、以及无效吞咽百分比等HRM参数的差异,并进行两两比较。
LES压力及长度食管随食管炎严重程度的升高而减小,差异有统计学意义(P<0.001,P=0.030),食管无效吞咽百分比随食管炎严重程度的升高而升高,差异有统计学意义(P<0.001),LES与CD高压带距离随食管炎严重程度的升高而升高,差异有统计学意义(P<0.001)。四组间两两比较显示NERD与重度食管炎组的LES压力、LES长度、LES与CD高压带距离、以及无效吞咽百分比等HRM参数的差异均有统计学意义(P<0.001,P=0.012,P<0.001,P<0.001)。从NERD至重度食管炎食管的裂孔疝(HH)检出率明显升高,胃镜的HH检出率为6.3%~82.5%,HRM的HH检出率为16.3%~45.0%,二者的诊断一致性一般(Kappa值为0.31)。
食管低动力状态和HH是食管炎患者的主要食管动力学表现,食管体部功能低下、LES压力低下和HH与食管炎的严重程度相平行,这些异常可能是造成食管炎的重要因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃食管反流病(GERD)为胃内容物反流至食管、口腔(包括咽喉)和(或)肺导致的一系列症状、终末器官效应和(或)并发症的一种疾病。GERD已成为一种常见的,甚至是危害极大的慢性疾病[1]。胃镜检查是GERD评估的基本检查,不但可直接观察GERD所致的食管黏膜损伤,如不同程度的反流性食管炎等,而且还可以显示食管裂孔疝(HH)等解剖学改变,从而为GERD的诊断和预后提供重要的参考依据。食管炎的严重程度在食管黏膜损伤的层面上反映了GERD严重程度,胃食管交界区(GEJ)和食管体部的功能障碍被认为是胃食管反流的主要机制。近年出现了高分辨率测压系统(HRM)被认为可更简单更快捷的用于食管动力的评估和HH的诊断,特别是图形化后直观的显示了食管的蠕动功能,上食管括约肌(UES)和下食管括约肌(LES)静息和吞咽状态下的功能,以及LES和CD的分离现象,并且HRM的HH诊断结果和胃镜有相似的准确性[2],已被广泛的应用于胃食管反流病的诊断和术前评估[3]。本研究分析了不同严重程度食管炎的食管动力学功能障碍情况,以了解食管炎严重程度与食管动力学功能障碍之间的关系和意义。
选择2013年1月至2017年1月于火箭军总医院胃食管反流病科行GERD评估,并首次于本中心同期行胃镜和食管高分辨率测压检查的GERD患者。本研究严格遵守国际"赫尔辛基"宣言,并且通过了医院道德委员会的审查,在此前瞻性对照临床研究开展前已获得患者的知情同意。
纳入条件:年龄≥18周岁,同时符合如下条件:有反流[反酸和(或)反食]、烧心等典型GERD症状,合并或不合并胸痛、咽部异物感、咳嗽、胸闷气短、喘息等不典型症状,临床诊断为GERD,且病程>3个月。排除条件:有上消化道手术史(包括食管部分切除、胃大部切除、胃底折叠术和食管贲门射频术等),贲门失弛缓症和嗜酸细胞性食管炎等。GERD临床诊断:较轻的症状每周出现2 d或以上,中、重度症状每周出现1 d以上,和(或)质子泵抑制剂(PPI)诊断性治疗有效。将患者分为无食管炎组即非糜烂性胃食管反流病(NERD)组、轻度食管炎(LA-A)组、中度食管炎(LA-B)组和重度食管炎(LA-C和LA-D)组,每组各80例,先固定所有80例重度食管炎患者的性别和年龄,再选取与每一例重度食管炎患者性别和年龄完全相同的中度、轻度、和无食管炎患者进行配对。
以管状食管与囊状胃的交界为胃食管交界处(GEJ),其镜下的定位标志为食管下端纵行栅栏样血管末梢处或最小充气状态下胃黏膜皱襞的近侧缘。反流性食管炎采用洛杉矶(LA)分级标准:正常为食管黏膜无破损;LA-A为1个或1个以上黏膜破损,长径≤5 mm;LA-B为1个或1个以上黏膜破损,长径>5 mm,但无融合性病变;LA-C为黏膜破损有融合,但<75%食管周径;LA-D为黏膜破损有融合,至少达到75%的食管周径。内镜下滑动型HH诊断:患者左侧卧位平静呼吸,避免嗳气,适量充气状态,清晰显示GEJ,测量GEJ和膈肌脚(CD)压痕至切牙的距离差,当距离差≥2.0 cm时定义为HH。
停用PPI及胃肠促动力药物至少7 d,检查前禁食至少8 h,经鼻插管,右侧卧位,经过3~5 min的适应期,上食管括约肌(UES)及下食管括约肌(LES)压力相对平稳后开始测压。记录一个至少30 s静息压力,之后每隔30 s嘱受试者吞咽5 ml常温清水,一次吞咽后不做反复吞咽动作,共计吞咽10次以上。采用Manoview 3.0分析软件进行分析,根据2015年芝加哥标准对于食管动力进行综合诊断[4],本研究选取与GERD密切相关的5个参数进行研究,包括UES压力平均值[正常参考值范围:34~104 mmHg(1 mmHg=0.133 kPa),低于或高于正常值为异常]、LES压力呼吸平均值(参考值范围:13~43 mmHg,低于正常值为异常)、LES长度(正常参考值范围:2.7~4.8 cm,低于正常值为异常)、LES-CD压力带分离距离(出现分离为异常,视为HH)和无效吞咽百分比[≥30%为异常,30%~80%为轻度无效食管蠕动(IEM),>80%为重度IEM][5]。
采用SPSS 17.0统计软件对数据进行统计学分析。所有参数均以 ±s表示,各组食管动力学相关参数符合正态分布的用t检验,不符合正态分布的采用Kruskal-Wallis非参数检验,P<0.05为差异有统计学意义,四组间两两比较采用Mann-Whitney非参数检验,P值调整为P<0.013为差异有统计学意义。检出率采用χ2检验进行比较,P<0.05为差异有统计学意义。
±s表示,各组食管动力学相关参数符合正态分布的用t检验,不符合正态分布的采用Kruskal-Wallis非参数检验,P<0.05为差异有统计学意义,四组间两两比较采用Mann-Whitney非参数检验,P值调整为P<0.013为差异有统计学意义。检出率采用χ2检验进行比较,P<0.05为差异有统计学意义。
NERD组、轻度食管炎组、中度食管炎组和重度食管炎组的性别均为男43例,女37例,年龄均为20~75(55±13)岁。各组胃镜下HH的检出率分别为6.3%、23.8%、50.0%和82.5%,胃镜下HH检出率随食管炎严重程度的升高而升高(P<0.001),四组间两两比较差异均有统计学意义(图1A)。胃镜诊断为HH的患者LES压力明显低于无HH患者[(8.4±6.2)比(11.7±6.9)mmHg,P=0.001]。


注:A.胃镜下食管裂孔疝检出率随食管炎严重程度的升高而升高,四组间两两比较差异均有统计学意义;B.高分辨率测压对食管裂孔疝检出率也随食管炎严重程度的升高而升高,四组间两两比较,NERD与中度和重度食管炎差异有统计学意义
NERD组、轻度食管炎组、中度食管炎组和重度食管炎组所纳入的高分辨率测压参数值(表1)均为非正态分布,均采用非参数检验进行比较。四组的UES压力平均值无统计学差异(P=0.636);LES压力呼吸平均值随食管炎严重程度的升高而减小(P<0.001);LES长度随食管炎严重程度的升高而减小(P=0.030);LES下缘与PIP分离的距离随食管炎严重程度的升高而升高(P<0.001),LES-CD压力带分离的检出率分别为16.3%、33.8%、37.5%和45.0%,测压HH检出率随食管炎严重程度的升高而升高(P<0.001);无效吞咽百分比数值随食管炎严重程度的升高而升高(P<0.001),NERD组的重度IEM检出率为8.8%、轻度食管炎组为13.8%、中度食管炎组为21.3%、重度食管炎组为35.0%,重度IEM检出率随食管炎严重程度的升高而升高(P<0.001)。

不同严重程度反流性食管炎的高分辨率测压参数
不同严重程度反流性食管炎的高分辨率测压参数
| 项目 | 食管炎严重程度 | ||||
|---|---|---|---|---|---|
| NERD | 轻度食管炎 | 中度食管炎 | 重度食管炎 | ||
高分辨率测压参数( ±s) ±s) | |||||
| UES压力(mmHg) | 58.9±35.0 | 50.0±33.7 | 56.6±33.7 | 58.6±34.6 | |
| LES压力(mmHg) | 11.9±6.7 | 12.2±7.9 | 9.8±6.1 | 7.6±5.3 | |
| LES长度(cm) | 3.1±0.6 | 3.0±0.5 | 2.8±0.7 | 2.8±0.7 | |
| 压力带分离(cm) | 11.9±6.7 | 12.2±7.9 | 9.8±6.1 | 7.6±5.3 | |
| 无效吞咽百分比(%) | 0.1±0.4 | 0.3±0.6 | 0.6±1.0 | 0.6±0.9 | |
| 各参数异常例数百分比(%) | |||||
| UES压力 | 37.5 | 35.0 | 35.0 | 35.0 | |
| LES压力 | 65.0 | 60.0 | 70.0 | 82.5 | |
| LES长度 | 13.8 | 20.0 | 36.3 | 35.0 | |
| 压力带分离 | 16.3 | 33.8 | 37.5 | 45.0 | |
| 无效吞咽百分比 | 32.5 | 40.0 | 60.0 | 57.5 | |
注:NERD :非糜烂性胃食管反流病;UES:上食管括约肌;LES:下食管括约肌;1 mmHg=0.133 kPa
四组间的高分辨率测压参数进行两两比较(图2):NERD组、轻度食管炎组、中度食管炎组和重度食管炎组各组间的UES压力平均值差异均无统计学意义;NERD组与重度食管炎组的LES压力、LES长度、LES-CD分离的距离、无效蠕动百分比均差异有统计学意义(P<0.001、P=0.012、P<0.001、P<0.001);NERD组与中度食管炎组的LES长度、LES-CD分离的距离、无效蠕动百分比差异有统计学意义(P=0.012、P=0.001、P=0.001)。NERD组与轻度食管炎组的LES下缘与PIP分离的距离差异有统计学意义(P=0.008)。轻度食管炎组与重度食管炎组的LES压力、无效蠕动百分比差异有统计学意义(P<0.001、P=0.001);中度食管炎组与重度食管炎组的各测压参数差异均无统计学意义。测压下HH检出率随食管炎严重程度的升高而升高(P<0.001)(图2),四组间两两比较NERD组分别与中度和重度食管炎组差异有统计学意义(图1B)。胃镜和高分辨率测压对本组患者的食管裂孔疝的总检出率为53.1%,胃镜对HH的检出率高于高分辨率测压(40.6%比33.1%,P<0.001);两种方法结果的一致性一般(Kappa值为0.31)。
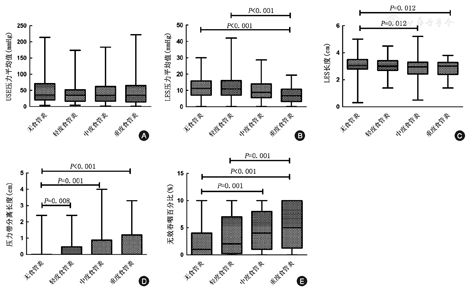

注:UES:上食管括约肌LES:下食管括约肌A. UES压力的比较;B. LES压力的比较;C. LES长度的比较;D.压力带分离长度的比较;E.无效吞咽百分比的比较
食管炎的严重程度可反映出GERD的严重程度,24 h阻抗pH监测发现食管炎患者较NERD患者的DeMeester评分、最长酸反流时间和长周期反流(>5 min)与食管炎有统计学正相关,另外>3次的长周期反流对重度食管炎有良好的预测能力[6]。其中,最长酸反流时间和长周期反流的次数不但与GEJ的抗反流功能有关,还与食管体部的反流清除能力相关[7]。
LES平滑肌产生的腔内压力、CD产生的腔外压力、GEJ的顺应性、膈食管膜的完整性(将下食管固定于膈裂孔)、以及胃食管形成的"阀瓣"(食管和胃底形成的His角)构成了GEJ区复杂的抗反流装置。GEJ向近端移位进入膈裂孔则产生了滑动型HH,从而造成多种抗反流组成部分出现障碍,所以有HH患者较无HH患者GERD发生率更高,且反流症状,食管炎和巴氏食管症状更显著[8,9]。合并HH的患者可观察到更普遍的GER相关性食管外呼吸道症状(如咳嗽或声嘶),并且更容易出现夜间症状[10]。
GERD患者较非GERD患者有更高的HH合并率,据估计50%至90%的GERD患者合并有HH,而没有GERD症状和体征的患者合并HH的比例较低[11]。本研究显示胃镜及HRM对NERD至重度食管炎HH的检出率均明显升高,食管炎的检出率和HH的检出率有统计学相关性,表明GERD严重程度与其合并的HH明显相关。本研究亦显示胃镜和HRM的诊断一致性一般,对于NERD和轻度食管炎HRM诊断HH的敏感性优于胃镜,而对于中重度食管炎胃镜诊断HH的敏感性优于HRM。分析其原因,NERD和轻度食管炎患者的LES和CD压力带显示清晰,通过HRM可以发现更多的微小HH,而中重度食管炎合并更高比例的重度IEM、LES和CD压力过低,导致分离的压力带在HRM上无法清晰显示而无法判断压力带分离,而导致HH的漏诊,故胃镜结合HRH可以提高HH的检出率。Khajanchee等[12]以腹腔镜术中诊断的HH为金标准与胃镜和HRM对HH诊断的相比较,发现HRM的假阳性率低于胃镜,假阴性率相似,HRM的特异性高于胃镜。
一过性下食管括约肌松弛(TLESR)被认为是导致胃内容反流进入食管的主要机制,GERD患者75%的反流事件发生于TLESR。然而,GERD越严重TLESR参与引起反流事件的作用反而越弱,而LES压力过低的合并率越高[13]。有研究表明,食管炎患者的LES平均压力显著低于NERD患者[14]。另外,和没有HH的GERD患者相比,TLESR在合并HH的患者中的作用较为次要[13]。本研究亦显示从NERD至重度食管炎LES压力逐渐下降,NERD和轻度食管炎患者LES压力显著低于重度食管炎,而且胃镜检出为HH的患者较无HH患者的LES压力明显下降。故上述研究表明严重GERD患者的主要反流机制可能是HH的形成和LES压力过低,而不是TLESR。
研究发现GERD患者较正常人群在低压力扩张下其GEJ开放的更大,这一现象不单是因为HH引起的GEJ纵向上移或LES压力下降,还与GEJ区的其他改变有关,如CD的退化、膈食管膜完整性的破坏、以及LES肌层的退化等[15]。Bredenoord等[13]研究发现合并微小HH的患者在HRM检查时可发现频繁的LES和CD的暂时性分离,而且LES和CD分离时(出现HH)观察到的反流事件要明显多于HH消失时的反流事件。表明相当于"外括约肌"的CD,也是抗反流屏障的重要组成部分,CD薄弱、CD与LES的纵向或横向分离均可造成CD功能障碍,从而导致反流的发生。
IEM,如无效吞咽或蠕动缺失,可引起食管清除功能障碍[5]。弱蠕动被认为是GERD最常见的食管功能障之一[16]。GERD越严重则食管蠕动功能障碍的合并率越高,进一步证实了GERD患者的这种食管动力学特点[14,17]。Frazzoni等[18]发现ERD和NERD不但LES压力明显低于正常对照和功能性烧心患者,而且ERD患者的食管远端收缩幅度明显低于NERD、功能性烧心和正常对照,而且ERD和NERD患者HH的合并率亦明显高于功能性烧心和正常对照。然而轻度的IEM并不影响GERD患者食管清除,只有严重的IEM,尤其在卧位时,会明显延长食管清除和酸暴露[5]。本研究亦显示从NERD至重度食管炎不但HH与LES过低的检出率逐渐升高,而且食管蠕动功能亦逐渐减弱,NERD的重度IEM为8.8%,而重度食管炎的重度IEM则高达35.0%,故这类患者应加强夜间抗反流治疗,如夜间服用PPI等药物及抬高床头睡眠等[19]。
PPI按需治疗能长期、有效的治疗多数NERD和轻度食管炎患者。对于合并HH以及重度食管炎的患者,剂量通常需要加倍,因多数停药后容易复发,通常需要PPI长程维持治疗[20]。对于重度食管炎酸反流和食管动力障碍均起关键的作用[21]。故针对中重度GERD的亦可加用动力治疗,如巴氯芬等(LES的压力和抑制TLESR的发生)也被用于GERD的治疗,无论对于典型症状还是食管外症状均取得了一定的疗效,并可应用于难治性GERD[22]。多潘立酮和伊托必利等促动力药可加速胃排空,增加LES压力和加快食管清除,然而目前被证明对GERD症状和并发症的疗效有限,而多作为GERD治疗的辅助用药[23]。
射频治疗是目前国内使用比较广泛的GERD食管腔内治疗技术,该方法可显著减少TLESR,增加LES压力,减少酸暴露,改善反流、烧心等典型症状乃至咳喘等食管外症状,多用于没有HH或HH<2 cm的慢性NERD乃至功能性烧心的患者,多数患者疗效至少可维持4至10年[24]。本研究显示食管炎越明显则HH的合并率越高,其中重度食管炎的HH合并率可高达45%~83%,说明严重食管炎更倾向于解剖学问题,而非单纯的食管黏膜损伤问题,其中HH可能是食管炎的重要成因,故该类患者有抗反流手术指征[25]。抗反流手术被证明能够纠正GEJ区域的HH,CD和LES功能缺陷,从而形成抗反流阀瓣,提高GEJ整体压力和抗扩张能力,又可减少TLESR的频率,而且还可增强食管体部的收缩能力,从而增强清除功能,理论上可以终止绝大部分乃至所有形式的反流[10,26]。
综上所述,食管低动力状态和HH是食管炎患者的主要食管动力学表现,食管体部功能低下、LES功能低下和HH与食管炎的严重程度相平行,尤其在重度食管炎的这四联想象最为明显,这些异常也可能是造成食管炎的重要因素。



























