
比较木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶对优黑素和褐黑素的脱色活性并观察外用LiP对308 nm准分子光诱导豚鼠皮肤色沉斑的影响。
碱溶法从人毛发及皮肤黑素瘤组织中提取褐黑素并商业购买优黑素,将等量(0.02%)黑素与相同活性单位(200 U/L)的3种木质素降解酶孵育3 h,使用酶标仪测定反应液A475值变化;用308 nm准分子光诱导豚鼠皮肤色沉斑模型,将LiP与加热灭活LiP反应液外涂于色沉斑处,同时用3%氢醌乳膏与乳膏基质作对照。用皮肤色度计测定L值变化;胶带法采集脱落角质层细胞,Fontana-Masson嗜银染色观察脱落角质层细胞与皮肤组织中黑素颗粒的分布与数量。
3种木质素降解酶对优黑素及褐黑素均有脱色活性,其中LiP脱色效率为40%~70%,MnP约为22%~42%,漆酶约为9%~21%;体内实验显示,LiP反应液与3%氢醌乳膏均可使色沉斑颜色变浅。脱落角质层细胞中黑素颗粒的平均数量,LiP组为199±11,低于空白组(923±12)和酶热灭活假处理组(989±13)。组织学检查发现氢醌组表皮增厚,全层黑素颗粒减少,而LiP组表皮正常,仅表皮浅层黑素颗粒减少,深层仍有黑素颗粒存在。
LiP对皮肤及毛发黑素脱色作用最强,优于MnP和漆酶,能否替代氢醌制剂成为新一代高效安全的皮肤增白剂用于临床有待进一步证实。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
位于人表皮基底层和毛球基质的黑素细胞(MC)借酪氨酸酶等黑素生成蛋白酶的催化,调节生成两种黑素分子,即优黑素和褐黑素的比例与数量直接决定着皮肤与毛发着色。MC代谢活跃与黑素生成异常增加可导致黄褐斑与炎症后色素沉着斑等。目前,以氢醌及其衍生物为代表的酪氨酸酶抑制型皮肤增白剂(skin lightening agent)是治疗这类色素增加性皮肤病的主干药物[1]。然而,这类单酚化合物的理化性质不稳定,除自身存在皮肤刺激外,作为皮肤增白化妆品的添加成分长期大剂量使用有削弱光保护甚至增加光致癌的风险[2]。加速表皮外层细胞内黑素颗粒的降解,而不影响表皮深层MC的黑素合成,可能代表着一种更安全有效的皮肤增白策略[3]。最近的研究发现,自白腐真菌分离到的木质素降解酶具有分解黑素的活性[4,5]。本研究比较了3种木质素降解酶即木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(laccase)对皮肤和毛发衍生黑素的脱色作用。同时,观察了含LiP反应液对UVB照射诱导豚鼠皮肤色沉斑的脱色效果与脱落角质层细胞内黑素的降解。
LiP(货号42603)、MnP(货号93014)、漆酶(货号38429)及合成黑素(货号M8631)均购自美国Sigma-Aldrich公司;RIPA裂解液购自上海碧云天生物技术公司;3%氢醌乳膏(本院药剂科自制);30%过氧化氢、酒石酸、酒石酸二钠、硫酸锰、氯化金、硝酸银等均为市售分析纯。
8周龄雌性棕黄色豚鼠5只,体质量400~520 g,购自武汉生物制品研究所有限责任公司,饲养于武汉大学人民医院普通级动物房。
(1)毛发黑素提取:参照Krol等[6]的毛发碱溶性黑素提取方法。称取1 g亚洲人黑发,剪碎放入离心管中,加入1 mol/L NaOH于37 ℃放置24 h,取上清液过滤,滴加1 mol/L HCl至溶液pH=1.0,此时溶液中可见絮状沉淀,离心之后将上清液弃去,加入NaOH将黑素团块儿溶解,再次加入1 mol/L HCl沉淀,离心弃上清,最后用75%乙醇清洗黑素沉淀干燥备用。(2)皮肤组织黑素提取:参照Watts等[7]的自皮肤黑素瘤组织中提取黑素方法。取1例病理确诊为恶性黑素瘤患者手术切除废弃的肿瘤组织,质量约10 g,去除皮下脂肪组织后将样本切成薄片,置于玻璃匀浆器中加入双蒸水进行研磨,离心之后弃上清,使用磷酸盐缓冲液及氯仿甲醇溶液(氯仿∶甲醇=2∶1)清洗沉淀物以除去水溶或脂类物质。最后用细胞裂解液处理30 min后离心,清洗黑素团块干燥备用。
3种降解酶酶促反应体系于96孔细胞培养板中进行。总酶反应体积为250 μl,即于125 mmol/L酒石酸-酒石酸钠缓冲液内加入0.02% 黑素(w/v,皮肤黑素、毛发黑素与对照合成黑素),200 U/L降解酶。LiP和MnP反应体系内每隔10 min还需添加2 μl过氧化氢至终浓度为80 μmol/L,漆酶不加过氧化氢。置于28 ℃恒温箱,于不同作用时间(10、20、30、60、120及180 min)用酶标仪测定每孔在475nm处的吸光值。反应完毕收集各组反应液至离心管摄像对比颜色变化。用以下公式计算脱色效率: , A0为加入酶即刻所测的吸光度值;At为不同终末时间点所测的吸光度值[8]。
, A0为加入酶即刻所测的吸光度值;At为不同终末时间点所测的吸光度值[8]。
参照文献[1]的方法,棕黄色豚鼠腹腔麻醉后背部剃除毛发,皮肤用308 nm准分子光治疗仪(日本Ushio公司产)照射,隔日1次,共4次,单次总辐照剂量为500 mJ/cm2。末次照射1周后皮肤照射区域形成稳定的色沉斑。色沉斑皮肤分别给予乳膏基质(空白对照组),3%氢醌乳膏,LiP反应液和灭活LiP反应液(于95 ℃加热10 min使酶灭活,假对照组),1次/d,连用14 d。其中LiP反应液组和灭活LiP反应液组每次使用约0.05 U酶液,外用反应液1 min后,外涂80 μmol/L过氧化氢溶液作为激活剂。摄像记录色沉斑颜色变化,并用CR-10色度计(日本美能达产)测定L值的改变。
皮肤组织常规石蜡包埋切片与胶带粘贴法采集脱落角质层细胞[1],滴加氨银溶液孵育,氯化金溶液增色,伊红复染。脱水、透明和封片后,于Olympus正置显微镜下观察并拍照。载有脱落角质层细胞的玻片,观察前于玻片上滴加香柏油。使用Image-J图像分析软件(美国NIH免费版)计数角质层细胞内的平均黑素颗粒。
采用SPSS 21.0软件,所有计量资料采用 ±s表示,各组数据间的比较采用方差分析,各药物处理组与单乳膏基质组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
±s表示,各组数据间的比较采用方差分析,各药物处理组与单乳膏基质组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
将等量(0.02%)的黑素与相同活性单位(200 U/L)3种木质素降解酶孵育3 h后观察黑素的颜色变化,见图1。LiP对3种黑素的脱色效率为40%~70%,而MnP约为22%~42%,漆酶约为9%~21% (表1)。用碱溶法自毛发和黑素瘤组织中提取到的黑素主要成分是褐黑素[6,7],而多巴氧化法合成的黑素为优黑素[9]。结果提示,LiP对褐黑素和优黑素的脱色作用均明显优于MnP和漆酶。


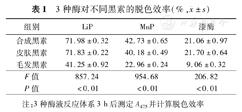
3种酶对不同黑素的脱色效率(%, ±s)
±s)
3种酶对不同黑素的脱色效率(%, ±s)
±s)
| 组别 | LiP | MnP | 漆酶 |
|---|---|---|---|
| 合成黑素 | 71.98±0.32 | 42.73±0.65 | 21.06±0.97 |
| 皮肤黑素 | 71.83±0.22 | 40.18±0.49 | 21.70±0.64 |
| 毛发黑素 | 41.25±0.92 | 22.96±0.24 | 9.06±0.32 |
| F值 | 857.24 | 954.68 | 206.82 |
| P值 | <0.01 | <0.01 | <0.01 |
注:3种酶液反应体系3 h后测定A475并计算脱色效率
图2显示,局部外涂2周LiP反应液与3%氢醌乳膏均可使色沉斑颜色变浅。L值氢醌组为53.4±1.0,而LiP组为51.5±1.2,均高于空白组(48.2±1.3)和酶灭活假处理组(46.6±0.6)。外层脱落角质层细胞嗜银颗粒比较(表2)显示黑素颗粒的数目,其中氢醌组为268±12,而LiP组为199±11,均低于空白组(923±12)和酶灭活假处理组(989±13)。组织学检查发现,氢醌组表皮增厚,全层黑素颗粒减少,而LiP组表皮正常,表皮浅层黑素颗粒减少,深层仍存在有黑素颗粒(图3,图4)。



各组L值、表皮厚度及脱落角质层细胞中黑素颗粒计数测定(%, ±s)
±s)
各组L值、表皮厚度及脱落角质层细胞中黑素颗粒计数测定(%, ±s)
±s)
| 组别 | L值 | 表皮厚度(mm) | 黑素颗粒 |
|---|---|---|---|
| 空白对照 | 48.2±1.3 | 0.43±0.02 | 992.6±12.2 |
| 3%氢醌乳膏 | 53.4±1.0b | 0.81±0.01b | 268.5±12.3b |
| LiP反应液 | 51.5±1.2b | 0.45±0.02a | 199.1±11.1b |
| 灭活LiP反应液 | 46.6±0.6a | 0.47±0.03a | 988.7±13.2a |
| F值 | 16.132 | 17.961 | 408.9 |
| P值 | <0.01 | <0.01 | <0.01 |
注:与空白对照组比较aP>0.05;与空白对照组比较bP<0.05
有学者提出疑问"在化妆品和防晒霜中大量添加酪氨酸酶抑制型皮肤增白剂可能存在损伤皮肤光保护能力的风险"[2]。最近发现,从真菌白腐菌中分离到的3种降解木质素的胞外酶(LiP、MnP和漆酶)可以有效分解黑素使其脱色[3,4]。我们推测,是否含这些木质素降解酶的反应液外擦于皮肤色素斑,可使色素斑快速清除而又不干扰表皮深层MC的黑素合成,不影响皮肤的光保护能力。为此,我们比较了3种木质素降解酶对碱溶法分离到的褐黑素(毛发黑素与皮肤黑素)与多巴氧化法合成的优黑素的脱色作用。结果显示(图1和表1)LiP脱色作用最强,优于MnP和漆酶。体内实验显示,LiP反应液对308 nm准分子光诱导豚鼠皮肤色沉斑的脱色作用与3%氢醌乳膏相当。氢醌组表皮厚度增加,且全层黑素颗粒减少,而LiP反应液组表皮正常,黑素颗粒减少主要见于脱落角质层细胞与表皮浅层。黑素是由5,6-二羟基吲哚(DHI)和5,6-二羟基吲哚羧酸(DHICA)等构件分子组成的大分子生物聚合物,与木质素的化学结构类似[5]。LiP作为一种铁依赖的过氧化物酶,在过氧化氢的驱动下产生大量的自由基促使多酚芳香化合物的化学键断裂[8]。
最近已有报道用含有LiP的霜剂治疗面部黄褐斑有效[10]。遗憾的是LiP最适pH值为2.5[4],酸性LiP酶反应液直接外用人类皮肤会产生明显不适和刺激反应。接下来,本研究拟通过基因工程与分子改造的方法表达筛选有可能用于临床的近中性LiP同工酶[11]。此外,本研究还发现LiP能快速降解毛发黑素,能否代替传统的毒性较大的对苯二胺氧化染发剂用于亮发染发产品有待证实。



























