
初步探讨扁桃体切除治疗肾移植术后复发性IgA肾病的临床效果。
收集11例自2014年5月在华中科技大学同济医学院附属同济医院器官移植研究所行移植肾穿刺活检确诊IgA肾病复发的病例,行扁桃体切除治疗,中位随访14(4~38)个月,观察扁桃体切除前后的尿蛋白、尿红细胞、估算肾小球滤过率(eGFR)水平及血清总IgA水平变化,并统计该组病例扁桃体切除后的移植受者和移植肾存活率。
11例受者中,8例在扁桃体切除后蛋白尿显著减少甚至转阴,并在之后的随访期内保持良好。其余3例受者的扁桃体切除对缓解蛋白尿疗效不明显,最终移植肾均于继续随访1年内失功,患者恢复血透治疗。影响扁桃体切除治疗效果的因素可能包括:原发病为急进性肾小球肾炎合并新月体形成、二次移植IgA肾病复发、出现蛋白尿后干预时机过晚等。本组病例扁桃体切除后血清中IgA水平显著下降,切除后随访期间均无急性排斥反应或感染发生,11例受者全部存活,8例移植肾存活。
扁桃体切除是移植肾复发性IgA肾病比较可靠有效的治疗方式,可以在未来的临床中逐步推广应用,但需要注意进行干预的时机及原发IgA肾病的病理特点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植术后原肾病复发是除排斥反应之外,导致移植肾丧失功能的重要原因之一。据国外报道,多达20%的肾移植受者可因原发肾病在移植肾复发而重新恢复透析治疗[1]。在亚洲,IgA肾病是肾小球肾炎中最常见的一种类型,是导致终末期肾脏疾病的常见病因,也是肾移植术后较易复发的一种原发病[2],其复发时间在移植后数月至十余年不等,复发率根据临床或病理诊断标准的不同统计为15%~78%不等[3]。目前国际上对移植肾IgA肾病复发尚无公认的特效治疗手段,近些年在日本尝试使用扁桃体切除进行预防和治疗取得了良好的临床疗效[4,5,6],但在其他国家还鲜有报道。近3年来,同济医院器官移植研究所在国内开始尝试使用扁桃体切除治疗经病理活检证实的肾移植术后复发性IgA肾病,本研究对该组临床资料进行回顾性分析,报道如下。
自2014年5月对华中科技大学同济医学院附属同济医院器官移植研究所行肾移植术后出现明显蛋白尿的75例受者行移植肾穿刺活检,其中17例(22.7%)表现为IgA肾病。通过追问病史,若原发病为病理诊断的IgA肾病,则明确移植肾为原肾病复发(11例),如原肾未经穿刺活检,原发病不详,则高度怀疑移植肾IgA肾病复发(6例)。在我们的建议下,其中11例接受了扁桃体切除术,6例选择保守治疗。本研究经华中科技大学同济医学院附属同济医院伦理委员会批准,所有入组受者知情同意。
患者一般资料见表1。11例受者中男9例,女2例;成人10例,儿童1例;年龄14~51(33±12)岁;亲属供肾3例,尸体供肾8例;初次肾移植10例,二次肾移植1例。免疫诱导方案中使用抗CD25单克隆抗体6例,抗胸腺细胞球蛋白2例,仅激素+环磷酰胺3例。口服免疫维持方案中使用他克莫司(Tac)+霉酚酸酯(MMF)或霉酚酸(MPA)+泼尼松(Pred)5例;环孢素(CsA)+MMF或MPA+Pred 4例;雷帕霉素(Rapa)+小剂量CsA+Pred 2例(表1)。11例受者出现明显蛋白尿的中位时间为移植后18(3~117)个月,均给予口服血管紧张素受体拮抗剂(ARB)、雷公藤多苷片或其他中成药辅助治疗,并要求血压控制在125/75 mmHg(1 mmHg=0.133 kPa)以下。在获知扁桃体切除术可能是一种有效治疗后,3例受者在穿刺证实移植肾IgA肾病复发后选择立即接受手术,余8例在随后1~8个月接受扁桃体切除术。手术均在全麻下进行,1例术后发生手术部位出血,治疗后好转。扁桃体切除后患者保持口服ARB,根据尿蛋白水平的变化在随访中增减雷公藤多苷片或其他中成药。
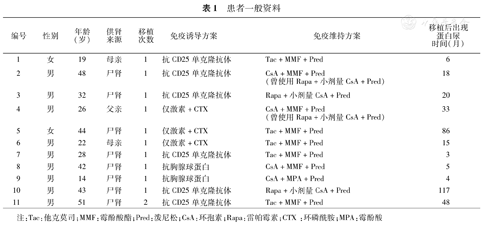
患者一般资料
患者一般资料
| 编号 | 性别 | 年龄(岁) | 供肾来源 | 移植次数 | 免疫诱导方案 | 免疫维持方案 | 移植后出现蛋白尿时间(月) |
|---|---|---|---|---|---|---|---|
| 1 | 女 | 19 | 母亲 | 1 | 抗CD25单克隆抗体 | Tac+MMF+Pred | 6 |
| 2 | 男 | 48 | 尸肾 | 1 | 抗CD25单克隆抗体 | CsA+MMF+Pred(曾使用Rapa+小剂量CsA+Pred) | 18 |
| 3 | 男 | 32 | 尸肾 | 1 | 抗CD25单克隆抗体 | Rapa+小剂量CsA+Pred | 20 |
| 4 | 男 | 26 | 父亲 | 1 | 仅激素+CTX | CsA+MMF+Pred(曾使用Rapa+小剂量CsA+Pred) | 33 |
| 5 | 女 | 44 | 尸肾 | 1 | 仅激素+CTX | Tac+MMF+Pred | 86 |
| 6 | 男 | 22 | 母亲 | 1 | 仅激素+CTX | Tac+MMF+Pred | 15 |
| 7 | 男 | 28 | 尸肾 | 1 | 抗CD25单克隆抗体 | Tac+MMF+Pred | 3 |
| 8 | 男 | 42 | 尸肾 | 1 | 抗胸腺球蛋白 | CsA+MMF+Pred | 5 |
| 9 | 男 | 14 | 尸肾 | 1 | 抗胸腺球蛋白 | CsA+MPA+Pred | 4 |
| 10 | 男 | 43 | 尸肾 | 1 | 抗CD25单克隆抗体 | Rapa+小剂量CsA+Pred | 117 |
| 11 | 男 | 51 | 尸肾 | 2 | 抗CD25单克隆抗体 | Tac+MMF+Pred | 48 |
注:Tac:他克莫司;MMF:霉酚酸酯;Pred:泼尼松;CsA:环孢素;Rapa:雷帕霉素;CTX :环磷酰胺;MPA:霉酚酸
在床边彩超定位下,采用BARD公司的自动活检枪(16#)取出肾组织1~2条后,立即将获取的肾组织分割成数段,以同时进行光学显微镜、免疫荧光和电子显微镜检查。光镜检查包括苏木精-伊红(HE)染色、过碘酸Schiff(PAS)染色及Masson染色。免疫荧光染色项目包括IgA、IgG、IgM、C3、C1q、纤维蛋白相关抗原(FRA)和白蛋白(ALB)。因IgA肾病的病理损害多样化,既有肾小球固有细胞的改变,也有基底膜、内皮细胞及肾小管间质的病变,本研究主要以IgA同时伴有C3在移植肾系膜区的沉积和系膜增生为标准,其他伴随病变可有新月体形成、肾小球局灶节段硬化、系膜区电子致密物沉积、炎症细胞浸润等[7]。
记录所有病例在扁桃体切除术前和切除术后每月的尿蛋白、尿红细胞和估算肾小球滤过率(eGFR)水平,并观察扁桃体切除前后的血清总IgA水平变化。尿蛋白以24 h尿微量总蛋白定量评估为主,部分未能行该检测的病例采用晨尿标本的尿干化学分析定性来评估。若蛋白尿无缓解或进行性加重,或患者因此而恢复血液透析治疗,则判定治疗无效。此外,观察统计该组病例扁桃体切除后的移植受者和移植肾存活率。
采用SigmaStat统计软件(3.5版)对数据进行处理,计量资料用 ±s、中位数等指标描述,计数资料用百分比和率等统计学描述。正态分布的计量资料的两组间比较采用t检验。P<0.05为差异有统计学意义。
±s、中位数等指标描述,计数资料用百分比和率等统计学描述。正态分布的计量资料的两组间比较采用t检验。P<0.05为差异有统计学意义。
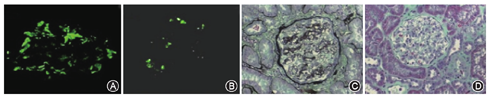
11例受者中8例在扁桃体切除后1~2个月即可见蛋白尿显著减少甚至转阴,并在之后的随访期内保持良好(表2)。中位随访14(4~38)个月,4例受者的24 h尿蛋白定量从扁桃体切除前的637~1 632 mg下降到131~290 mg;另4例未行24 h尿蛋白定量检测,但尿常规显示3例患者尿蛋白从2+分别下降到-、±和1+,1例患者的尿蛋白从1+下降到-(表2)。代表病例(编号2)在出现蛋白尿时的移植肾穿刺活检结果如图1所示,其尿微量总蛋白在扁桃体切除后2个月即从切除前的674 mg/d转为定性阴性,并在之后的每月随诊中保持阴性。最近1次随访在扁桃体切除术后27个月,复查尿微量总蛋白仅144 mg/d 。此外,8例受者的移植肾功能在扁桃体切除前后保持稳定,eGFR从切除前(75.9±7.5) ml·min-1·(1.73 m2)-1到最近1次随访的(76.5±11.6) ml·min-1·(1.73 m2)-1(P=0.547)。3例受者的扁桃体切除对缓解蛋白尿疗效不明显,具体为:(1)病例a:14岁儿童,在肾移植后4个月首次出现轻度蛋白尿(387 mg/d),口服ARB效果不佳,移植后8个月增加至2 154 mg/d。追溯病史得知自体肾穿刺活检有IgA大量沉积合并新月体形成,且病程为快速进展的急进性肾小球肾炎,对激素治疗不敏感。遂建议其立即行扁桃体切除术,但切除后1~4个月蛋白尿无好转(2 426~2 926 mg/d)。行移植肾穿刺活检结果:8个肾小球系膜细胞和基质中至重度弥漫性增生,IgA++,IgG++,C3+/++,团块状沉积于系膜区和毛细血管壁,符合IgA肾病。又先后给予激素冲击、环磷酰胺(CTX)冲击和较高浓度CsA静脉泵入2周(维持血药浓度250~300 μg/L)等措施,但均无疗效,蛋白尿持续加重至12 068 mg/d,患者于肾移植后20个月恢复血透治疗。(2)病例b:43岁,男,于肾移植术后近10年出现轻度蛋白尿(683 mg/d)伴供者特异性人类白细胞抗原(HLA)-DQ抗体阳性(最高平均免疫荧光度18 610),eGFR为45 ml·min-1·(1.73 m2)-1,适当增加CsA浓度和给予ARB+中成药治疗。4个月后蛋白尿增加至3 448 mg/d,行移植肾穿刺活检提示:局灶增生性IgA肾病(IgA++,C3+)合并轻度慢性排斥反应(C4d-)。患者犹豫4个月后接受扁桃体切除术,术后尿蛋白一度稍有降低(2 895 mg/d),但不久因浮肿明显和乏力气短恢复血透治疗。(3)病例c:51岁,男,原发病为IgA肾病,初次移植肾于术后5年慢性功能丧失。因失功前表现为进行性加重的大量蛋白尿,推测为IgA肾病复发但未经活检证实。二次肾移植术后4年再次快速出现大量蛋白尿(4 493 mg/d)伴eGFR下降,活检证实IgA肾病复发(IgA++/+++,IgM+,C3+,3/8个肾小球硬化)。患者立即接受了扁桃体切除术,但效果不佳,半年后恢复血液透析治疗。
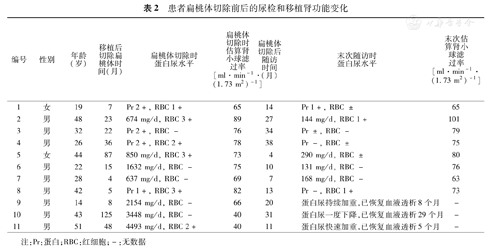
患者扁桃体切除前后的尿检和移植肾功能变化
患者扁桃体切除前后的尿检和移植肾功能变化
| 编号 | 性别 | 年龄(岁) | 移植后切除扁桃体时间(月) | 扁桃体切除时蛋白尿水平 | 扁桃体切除时估算肾小球滤过率[ml·min-1·(1.73 m2)-1] | 扁桃体切除后随访时间(月) | 末次随访时蛋白尿水平 | 末次估算肾小球滤过率[ml·min-1·(1.73 m2)-1] |
|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 19 | 7 | Pr 2+,RBC 1+ | 65 | 14 | Pr 1+,RBC ± | 65 |
| 2 | 男 | 48 | 23 | 674 mg/d, RBC 3+ | 89 | 27 | 144 mg/d, RBC 1+ | 101 |
| 3 | 男 | 32 | 22 | Pr 2+,RBC - | 76 | 34 | Pr ±,RBC - | 79 |
| 4 | 男 | 26 | 36 | Pr 2+,RBC 2+ | 78 | 38 | Pr -,RBC ± | 75 |
| 5 | 女 | 44 | 87 | 850 mg/d, RBC 3+ | 73 | 4 | 290 mg/d, RBC ± | 80 |
| 6 | 男 | 22 | 15 | 1632 mg/d, RBC - | 75 | 10 | 131 mg/d, RBC - | 76 |
| 7 | 男 | 28 | 4 | 637 mg/d, RBC - | 69 | 7 | 168 mg/d, RBC - | 63 |
| 8 | 男 | 42 | 5 | Pr 1+,RBC 3+ | 82 | 13 | Pr -,RBC 1+ | 73 |
| 9 | 男 | 14 | 8 | 2154 mg/d, RBC - | 66 | 20 | 蛋白尿持续加重,已恢复血液透析8个月 | - |
| 10 | 男 | 43 | 125 | 3448 mg/d, RBC - | 40 | 31 | 蛋白尿一度下降,已恢复血液透析29个月 | - |
| 11 | 男 | 51 | 48 | 4493 mg/d, RBC 2+ | 40 | 11 | 蛋白尿快速加重,已恢复血液透析5个月 | - |
注:Pr:蛋白;RBC:红细胞;-:无数据

扁桃体切除前11例受者血清总IgA水平为(4 011±594) mg/L,在切除后1~2周复查,血IgA水平均有不同程度降低,平均为(2 563±308) mg/L,与切除前比较,P<0.01。
11例受者在扁桃体切除术后中位随访14(4~38)个月,均无急性排斥反应或感染发生,11例受者全部存活,8例移植肾存活。
6例患者在穿刺确诊移植肾IgA肾病复发后选择了保守治疗而未接受扁桃体切除术,其中2例在确诊时已存在慢性移植肾功能不全,接受ARB、雷公藤多苷片或其他中成药辅助治疗后效果不佳,很快发展到移植肾失功而恢复血透,另外4例也接受上述辅助药物保守治疗,中位随访8(6~14)个月,3例受者的蛋白尿保持之前水平(3+、2+、2+),1例受者蛋白尿从3 300 mg/d加重至8 365 mg/d且伴明显浮肿,于随访14个月恢复血液透析治疗。
IgA肾病是指肾小球系膜区和(或)毛细血管袢单纯IgA或以IgA为主的免疫复合物沉积、伴不同程度的系膜细胞和基质增生的一组具有共同免疫病理特征的临床综合征。IgA肾病是国内原发性肾小球疾病中最常见的病理类型,也是肾移植后最常见的复发类型。移植肾IgA肾病复发的临床表现主要为蛋白尿伴或不伴镜下血尿,目前国际上通行的诊断标准为移植肾病理免疫荧光检查有以IgA为主的免疫球蛋白沉积,并且原肾亦经病理确诊为IgA肾病。治疗上主要包括增大激素用量、使用血管紧张素转化酶抑制剂或受体拮抗剂、使用雷公藤多苷片等中成药、严格控制血压、口服鱼油等,但往往效果有限而影响移植肾的长期存活[8]。Moroni等[9]观察了190例意大利患者,其IgA肾病复发率为22%,这些复发患者中29%的移植肾功能在15年随访期内因此而丧失,使总体移植肾存活率比对照组受者下降约10%。Nijim等[10]报道104例原发病为IgA肾病的移植受者,23例出现复发而显著影响到移植肾预后,52%的复发患者在移植后6年丧失了移植肾功能。
切除扁桃体对治疗原发性IgA肾病有效,但应用于治疗移植肾IgA肾病复发的报道尚不多,主要在日本作了一些尝试及报道,取得了良好的预防及治疗效果。Kennoki等[4]报道在28例确诊为IgA肾病复发的移植受者中,16例接受扁桃体切除后5年随访期内尿蛋白从平均880 mg/d下降到280 mg/d,而未切除扁桃体的12例受者尿蛋白从平均680 mg/d增加到760 mg/d。Hoshino等[11]报道5例受者切除扁桃体联合激素冲击治疗取得满意疗效。目前国内几乎还没有扁桃体切除治疗移植肾复发性IgA肾病的报道。
由于蛋白尿是影响移植肾长期存活的重要指标,同济医院器官移植研究所近3年来对肾移植术后随访期间出现逐渐加重蛋白尿的75例患者行移植肾穿刺活检,发现17例(22.7%)为IgA肾病复发,复发时间从近期到远期不等。我们对其中11例尝试采用扁桃体切除治疗,结果与日本的一些相关报道类似,其中8例取得良好疗效,具体体现在蛋白尿的迅速减轻甚至转阴,并能在随访过程中保持这种缓解状态,蛋白尿未再加重。因为肾移植受者需常规服用口服维持免疫抑制剂以预防排斥反应,故本组患者至始至终均有免疫抑制治疗,但在此基础上,患者还是在术后不同时期出现移植肾的IgA肾病。本组病例在切除扁桃体前后的免疫抑制用药未做特殊调整,即在切除扁桃体后没有额外增加其他针对IgA肾病的免疫治疗,因此蛋白尿的显著好转应该主要是扁桃体切除带来的效果。这种初步尝试表明,对亚洲人而言,扁桃体切除术是移植肾IgA肾病比较可靠有效的治疗方式,可以在未来的临床中逐步推广应用。当然值得注意的是,因为复发性IgA肾病具有慢性进展性特点,在行扁桃体切除的同时联合ARB和中成药等将有助于取得长期的保护效应。此外,扁桃体作为机体内具有区域防御保护作用的重要淋巴器官,其切除是否会导致受者感染机会增多,尚需进一步观察。
本组临床尝试虽然大部分病例获得良好效果,但仍有3例病例经扁桃体切除的效果不佳,体现在蛋白尿无明显缓解或轻度缓解后又复加重,最终移植肾均于继续随访1年内失功,患者恢复血透治疗。分析其无效的可能原因,3例各有不同:其中1例的原肾IgA肾病表现为急进性肾小球肾炎,穿刺活检表明IgA大量沉积合并新月体肾炎;另1例为二次肾移植,首次移植肾丧失功能的原因即高度怀疑为IgA肾病复发,再次肾移植后比首次更早发生IgA肾病复发;第3例于肾移植术后近10年出现进行性加重的蛋白尿,行扁桃体切除的时间为出现蛋白尿10个月后,而本组治疗有效的绝大多数病例在出现蛋白尿1~3个月的早期行扁桃体切除,因此认为本例无效的可能原因是扁桃体切除时机偏晚。综上,建议肾移植后IgA肾病复发行扁桃体切除治疗的适宜时机为出现蛋白尿的早期,在系膜增生程度还较轻微时效果较好[12]。此外,原发病为合并新月体肾炎的IgA肾病,以及再次或多次复发的IgA肾病,可能是影响治疗效果的高危因素。对于具有上述高危因素的病例,建议扁桃体切除的时机选择在肾移植前或肾移植后IgA肾病尚无复发迹象时,可能对预防或延缓移植肾IgA肾病复发有效。
在我们的确诊病例中,有6例患者确实选择了保守治疗而未接受扁桃体切除术,3例受者的蛋白尿能维持相对稳定,但未出现扁桃体切除后的显著减轻情况。另外3例均发展到移植肾失功而恢复血透。虽然作为对照组进行统计学分析例数偏少,但还是能在一定程度支持我们的初步结论,即扁桃体切除是减轻移植肾IgA肾病复发蛋白尿的有效手段。我们将在下一步深入的前瞻性研究中设计例数更多的对照组。
关于扁桃体切除治疗移植肾IgA肾病复发的机制,目前尚不清楚。扁桃体是人体内产生IgA的重要淋巴器官,切除扁桃体对治疗原发性IgA肾病有效,部分病例在摘除扁桃体后沉积在肾小球的IgA1会显著较少或消失。本组病例在扁桃体切除前后检测血中IgA水平的结果表明,扁桃体切除后循环中IgA水平显著降低,可能会减轻移植肾肾小球IgA的进一步沉积,具体机制有待进一步研究。



























