
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,59岁,因"手足变大、面容改变3年余,发现鞍区占位5个月"于2017年7月27日入院。患者自2014年起,逐渐出现手足变大、关节肥厚、口唇变厚、面容变丑,鞋号由36码增至38码,体重增加约5 kg。未予诊治。2017年2月查体时,行头部磁共振成像(MRI)提示"鞍区占位" ,后患者于2017年7月就诊于北京协和医院神经外科。自发病以来精神、食欲、睡眠好。既往高血压10余年,血压最高170/110 mmHg(1 mmHg=0.133 kPa),每日服"寿比山" 2.5 mg,血压控制在120/70 mmHg左右。患者自述家族中弟弟面容有类似改变。
体格检查:轻度肢端肥大症面容,表现为口唇略肥厚(图1);手足宽大,手指/足趾节增粗,下肢皮肤增厚。辅助检查:(2017年7月)血总皮质醇268.66 nmol/L(参考值:110.56~616.37 nmol/L),促肾上腺皮质激素(ACTH)3.44 pmol/L(参考值:0~10.13 pmol/L),催乳素0.56 nmol/L(参考值:<1.30 nmol/L),胰岛素样生长因子1(IGF-1)276 μg/L(参考值:81~225 μg/L),清晨随机血清生长激素(GH)1.3 μg/L(参考值:<2.0 μg/L),甲状腺功能正常。空腹血生化:血糖6.4 mmol/L(参考值:3.9~6.1 mmol/L),血钙2.35 mmol/L(参考值:2.13~2.70 mmol/L),血钠142 mmol/L(参考值:135~145 mmol/L),血钾3.0 mmol/L(参考值:3.5~5.5 mmol/L)。垂体增强MRI示垂体左翼后下部占位,大小约6.0 mm×3.5 mm,考虑为垂体微腺瘤(图2)。口服75 g葡萄糖GH抑制试验:GH基础值为2.1 μg/L,谷值为0.7 μg/L。
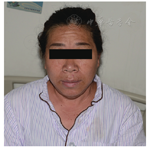

注:患者皮肤增厚、额纹明显、口唇肥厚
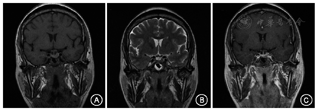

注:A. T1WI;B. T2WI;C.增强MRI;垂体左翼上缘膨隆,下缘倾斜,垂体平扫信号均匀,呈等T1等T2信号;增强MRI显示垂体偏左翼后下部一不规则强化减低区;视交叉未见受压上移征象,双侧海绵窦未见明显异常
因患者清晨空腹随机GH正常,服糖后GH可被抑制至1 μg/L以下,且存在低钾血症,进一步进行除外肥大性骨关节病(HOA)的检查:胫腓骨正侧位(双侧)提示双侧胫腓骨皮质稍增厚,双侧膝关节骨质增生;双手放大X线片示双手多发近节指骨骨膜反应可能,双腕头状骨多发囊变(图3);停用寿比山后血钾恢复正常;甲状旁腺素(PTH)、游离钙、降钙素、24 h尿电解质、血尿蛋白电泳、抗核抗体谱、癌胚抗原等肿瘤指标均未见异常,胸部和肾上腺CT未见占位。结合患者临床表现和检查结果,考虑不除外轻型垂体GH腺瘤可能。经过多科讨论,2017年8月4日患者在全麻下行神经内镜经鼻蝶窦入路垂体探查及鞍底重建术。术中见肿瘤主要位于鞍内靠下靠后,质地软,为灰白色,血运不丰富,大小约7 mm×6 mm×5 mm,术后第2天清晨空腹随机GH降至0.8 μg/L,IGF-1降至142 μg/L,较术前明显下降。葡萄糖GH抑制试验:GH基础值为0.8 μg/L,谷值为0.4 μg/L。病理回报:垂体腺瘤。免疫组化结果:GH(+),黄体生成素(LH)(-),卵泡刺激素(FSH)(+),ACTH(-),催乳素(-),促甲状腺激素(-),P53(-),Ki-67指数:4%(图4)。
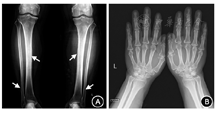

注:A.患者胫腓骨正侧位(双侧):双侧胫腓骨皮质稍增厚,双侧膝关节骨质增生(↑);B.患者双手放大相:双手软组织增厚,多发近节指骨可见骨膜反应,双腕头状骨多发囊变区
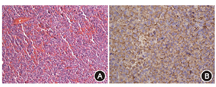

注:A. HE ×200;B. GH免疫组化(+) ×300
本例患者中年女性,隐匿起病,慢性病程。患者以全身多处软组织增大增厚等表现起病,查体见口唇肥厚、手足增宽,MRI检查发现垂体微腺瘤可能。结合病史和影像学特点,考虑垂体GH腺瘤可能性大。激素检查虽然发现IGF-1升高,但清晨随机血清GH在正常参考范围,且葡萄糖GH抑制试验中GH可被抑制到1 μg/L以下,所以生化激素检测不支持垂体GH腺瘤。考虑到患者家族中弟弟面容有可疑类似改变。因此需要考虑HOA可能。
轻型垂体GH腺瘤患者就诊时可仅表现为轻度肢端肥大症面容及血清IGF-1水平升高,而随机清晨血清GH水平及葡萄糖GH抑制试验结果正常。
轻型垂体GH腺瘤与HOA在临床表现、管状骨影像学表现及实验室化验指标方面均可有重叠,容易误诊,临床需要注意鉴别。
对于存在垂体GH腺瘤的临床表现、血清IGF-1水平升高的患者,不可依据葡萄糖GH抑制试验结果正常而轻易做出排除诊断。
对于可疑轻型垂体GH腺瘤患者,杵状指是一个重要的鉴别体征,应考虑HOA的可能并进行详细鉴别。
HOA的骨骼改变多累及长骨,而垂体GH腺瘤患者除了长骨以外,头颅骨影像学检查也同样存在骨质增厚等表现,有利于与HOA进行鉴别诊断。
垂体GH腺瘤分泌过多GH会导致软组织、骨和软骨的异常增生,在成人表现为肢端肥大症,其发病率为40~70/106[1]。国内外多篇关于垂体GH腺瘤的临床指南[2,3]均指出该病的诊断需要综合分析患者的临床表现、实验室检测以及影像学检查结果,主要包括:(1)临床表现:面容丑陋、鼻大唇厚、手足增大、皮肤增厚、多汗、皮脂腺分泌过多等;(2)实验室检查:随机清晨血清GH升高、血清IGF-1高于与年龄和性别相匹配的正常参考值范围,以及葡萄糖GH抑制试验中GH无法被抑制至<1 μg/L;(3)影像学检查:提示垂体腺瘤。
本例患者存在支持垂体GH腺瘤的症状和体征,影像学也提示垂体微腺瘤,但激素检测却不完全支持,仅有IGF-1水平升高。既往将IGF-1检测用于临床之前,葡萄糖GH抑制试验一直被作为垂体GH腺瘤诊断的金标准[4,5],但是到目前为止,已有多篇关于葡萄糖GH抑制试验阴性的垂体GH腺瘤的报道[4,5,6]。Dimaraki等[6]发现,在16例日平均血清GH水平正常,而IGF-1水平升高的垂体GH腺瘤患者中,有8例患者在葡萄糖GH抑制试验中GH谷值<1 μg/L。Ribeiro-Oliveira等[4]发现,随机清晨血清GH水平>4.3 μg/L的患者在葡萄糖GH抑制试验中GH谷值均>1 μg/L,而在随机清晨血清GH水平<4.3 μg/L的患者中有52%(13/25)的患者GH谷值<1 μg/L,甚至还有28%(7/25)的患者GH谷值<0.4 μg/L。而本例患者随机清晨血清GH水平为1.3 μg/L,其葡萄糖GH抑制试验GH谷值也<1 μg/L,与上述报道符合。
HOA按照病因不同分为原发性和继发性两类,原发性HOA又称厚皮性骨膜增生症,是一种罕见的遗传性疾病,多为常染色体隐性遗传病,也有常染色体显性遗传的报道。目前已知的病因分为HPGD基因(编码15羟基前列腺素脱氢酶)突变和SLCO2A1基因(编码前列腺素转运蛋白)突变[7]。发病年龄主要为出生后1年及青春期,男女比例约为7∶1。而继发性HOA则常继发于肺癌、肺部感染、囊性纤维化以及心脏右向左分流,与非小细胞肺癌关系最为密切,可以是副肿瘤综合征的表现之一。HOA的临床表现主要包括杵状指、额纹增厚和滑膜积液[8,9,10],部分患者可因升高的前列腺素E2作用于肾小管导致排钾增多而合并低钾血症。本例患者为中年起病,弟弟有可疑类似面容改变,但无动态进展,患者查体未发现杵状指及滑膜积液表现,进一步行影像学检查也未发现可导致继发性HOA的疾病。HOA的X线特点主要为多发性对称性管状骨骨膜增生和骨赘形成,可表现为花边状、层状、线状、簇状等[8,11]。垂体GH腺瘤在长骨X线片表现为四肢长骨粗厚增大、皮质增厚、小梁增粗[12],与HOA长骨表现比较接近,无法靠骨骼系统影像学表现将两者区分,但垂体GH腺瘤患者的骨质增厚在颅面骨尤其是下颌骨的表现更为突出。本例患者经过经蝶垂体手术治疗后随机清晨血清GH下降,IGF-1降至正常范围,病理也支持垂体GH腺瘤,从整个诊治经过来看可除外HOA。
对于垂体GH腺瘤的诊断,长久以来许多指南和专家共识建议将葡萄糖GH抑制试验中血清GH谷值水平>1 μg/L作为重要诊断标准之一[2]。随着检验技术的发展,也有学者认为应该将葡萄糖GH抑制试验中GH谷值的切点改为0.4 μg/L,Subbarayan等[5]认为即便是对于那些在葡萄糖GH抑制试验中血清GH谷值<0.4 μg/L的患者,血清IGF-1水平升高结合患者的相关临床表现也可以作为诊断肢端肥大症的依据。Dimaraki等[6]也同样认为传统的基于GH的垂体GH腺瘤诊断标准不能用于排除诊断。
鉴于垂体GH腺瘤与HOA的治疗方案全然不同,认识到部分轻型垂体GH腺瘤患者在葡萄糖GH抑制试验中血清GH谷值水平可以被抑制至1 μg/L以下对于临床工作者至关重要。对于存在可疑垂体GH腺瘤临床表现和(或)血清IGF-1水平升高的患者,切不可因葡萄糖GH抑制试验结果正常而轻易排除垂体GH腺瘤的可能。根据本例报道和文献所见,对于轻型垂体GH腺瘤患者,尤其是葡萄糖GH抑制试验可被抑制的患者,在除外HOA后,血清IGF-1水平升高更敏感可靠。


























