
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
可逆性胼胝体压部病变综合征(reversible splenial lesion syndrome,RESLES)是一种由各种原因导致的主要累及胼胝体压部的临床影像综合征。2011年由Garcia-Monco等[1]首先提出,以MRI表现为至少累及胼胝体压部的可逆性的短暂弥散受限病灶,伴随有轻度的可逆的临床症状为特点,病程具有自限性,预后良好。我们通过对就诊于郑州大学人民医院的4例成人RESLES患者进行回顾性分析,总结其临床特点,提高临床医师认识。
收集2016年8月至2017年3月在郑州大学人民医院就诊的符合Garcia-Monco诊断标准[1]的成人(≥14岁)可逆性胼胝体压部病变综合征患者4例。均行MRI检查及复查。1例可疑病例因未复查MRI而被排除。
对4例患者的病史、实验室检查、影像学表现、治疗及随访资料进行综合性分析。(1)病史包括:一般情况、既往史、主要临床表现。(2)实验室检查包括:血常规、肝功、肾功电解质、心肌酶谱、血糖、甲状腺功能及相关抗体、风湿三项、免疫全套、结缔组织病相关抗体、感染四项、病毒抗体系列,脑脊液常规、生化、寡克隆,脑炎六项(抗NMDAR抗体)等。(3)头颅MRI平扫及MRA检查,1例患者行MRI增强扫描。(4)其他:1例患者行肌电图和神经传导速度、眼底照相检查。3例患者行血清AQP4检查。
4例患者中男3例,女1例,发病年龄20~55岁,平均36岁。既往类风湿性关节炎1例,肠穿孔修补术1例,轻微脑外伤1例,饮酒史1例。3例患者急性起病,1例亚急性起病。例1病因为脑外伤,临床表现为头痛、短暂性意识丧失。例2病因为类风湿性关节炎,临床表现为视物模糊,认知功能减退、四肢远端感觉异常。例3病因为尿路感染、贫血,临床表现为发热、头痛、视物模糊、晕厥、肾区疼痛。例4病因不明,临床表现为频繁、短暂发作性双眼视物模糊,每次持续约10 s,2 h发作10次。
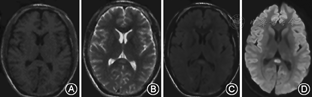
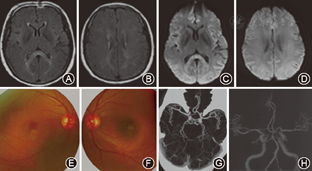
4例患者分别于发病后第1、第15、第1、第3天行MRI检查。3例MRI表现为胼胝体压部中心区孤立的类圆形病变,病变在T1WI上呈等或低信号,T2WI上呈高或稍高信号,FLAIR及DWI为高信号(图1)。1例表现为整个胼胝体压部弧形病变,同时累及双侧半卵圆中心、侧脑室旁及皮质下白质,病变在T1WI呈等信号,T2WI、FLAIR呈高信号,DWI仅可见胼胝体压部弧形高信号(图2)。


例1压力150 mmH2O(1 mmH2O=0.009 8 kPa),白细胞14×106/L,生化正常;例2压力90 mmH2O,白细胞2×106/L,生化正常;例3压力190 mmH2O,白细胞1×106/L,生化正常;例4压力110 mmH2O,白细胞18×106/L,蛋白1.23 g/L,糖、氯化物正常。细菌涂片及培养均正常。寡克隆均为阴性。
例1抗核抗体(ANA)1:100核颗粒型;ANA-2 1:100中心粒型;免疫全套IgM 0.38 g/L(0.4~2.36 g/L)。例2抗环瓜氨酸肽抗体30 kU/L(0~25 kU/L);类风湿因子(IF) 33.3 kU/L;肌电图示:多发性周围神经损害、感觉神经损害为主、双侧视通路传导异常;眼底照相正常。例3实验室检查结果均正常。例4血常规示:白细胞增高(12.19×109/L),贫血(红细胞4.0×1012/L,血红蛋白129 g/L,血小板72×109/L);总蛋白58.5 g/L(65~85 g/L),白蛋白29.9 g/L(40~55 g/L);肾功能不全[尿素24 mmol/L(2.5~7.1 mmol/L),肌酐263 μmol/L(44~104 μmol/L),尿酸536 μmol/L(155~428 μmol/L),尿蛋白(++)];甲状腺功能减低(T3 1.44 nmol/L,T4 0.66 nmol/L, FT3 1.81 pmol/L,FT4 8.17 pmol/L,TSH3UL 0.327 mU/L)。3例患者血清AQP4均为阴性。
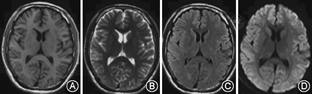
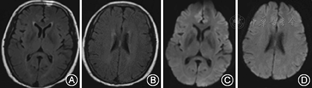
例1、例3均未给予特殊治疗;例1给予80 mg/d甲泼尼龙冲击治疗1周;例4给予抗感染、改善肾功能、纠正贫血治疗;患者临床症状均在1~2周内明显改善。分别于发病后32、7、5、8 d后复查头颅MRI,例1、2、4病灶完全消失(图3,图4)。例3胼胝体压部病变范围减小且异常信号强度减弱。


RESLES的概念在2011年由Garcia-Monco等[1]首先提出,是一种少见的临床影像综合征。其病因复杂,包括癫痫及抗癫痫药撤药、感染、代谢障碍(低血糖、高钠血症等)、高原性脑水肿、抗肿瘤药物等,也可偶然发现于一些看起来与本病无关的疾病,如贫血、外伤[2]、川崎病[3]等。临床表现缺乏特异性,多表现为轻度脑炎或脑病的症状:头痛、意识障碍、癫痫、精神行为异常等,视觉障碍也有报道[1,4]。本研究4例患者病因各异,其中1例为类风湿性关节炎(RF),既往罕见报道,但有其他系统性自身免疫性疾病如系统性红斑狼疮、桥本脑病出现RESLES的相关报道[5,6],推测其可能的致病机制为自身免疫性疾病相关的血管炎导致的短暂性局部缺血或者炎症因子导致的血管源性水肿。3例患者出现视觉症状,由于胼胝体压部纤维在视觉词形信息的加工和传递中起作用,其可能与胼胝体压部病变相关[4]。
MRI显示胼胝体压部的孤立性异常信号和病灶的可逆性消失是本病主要的诊断依据。Takanashi等[7,8]根据MRI特点将MRES其分为Ⅰ型和Ⅱ型,即病灶局限于胼胝体压部的Ⅰ型和同时累及深部白质或皮质下白质的Ⅱ。本组3例患者MRI表现为胼胝体压部的孤立的类圆形病变,符合MRES分型Ⅰ型;1例表现为整个胼胝体压部受累的弧形病变,类似于"回旋镖征"[9],同时累及胼胝体外,符合Ⅱ型。Takanashi等[7]发现MRES Ⅱ型可向Ⅰ型转变,胼胝体外的异常信号可先于胼胝体压部的异常信号消失。本组1例患者MRI上DWI仅见胼胝体压部异常信号,而T2WI、FLAIR显示胼胝体及胼胝体外异常信号,推测这种不匹配的其可能的原因是患者行MRI检查是处于Ⅱ型向Ⅰ型转换的中间阶段,胼胝体外病变正逐渐消失,DWI较T2WI及FLAIR能够更敏感的显示这种改变。本研究Ⅰ型和Ⅱ型患者的临床症状及预后方面无差异,与Takanashi等[8]的报道一致。也有研究发现,胼胝体外病变的出现可能提示预后不良[10]。本组4例患者MRI病变在首次行MRI检查后4~17 d消失,患者临床症状的完全恢复晚于MRI病灶的消失。
RESLES的机制目前仍不清楚,其MRI表现为短暂的可逆性的DWI高信号,伴ADC减低,提示其可能的病理生理机制为髓鞘层的分离导致的髓鞘内或髓鞘间水肿,目前存在如下假说:(1)癫痫、脑炎等各种原因导致胶质细胞或神经鞘中兴奋性神经递质谷氨酸的释放增多或再摄取减少,细胞外谷氨酸浓度升高,与非NMDA受体结合介导钠离子进入细胞内从而引起髓鞘内水肿;(2)炎症细胞或炎性因子的浸润[11];(3)能量代谢障碍离子泵衰竭,导致钠水潴留,引起细胞毒性水肿;(4)遗传[12];(5)自身免疫系统的激活[13]。病变主要累及SCC的可能原因为:(1)与周围组织相比,胼胝体压部的髓鞘水含量较多,但其调节水电解质失衡的自身保护机制不足[3];(2)病毒的抗原或受体诱导产生的抗体对胼胝体压部轴突或髓鞘的受体具有特异的亲和性,从而导致炎症浸润[8]。
RESLES需与其他累及胼胝体压部的病变相鉴别,包括:急性播散性脑脊髓炎、多发性硬化、可逆性后部脑病综合征、肾上腺脑白质营养不良、胼胝体卒中、海洛因中毒性脑病、中枢神经系统淋巴瘤、胼胝体变性、抗NMDAR脑炎等。
综上所述,成人RESLES病因谱更广,脑炎或脑病的临床症状可不明显,MRI主要表现为胼胝体压部孤立的类圆形病变,也可伴有胼胝体外异常信号,病变具有可逆性。本病预后较好,临床及影像均可完全恢复,更好地认识本病可以避免误诊及过度治疗,有助于患者早期康复。


























