
探讨核仁纺锤体相关蛋白(NUSAP1)表达与人脑多形性胶质母细胞瘤(GBM)恶性进展及临床预后间的相关性。
以RT-PCR和免疫组化技术分析NUSAP1在GBM手术标本的表达水平。在TCGA数据库中分析该基因表达与GBM患者分子分型、生存期的相关性。采用基因沉默技术封闭该基因在U87细胞表达,CCK-8实验检测细胞增殖,流式细胞术检测细胞周期变化,并行体内致瘤试验。
与非肿瘤对照脑组织标本相比,NUSAP1在GBM表达明显上调,生存曲线分析显示,NUSAP1高表达者生存期显著降低(P<0.01),间质型和神经元型GBM NUSAP1表达相对低于其他两型,且显著受PTEN缺失和IDH1突变等特定基因畸变状态影响。敲除NUSAP1可抑制GBM肿瘤细胞周期G2/M进展和细胞增殖。
NUSAP1表达与GBM进展和预后密切相关,是一个反映GBM预后的生物标志物,并具有潜在应用价值的治疗靶标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经胶质瘤约占原发中枢神经系统(CNS)肿瘤的30%,在CNS恶性肿瘤中约占80%[1],其中多形性胶质母细胞瘤(GBM)是较为常见且恶性度最高的肿瘤类型,目前仍无根治的有效疗法[2]。因此,研究预后和潜在的生物标志物作为临床治疗靶标仍极为必要。核仁纺锤体相关蛋白1(NUSAP1)是一个微管DNA结合蛋白,其生物学功能为稳定微管,特异表达于细胞增殖期,在细胞周期进展和细胞分裂过程中必不可少[3,4,5]。NUSAP1与恶性肿瘤的相关性已有多篇报道,在一些恶性肿瘤,如乳腺癌[6]、肝细胞癌[7]及胰腺癌[8]等过度表达。而NUSAP1与GBM恶性进展及患者临床特征之间潜在的相关性仍未知。本研究通过对NUSAP1在GBM组织和非肿瘤对照脑组织标本的表达状况分析,对NUSAP1表达与GBM预后的预测价值进行了初步探索。
人神经胶质瘤细胞株U87,U251,SNB19,N229,U373L分别培养在含10%胎牛血清(FBS)的DMEM细胞培养液中。Balb/c无胸腺裸小鼠饲养在苏州大学实验动物中心,根据无特定病原菌(SPF)级水平管理,相关动物实验通过苏州大学动物管理委员会审核和批准。
研究用组织标本通过苏州大学第二附属医院临床伦理委员会批准。23例GBM临床标本和23例非肿瘤脑组织标本(源于临床非肿瘤患者手术减压标本)均获得知情同意,手术标本冻存于液氮。NUSAP1基因在GBM患者表达数据及相关临床信息由美国癌症基因组图谱(TCGA)数据库获得。
胶质瘤细胞系U87分别转染含NUSAP1基因的慢病毒载体或不含NUSAP1基因的对照载体(shMock)。转染后,以2 ng/ml嘌呤霉素条件培养基筛选稳定转染的细胞株。2~3周后获得稳定转染NUSAP1基因的U87细胞(U87-shNUSAP1)和转染不含NUSAP1基因的对照载体的U87细胞(U87-shMock),表达稳定的细胞克隆进一步由免疫印迹法验证。
以1%胰蛋白酶消化对数生长期的瘤细胞成单个细胞,然后1 000 r/min离心5 min,PBS洗2次,离心收集细胞,固定于4%乙醇过夜,然后以4 ℃预冷的磷酸缓冲盐溶液(PBS)洗2次。再于37 ℃核糖核酸酶处理30 min,4 ℃孵育30 min后于流式细胞仪测定细胞周期。
细胞总RNA提取按试剂盒说明书操作,然后行半定量RT-PCR和DNA定量RT-PCR(qRT-PCR)分析。引物序列如下:NUSAP1 5′TCATTTCCTTTTCTTGCCTCA 3′和5′AGGAGCTGGACTCCCTCAAG3′。反应体积为10 μl,反应条件:初始变性95 ℃5 min,然后95 ℃变性15 s,60 ℃延伸45 s,共40个循环。解链曲线评估每个样本的特异性扩增,且每个样本均重复3次。GAPDH作为内参,2-ΔΔCt法[9]相对量化PCR产物的表达量。
以比色细胞计数法(CCK-8)评估细胞增殖。细胞以1 000细胞/100 μl接种于96孔板,培养4 d后每孔添加10 μl CCK-8试剂,孵育2 h,在波长480 nm处测定样品吸光度(A)值。独立进行实验3次,每个样品重复测定3次。
在美国癌症基因组图谱(TCGA)公共数据库中的GBM队列(n=528)[10],分析NUSAP1的表达数据和患者临床信息来验证NUSAP1的差异表达及其预后价值。通过该数据库数据,还可分析GBM常见基因的变异和分子亚型数据,可用于分析NUSAP1的表达及其与这些分子变异之间的相关性。
源于患者肿瘤标本的组织切片先在室温下以3%过氧化氢作用15 min去除内源性过氧化物酶。PBS清洗5 min后在4 ℃滴加含有5%山羊血清PBS封闭30 min,按1∶150滴加抗NUSAP1抗体(Abcam),反应30 min后PBS洗涤,加入HRP偶联的二级抗体(1∶500)37 ℃下作用1 h。PBS洗涤后,苏木精复染色,梯度乙醇脱水。显微镜下拍照,免疫复合物灰度值的测定分析使用Image-Pro+6.0软件。
先提取总蛋白,细胞标本以细胞裂解液RIPA[含50 mmol/L Tris-HCl pH值7.4,150 mmol/L氯化钠,1.0%乙基苯基聚乙二醇-40, 0.1%钠十二烷基硫酸盐(SDS)]裂解,然后4 ℃离心12 000 r/min,15 min。吸取上清液进行后续分析,并测定蛋白质浓度。取50~100 μg样品行SDS-PAGE胶电泳,然后转移至PVDF膜上,浸入含5%牛血清白蛋白缓冲液中,同时加入一抗(anti-NUSAP1 1∶1 000和anti-GAPDH 1∶1 000),孵育过夜,然后用Tris缓冲液洗涤,在室温下加入二抗(1∶5 000)孵育1 h,应用化学发光成像系统(G:BOXChemi XRQ,Syngene,英国)记录信号信息。
2×106转染NUSAP1基因的U87-shNUSAP1细胞或转染空载体的U87-shMock细胞分别接种于雄性Balb/c无胸腺裸小鼠右腋皮下,每组6只实验鼠,每周3次使用游标卡尺测量皮下移植瘤长度(l)和宽度(w),然后以公式(V =lw2/2)计算肿瘤体积。实验结束后解剖皮下肿瘤,测量瘤径并称重。
应用SPSS 20.0版和GraphPad Prism 6.0版软件进行相关实验数据分析,t检验评估表达差异,临床及病理学资料通过χ2检验进行比较,Kaplan-Meier生存曲线与生存率Cox回归分析用于评估不同NUSAP1表达水平患者的总生存期(OS)和其他临床特征,以P<0.05为差异有统计学意义。
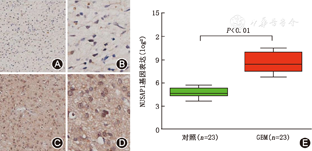
免疫组化染色结果显示,NUSAP1基因表达于细胞核内(图1A,图1B),在GBM中(图1C,图1D)表达较非肿瘤对照脑组织(图1A,图1B)增高。从23例原发GBM和23例对照组提取总RNA进行RT-PCR分析,与对照组相比,GBM组的NUSAP1的mRNA表达显著升高(图1E)。

利用TCGA中GBM队列相关数据研究NUSAP1表达与患者临床结果间的关系,结果表明,NUSAP1高表达者的总生存期显著低于低表达者(P<0.01;图2A)。
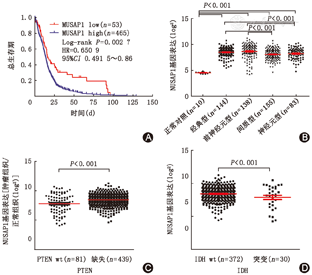

在TCGA GBM队列中实施NUSAP1表达和临床意义评估。结果显示,NUSAP1的mRNA的表达高出非肿瘤对照组约90%。在GBM4个不同的亚型,即间质型、经典型、神经元型和前神经元型[11]进一步分析NUSAP1的表达,发现NUSAP1表达在间质型和神经型中低于其他亚型,但仍明显高于对照组(图2B)。根据ROC曲线数值,528例GBM患者可分为NUSAP1高表达和低表达两组,两组之间年龄和性别差异无统计学意义,而NUSAP1的表达与肿瘤的起源相关(表1)。通过对TCGA数据库中GBM的分析,发现一些基因显著突变或有明显的拷贝数改变(CNA)。进一步分析GBM相关基因改变与NUSAP1表达间的关联性,发现NUSAP1高表达与野生型IDH1和PTEN缺失正相关(图2C,图2D)。
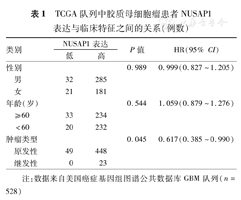
TCGA队列中胶质母细胞瘤患者NUSAP1表达与临床特征之间的关系(例数)
TCGA队列中胶质母细胞瘤患者NUSAP1表达与临床特征之间的关系(例数)
| 类别 | NUSAP1表达 | P值 | HR(95% CI) | ||
|---|---|---|---|---|---|
| 低 | 高 | ||||
| 性别 | 0.989 | 0.999(0.827~1.205) | |||
| 男 | 32 | 285 | |||
| 女 | 21 | 181 | |||
| 年龄(岁) | 0.544 | 1.059(0.879~1.276) | |||
| ≥60 | 33 | 234 | |||
| <60 | 20 | 232 | |||
| 肿瘤类型 | 0.045 | 0.617(0.385~0.990) | |||
| 原发性 | 49 | 448 | |||
| 继发性 | 0 | 23 | |||
注:数据来自美国癌症基因组图谱公共数据库GBM队列(n=528)
首先检测了NUSAP1基因在5株胶质瘤细胞系(U373L、N229、U251、U87、SNB19)的表达情况,qRT-PCR结果显示,NUSAP1在U87细胞表达水平最高(图3A)。通过RNAi技术敲低U87细胞中NUSAP1,并以免疫印迹法筛选出稳转株用于后续实验(图3B)。为了研究NUSAP1对GBM肿瘤细胞增殖能力的影响,在稳定沉默NUSAP1表达的U87细胞,和空白载体转染(shMock)的U87细胞等两组细胞中,观察NUSAP1对神经胶质瘤细胞体外增殖的影响。CCK-8试验测定细胞5 d内的增殖状况。结果表明,沉默NUSAP1表达后U87细胞的增殖与对照组相比显著减少(图3C),提示NUSAP1表达水平与胶质瘤细胞体外增殖正相关。
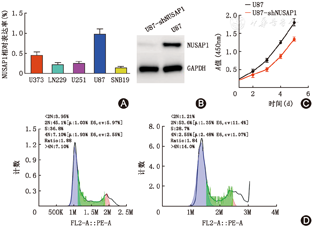

在NUSAP1影响胶质瘤细胞增殖的机制研究中首先观察了该基因表达与细胞周期的关系。流式细胞术检测结果表明,NUSAP1基因干扰沉默后的U87细胞中G2/M期细胞百分比显著低于对照组(图3D),即仅有2.55% U87-shNUSAP1细胞处于G2/M期,远低于对照组U87细胞在G2/M期的比例(21.5%),提示阻断NUSAP1表达可促使胶质瘤细胞的细胞周期停滞于G2/M期,进而抑制肿瘤细胞增殖。
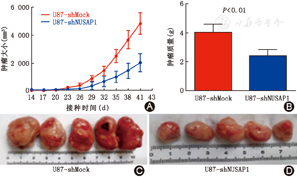
应用皮下异种移植瘤裸小鼠模型评估NUSAP1对胶质瘤体内增殖的影响。2×106个稳定沉默NUSAP1的U87细胞及等量对照U87细胞分别接种于4周龄Balb/c鼠的右腋皮下。动物实验结果表明,NUSAP1干扰组皮下肿瘤生长较对照组为慢,皮下肿瘤体积明显小于对照组(P<0.01),提示,阻断NUSAP1表达可以在一定程度上抑制胶质瘤细胞体内增长(图4)。

GBM是恶性程度最高的原发脑肿瘤,发病的分子机制远未阐明。分子靶向治疗是较有前途治愈该恶性疾病的治疗手段,但现有的治疗靶目标仍远不能满足临床需求。因此,需积极探寻更有价值的预后生物学标志物及潜在的治疗分子靶标。
作为细胞周期相关蛋白,NUSAP1在细胞有丝分裂中起着至关重要的作用,该基因表达异常可导致细胞有丝分裂期纺锤体的异常。在许多恶性肿瘤中NUSAP1表达普遍上调且与不良预后相关。文献报道NUSAP1基因可能与乳腺癌的发生和进展相关[12]。NUSAP1在GBM的表达状况及生物学意义尚未见报道。本结果显示,该基因表达在GBM中显著上调。生存曲线分析显示,高表达NUSAP1的患者整体生存率明显低于低表达NUSAP1者,提示NUSAP1可作为GBM患者生存期的一个预测指标。此外,NUSAP1表达水平与GBM瘤细胞增殖及细胞周期进展正相关。
不同分子亚型的GBM预后由较好至差依次为前神经元型、神经元型、间质型、经典型[13]。本研究发现在TCGA有关GBM 4种不同分子亚型,即间质型、经典型、神经元型和前神经元型中,均存在NUSAP1高表达,其中前神经元型和经典型2型的表达高于其他两型。与文献中报道经典型预后最差相符,但前神经元型虽相对高表达NUSAP1,但其预后优于其他3型,提示存在其他预后相关的基因参与,共同影响此型患者的预后。前神经元型因存在IDH1突变[14],预后相对优于其他3型,本研究亦发现无IDH1突变的野生型IDH1与NUSAP1高度表达相关,共同发生于无IDH1突变的经典型、间质型和神经型GBM中,预后较差。根据文献报道,PTEN缺失可发生于前神经元型、间质型、经典型等3种GBM分子亚型中,本研究发现,PTEN缺失与NUSAP1高表达相关联,符合经典型、间质型2型生存期预后相对差的临床特点。但前神经元型虽可有PTEN缺失和NUSAP1高表达,但其预后仍优于其他3型,提示存在其他预后相关的基因参与,共同影响此型患者的预后。
文献报道,在几个恶性肿瘤细胞系包括前列腺癌细胞,NUSAP1可促进肿瘤细胞增殖[15]。应予注意的是,上述研究结果是以建系的细胞株为研究对象而获取的,且同类肿瘤内的异质性和不同肿瘤间存在的遗传背景差异,这些因素决定了某一基因的功能在不同的时空背景下有所不同[16]。NUSAP1基因在胶质瘤进展中所发挥的功能及相关机制未见文献报道。本结果提示,抑制该基因表达无论在体外或体内均能显著抑制胶质瘤细胞生长,具体表现为细胞增殖受抑制,细胞周期停滞于G2/M期。而表达NUSAP1后可促进胶质瘤细胞的细胞周期进展,从而发挥促进瘤细胞增殖的作用。这些结果提示,下调NUSAP1的表达有可能达到抑制胶质瘤细胞增殖活跃的目的。临床数据显示,NUSAP1高表达与生存期短相关,提示NUSAP1可作为胶质瘤治疗的潜在靶点。



























