
探讨经皮肾镜取石术中预先留置双J管的临床效果及可行性。
回顾性分析了2014年6月至2017年2月浙江大学医学院附属第二医院74例接受经皮肾镜碎石取石术(PCNL)手术的肾结石患者的临床资料。74例患者中男54例,女20例,年龄27~78(49.5±12.3)岁。结石直径20~59 (29.4±4.3) mm。手术方法为先截石位通过经尿道输尿管镜下患侧输尿管预先留置Fr6双J管,随后留置三腔Foley导尿管并夹闭引流腔,袋装3 000 ml生理盐水(高度60~80 cm)连接冲洗腔。改俯卧位后经冲洗腔灌注生理盐水,产生人工肾积水后由B超引导下建立经皮肾穿刺通道Fr20,并行一期钬激光碎石取石术。
所有患者均成功完成经皮肾穿刺并建立Fr20通道,通道建立时间(8.0±2.0) min,手术时间(79±46) min,血红蛋白下降值(17.0±4.0) g/L,血肌酐上升(3.1±1.1) μmol/L,结石取尽率81.1%,并发症发生率8.1%(1例损伤胸膜并发气胸,1例术后形成动静脉瘘大出血,4例术后高热)。
经皮肾镜取石术中预先留置双J管是一种安全、可行的方法,有利于经皮肾通道的穿刺和建立,且可避免顺行留置双J的盲目性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经皮肾镜取石术(PCNL)是治疗复杂性肾结石的首选方法[1]。手术的操作已逐渐形成一定的标准化流程。但是,经留置输尿管导管注水制造人工肾积水时产生的微气泡对B超引导下穿刺会产生干扰,有时在操作时会遇到诸如结束时留置双J管困难或位置不准确等问题[2]。本研究我们设计了一种通过改变手术步骤以达到优化手术流程效果的方法。现将结果报道如下。
1.本研究的入选标准为:结石直径≥2 cm的肾盂或肾盏单发或多发结石,或有开放手术史及体外震波碎石效果不佳的肾结石患者;排除标准为:泌尿道感染未控制,合并肾结核、严重心肺功能不全无法耐受手术,严重凝血功能障碍者。
2.本研究共纳入肾结石患者74例,男54例,女20例,其中有肾开放取石手术史患者4例,曾接受2~3次体外震波碎石术患者3例,年龄27~78(49.5±12.3)岁。术前均行泌尿系CT检查,以了解结石的大小、位置情况,结石直径以最大径计算,结石直径20~59(29.4±4.3)mm。术前尿常规及中段尿培养提示有尿路感染者9例,均预防性静脉使用敏感抗生素。本研究经医院伦理委员会讨论通过,患者术前均签署知情同意书。
全身麻醉后,患者取截石位,经尿道输尿管镜下患侧逆行置入Fr6双J管,随后留置三腔Foley导尿管并夹闭引流腔,3 000 ml袋装生理盐水(高度约60~80 cm)连接冲洗腔。患者改取俯卧位后,经冲洗腔灌注生理盐水,水流由膀胱经双J管逆流入患侧肾盂。患侧肾产生人工积水后,予以穿刺针由B超引导下穿刺入后组肾盏,在斑马导丝引导下予以筋膜扩张器由Fr6顺序扩张至Fr20,以Fr8/9.8输尿管镜行钬激光碎石取石术,术中摄片检查结石清除情况及双J管的位置。术后留置Fr18肾盂造瘘管并停止灌注同时开放导尿管。
记录每例患者通道建立时间、手术时间(含逆行置管时间)、血红蛋白下降数值、术前后血肌酐的变化;术后3~5 d复查肾-输尿管-膀胱X线片或泌尿系CT,观察是否有结石残留(直径>5 mm的残留结石被认为结石未取净)[3];并同时记录并发症的发生及治疗情况。
应用SPSS 20.0统计软件处理数据,符合正态分布的连续变量资料以 ±s形式表示均数,并采用t检验,P<0.05为差异有统计学意义。
±s形式表示均数,并采用t检验,P<0.05为差异有统计学意义。
所有患者均成功完成经皮肾穿刺并建立Fr20通道,通道建立时间(8.0±2.0) min,手术时间(79±46)min;术前、术后平均血红蛋白分别为(125.8±5.2)g/L及(109.7±6.1)g/L,血红蛋白下降值(17.0±4.0)g/L,差异有统计学意义(P<0.05);术前、后血肌酐分别为(95.2±2.3)μmol/L及(99.1±3.7)μmol/L,上升(3.1±1.1)μmol/L,差异无统计学意义(P<0.05)(表1)。并发症发生率为8.1%,其中1例拔除肾造瘘管后出现气胸,经胸腔闭式引流后治愈;1例术后形成动静瘘大出血,经高选择性肾动脉栓塞治疗好转;4例患者出现高热(体温>39 ℃),经抗感染治疗后缓解,未发生感染性休克。60例患者未发现残留结石,结石取尽率81.1%。14例患者结石残留患者中,4例患者术后2周行二期经皮肾镜取石术、4例行输尿管软镜碎石术,结石完全清除;6例术后3个月行体外震波碎石治疗,结石部分排出。74例均获随访,随访时间3~27个月,平均17个月,无结石复发病例,均在预期的时间内门诊经膀胱镜下拔除双J管。
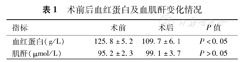
术前后血红蛋白及血肌酐变化情况
术前后血红蛋白及血肌酐变化情况
| 指标 | 术前 | 术后 | P值 |
|---|---|---|---|
| 血红蛋白(g/L) | 125.8±5.2 | 109.7±6.1 | P<0.05 |
| 肌酐(μmol/L) | 95.2±2.3 | 99.1±3.7 | P>0.05 |
PCNL由Fernstom与Johansson[4]于1976年首先实施并报道,通过建立经皮肾通道,将较大的结石击碎后取出,由此改变了以往较大的肾结石只有开放手术才能将结石取出的观念。经过40余年的发展,PCNL操作步骤已逐渐标准化。首先,患者取截石位,经尿道患侧逆行插入输尿管导管,随后改俯卧位,传统的PCNL采用X线定位穿刺,近年来由于超声定位更具准确、可靠、安全等特点而更多地被采用[5]。经输尿管导管灌注生理盐水,产生人工肾积水后由B超引导下穿刺肾盏,斑马导丝引导下筋膜扩张器扩张或球囊扩张,建立经皮肾穿刺通道后进行碎石清石治疗,术毕再顺行置放双J管。
PCNL因其损伤小、恢复快等特点已成为治疗肾结石尤其是复杂性肾结石及输尿管上段结石的有效方法[6]。在以往的PCNL操作过程中,经常会遇到如下困惑:(1)在经皮肾穿刺建立通道时,需要经预置的输尿管导管注水制造人工积水,注水时产生的微气泡会干扰B超成像进而影响穿刺的准确性;(2)结石清除后顺行插双J管由于视野欠清、穿刺通道与输尿管角度太小、输尿管中下段结石碎片堵塞、输尿管痉挛及下段狭窄等原因导致放置困难,需再次更改成截石位逆行置管,增加了手术时间和输尿管损伤的风险;或位置不准确导致术后拔管困难,增加了患者的痛苦及医疗费用。
本组病例通过预先留置双J管,接着留置导尿,并由导尿管加压灌注生理盐水,使肾盂通过双J管的返流作用持续得到灌注及加压。我们发现,在灌注生理盐水高度60~80 cm时,肾集合系统会产生稳定的人工积水,并且不会出现微气泡,B超成像很稳定。穿刺成功后,由于灌注的持续存在,方便后续通道扩张建立及碎石清石的进行,较传统的经皮肾镜取石术更不易形成凝血块,视野更清晰,由此减少了集合系统黏膜的误伤,增加手术的安全性。我们同时发现由于双J管的阻挡;双J管较输尿管导管侧孔多,由膀胱灌注的生理盐水通过逆流灌注,钬激光碎石时产生的结石碎片不易进入输尿管而减少了结石堵塞输尿管的风险。由于预先留置了双J管,避免了顺行留置双J管的弊端,没有患者术后拔管时由于双J管膀胱中不在位而需要进一步行输尿管检查。
当然,由于预先留置了双J管,钬激光碎石时可能导致双J管的误损伤,因此术中要时刻注意利用可撕剥鞘隔开双J管,以免影响术后引流的效果及附壁结石的形成。有时由于肾盂输尿管交界处铸形结石的阻挡,双J管的上端不能盘曲于肾盂,此时可在输尿管镜直视下先插入安全导丝越过结石进入肾盂,然后引导双J管的置放。
本组病例并发症发生率8.1%,其中1例拔除肾造瘘管后出现气胸,经胸腔闭式引流后治愈;1例术后形成动静瘘大出血,经高选择性肾动脉栓塞治疗好转,处理方式与既往研究资料相符合[7,8];4例患者出现高热,经退热、抗感染治疗后治愈,未发生感染性休克。术后血肌酐平均升高(3.1±1.1)μmol/L,但与术前比较差异无统计学意义,提示预先留置双J管对肾功能无明显影响。
通过本组病例观察,我们认为PCNL穿刺前预先留置双J管简化了手术步骤,是安全可行的,可以达到优化手术流程的效果。有利于B超定位,提高穿刺成功率;术中持续的冲洗有利于保持术野清晰,降低术中集合系统的误伤及碎石进入输尿管的机会;保证了双J管位置的准确性,避免术后由于双J管未置入膀胱导致拔管困难。当然,由于本组病例数目有限,尚需要多中心、大样本的前瞻性随机对照研究进一步证实。



























