
探讨慢性高原病(CMS)患者骨髓CD71+有核红细胞凋亡和细胞色素C(Cyt-C)及线粒体膜电位(MMP)的变化情况。
以14例CMS患者及15例单纯陈旧性骨折患者分别为CMS组和对照组,提取骨髓单个核细胞(BMMNC),CD71单克隆抗体标记、Annexin V-FITC/PI染色,流式细胞术检测CD71+有核红细胞的凋亡指数,磁珠分选法分选CD71+有核红细胞并以RT-qPCR检测Cyt-C mRNA的表达水平;JC-1染色流式细胞术检测CD71+有核红细胞MMP。
CMS组骨髓CD71+有核红细胞凋亡指数为(1.9±1.4)%明显低于对照组(3.2±1.5)%,差异有统计学意义(P<0.05)。CMS组Cyt-C mRNA表达水平(0.72±0.14)明显低于对照组(1.00±0.15),差异有统计学意义(P<0.01)。CMS组MMP(5.0±2.2)明显高于对照组(3.3±0.9),差异有统计学意义(P<0.05)。CMS患者骨髓CD71+有核红细胞凋亡指数与血红蛋白水平呈负相关(r=-0.569,P=0.034),凋亡指数、MMP及Cyt-C mRNA间未发现明显相关性。
CMS患者骨髓CD71+有核红细胞凋亡指数下降,且与血红蛋白水平呈负相关,说明有核红细胞凋亡下调可能与CMS红细胞积累有关;CD71+有核红细胞MMP增高,Cyt-C mRNA相对表达水平明显降低,提示线粒体通路变化参与CMS患者骨髓CD71+有核红细胞凋亡下降机制,而CD71+有核红细胞凋亡指数、MMP、Cyt-C mRNA水平之间没有发现明显的相关性,提示CMS造血细胞凋亡机制的复杂性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性高原病(CMS)是长期生活在海拔2 500 m以上地区的世居人群或移居者,对高海拔居住环境失适应或丧失习服能力而发生的临床综合征,以红细胞增多症和严重低氧血症为特征[1]。CMS相当程度地威胁着高海拔居住地区的居民健康,CMS发病机制与红细胞增殖、分化和凋亡息息相关。当前CMS发病机制中关于有核红细胞胞质细胞色素C(Cyt-C)、线粒体膜电位(MMP)变化及与其细胞凋亡的相关研究未见报道。本研究通过检测CMS患者骨髓CD71+有核红细胞凋亡指数、Cyt-C和MMP的变化情况,探究线粒体通路在CMS患者骨髓CD71+有核红细胞凋亡中的可能作用。
14例CMS患者,均为青海大学附属医院2015至2017年门诊及住院病人,严格按第六届国际高原医学和低氧生理学术大会(中国西宁,2004)推荐的CMS诊断标准确诊;以15例单纯陈旧性骨折患者为对照组。两组患者均生活在海拔3 000~4 500 m地区5年以上,并排除急慢性感染、肿瘤、免疫相关性疾病及原发性心、肺、肝、肾疾病。研究经过本院医学伦理委员会通过,并取得研究对象知情同意。
所使用的试剂包括:Ficoll(美国Sigma公司)、Trizol(Invitrogen公司)、CD71抗体磁珠(德国美天旎公司)、CD71单克隆抗体(美国BD公司)、Annexin V/PI(美国BD公司)、PrimescriptR RT reagent kit with g DNA Eraser(天根公司)、BDTMmitoscreen (JC-1)(美国BD公司)。使用的仪器包括:流式细胞仪(美国艾森公司)、CD71抗体磁珠(德国美天旎公司)、梯度PCR仪(MJ Research PTC-250,美国)、定量PCR仪(ABI7500,美国)、凝胶扫描成像系统(Labworks,英国)、Mi11pore Scepter手持式细胞计数仪(PHCC00000,上海)。
抽取研究对象外周静脉血5 ml及动脉血2 ml。外周静脉血用于进行外周血细胞学分析,动脉血用于血气分析。
收集CMS组及对照组研究对象的骨髓液5~6 ml、以肝素抗凝,1 800×g离心5 min,吸去上层血浆后,剩余沉淀中加入等体积1×磷酸缓冲盐溶液(PBS),混匀,置于7 ml Ficoll淋巴细胞分离液密度梯度液中,室温22 ℃,1 800×g离心20 min,吸取中间白色薄膜层(单个核细胞层),室温1 800×g离心5 min,弃上清,加入10 ml 1×PBS,室温1 800×g离心5 min,弃上清,相同的方法洗2遍,重悬细胞沉淀至5 ml缓冲液,充分混匀。用手持式细胞计数仪进行细胞计数。取1×106个骨髓单个核细胞,流式细胞仪检测细胞凋亡指数待用。
将上述细胞重悬液离心后,加入160 μl PBS,再加入40 μl CD71抗体磁珠(德国美天旎公司),4 ℃孵育15 min;加入5 ml PBS, 1 800×g离心5 min,弃上清,加入500 μl PBS,重悬沉淀。组装美天旎磁珠分选系统,以3 ml PBS湿润分选柱,待流空后,将细胞重悬液加入分选柱,待流空后,用3 ml PBS冲洗分选柱,重复3次,收集流出液标记为CD71-细胞;最后取5 ml PBS加入分选柱,拿离磁场,快速冲洗入15 ml管内,为CD71+细胞,并行细胞计数。
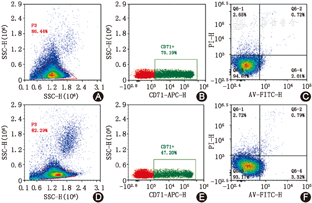
将新鲜的BMMNC按1×106个细胞,悬浮在100 μl PBS中,并加入APC标记的CD71+单克隆抗体10 μl、Annexin V-FITC 5 μl室温避光孵育15 min,加入5 μl PI,避光,孵育5 min,流式细胞术检测,确定40 000个CD71+细胞中的凋亡细胞数,凋亡指数为早期凋亡比例与晚期凋亡比例之和(图1)。

(1)用总RNA提取试剂盒(Total RNA kit目录号:DP419)提取CD71+有核红细胞RNA;(2)根据天根Fastquant cDNA第一链合成试剂盒说明书进行cDNA第一链的合成;(3)荧光定量PCR反应:配制20 μl反应体系(2×Super Real Premix Plus 10 μl、F-Primer 0.6 μl、R-Primer 0.6 μl、50×ROX Reference Dye 0.4 μl、cDNA模板2 μl、加RNase-free ddH2O补足至20 μl),反应条件:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 32 s,40个循环,反应结束后,根据样本及内参的ΔCT值,采用2-ΔΔCt法统计数据。
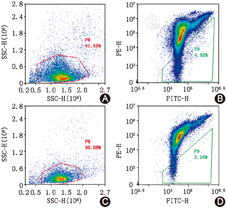
按照JC-1线粒体膜电位检测试剂盒(美国BD公司)操作说明进行试剂配置。制备1×106/ml的骨髓CD71+有核红细胞悬液,在15 ml离心管中加入1 ml细胞悬液,室温400×g离心5 min,弃上清。加JC-1工作液0.5 ml,吹打混匀,置于37 ℃的CO2培养箱,孵育15 min。按试剂盒说明书洗涤细胞两次。用1×Assay缓冲液0.5 ml,悬浮细胞,流式细胞仪分析MMP变化,以红色荧光值与绿色荧光值的比值表示MMP的高低(图2)。

采用SPSS 19.0统计软件进行分析,资料均为计量资料,数据均属于正态分布资料,结果用 ±s表示,两组间比较采用独立样本t检验;指标间相关性分析采用直线相关分析。P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验;指标间相关性分析采用直线相关分析。P<0.05为差异有统计学意义。
研究对象一般资料:14例CMS患者,均为汉族,男,年龄(42±6)岁;15例单纯陈旧性骨折患者为对照组,均为汉族,男,年龄(42±11)岁,两组间年龄差异无统计学意义(P>0.05)。一般资料详见表1。
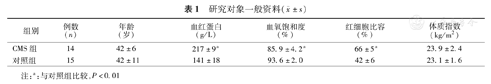
研究对象一般资料( ±s)
±s)
研究对象一般资料( ±s)
±s)
| 组别 | 例数(n) | 年龄(岁) | 血红蛋白(g/L) | 血氧饱和度(%) | 红细胞比容(%) | 体质指数(kg/m2) |
|---|---|---|---|---|---|---|
| CMS组 | 14 | 42±6 | 217±9a | 85.9±4.2a | 66±5a | 23.9±2.4 |
| 对照组 | 15 | 42±11 | 141±18 | 93.6±2.0 | 42±6 | 23.1±1.6 |
注:a:与对照组比较,P<0.01
CMS患者骨髓CD71+有核红细胞凋亡指数为(1.9±1.4)%,对照组为(3.2±1.5)%,两组间差异有统计学意义(P=0.031)。CMS患者骨髓CD71+有核红细胞Cyt-C mRNA的表达为(0.72±0.14),对照组为(1.00±0.15),两组间差异有统计学意义(P<0.001)。CMS组骨髓CD71+有核红细胞MMP为(5.0±2.2),对照组为(3.3±0.9) ,两组比较差异有统计学意义(P=0.017)(图1,图2,图3)。
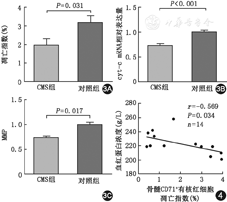

根据双变量相关性分析,CMS患者骨髓CD71+有核红细胞凋亡指数与血红蛋白水平呈负相关(r=-0.569,P=0.034)(图4)。凋亡指数与MMP无相关性(r=-0.022,P= 0.094),凋亡指数与Cyt-C mRNA无相关性(r=-0.070,P=0.812)。MMP与血红蛋白水平无相关性(r=0.098,P=0.738),Cyt-C mRNA与血红蛋白无相关性(r=-0.078,P= 0.790)。
本研究结果显示CMS骨髓CD71+有核红细胞凋亡指数低于对照组,且与血红蛋白水平呈反比,提示CMS骨髓有核红细胞凋亡下调参与了CMS红细胞积累的发生。前期研究结果显示CMS患者BMMNC凋亡指数下降[2,3,4,5],采用体外培养CMS患者骨髓有核红细胞并用TUNEL技术定量检测发现其凋亡指数下降[6,7]。骨髓造血细胞以红系为主,BMMNC凋亡变化情况可在一定的程度上反映红系凋亡情况,但BMMNC细胞成分复杂,不能完全反映红系凋亡情况;体外培养的红细胞凋亡变化不能完全反映体内情况。本研究采用Annexin V-FITC/PI染色流式细胞术检测CMS骨髓CD71+有核红细胞凋亡,发现其凋亡指数低于对照组,与前述研究结果一致,进一步证实CMS骨髓有核红细胞凋亡确实下调。同时,发现CMS患者骨髓CD71+有核红细胞凋亡指数与血红蛋白水平呈反比,说明骨髓CD71+有核红细胞凋亡下调参与了CMS红细胞积累的发生。至于CMS患者骨髓CD71+有核红细胞凋亡下调的原因,认为与低氧密切相关[8],相关机制有:(1)低氧可导致Na+/Ca2+交换(NCX)发生变化,NCX3亚型能维持细胞内Ca2+稳态并使缺氧期间的细胞处于存活状态[9,10] ;(2)低氧条件下通过自噬机制选择性清除活化的天门冬氨酸特异性半胱氨酸蛋白酶(caspase)、Bcl-2家族蛋白,抑制凋亡的发生并减轻细胞损伤[11];(3)低氧能够激活缺氧诱导因子-1α(HIF-1α),HIF-1α在多种缺氧组织中高表达[12],血管内皮生长因子(VEGF)基因启动子含有HIF-1α结合序列,因此VEGF在低氧条件下也会高表达,并通过MAK/ERK途径和PI3K/AKT途径,使Bcl-2、Bcl-xl表达上调,Bax表达下调,从而抑制了凋亡相关分子(如Cyt-C、caspase前体蛋白等)的释放,促进细胞增殖,抑制细胞凋亡[13];(4)低氧刺激下红细胞生成素(EPO)分泌增多,从而促进红系定向祖细胞增殖分化和成熟,抑制细胞凋亡[14,15],与之相关的信号通路有Janus蛋白酪氨酸激酶2(JAK2)信号通路、PI3K/AKT通路及STAT-5通路,这些信号通路的激活使MMP处于稳定状态,抑制促凋亡因子Cyt-C的释放,抑制细胞凋亡[16]。
本研究发现CMS骨髓CD71+有核红细胞MMP较对照组增高,Cyt-C mRNA水平降低,提示CMS有核红细胞凋亡下调与线粒体凋亡途径有部分关系。线粒体途径是细胞凋亡的重要途径之一。线粒体呼吸链通过氧化反应产生能量,在线粒体内膜以电化学梯度形式被储存,使内膜两侧离子处于不平衡状态即形成了MMP。MMP下降为细胞凋亡早期阶段,是细胞凋亡的特异性改变,凋亡信号传达至线粒体后,线粒体膜通透性转换孔打开,膜通透性增大,跨膜电位下降,释放促凋亡因子如Cyt-C、凋亡诱导因子等而引发细胞凋亡[17]。MMP的稳定有利于维持线粒体的正常生理功能,MMP增高不利于凋亡诱导分子的释放[18,19,20],本研究中Cyt-C mRNA水平降低的研究结果证实了这一点。研究确实证明,低氧条件下Cyt-C释放被抑制,使线粒体通路发生障碍,细胞凋亡下调[21,22]。Cyt-C是线粒体启动细胞凋亡程序的关键所在,当受到各类凋亡因素的刺激时,Cyt-C从线粒体释放到细胞质中,先与凋亡蛋白酶活化因子1、caspase-9结合形成复合体,从而发生细胞凋亡的级联反应,并进一步使caspase-3效应蛋白激活,最终导致细胞凋亡。因此,本研究结果提示线粒体途径变化参与了CMS有核红细胞凋亡下调机制。同时,指标间的相关性分析显示,在CD71+有核红细胞凋亡指数、MMP、Cyt-C mRNA水平间未发现明显统计学关系,提示CMS患者骨髓CD71+有核红细胞凋亡机制的复杂性。
本研究结果明确CMS患者骨髓CD71+有核红细胞凋亡下调,且线粒体途径在其机制中具有部分作用。提示骨髓CD71+有核红细胞凋亡在CMS发生发展中发挥着一定的作用,为进一步明确CMS红细胞的积累机制积累了科学依据,也为CMS患者治疗措施研究提供新的思路。细胞凋亡过程中涉及众多诱导因素和多种信号传导途径,完全明确细胞凋亡在CMS发生发展中的作用及其机制,需要进一步系统研究。



























