
探讨胰腺癌切除术后患者的预后因素,以及影响2、5年生存率的临床病理特征,以期提高胰腺癌患者的生存率。
回顾性分析469例胰腺癌切除术后患者的预后因素,以2、5年为界比较临床病理特征。
发现脉管侵犯(P=0.024)、淋巴结转移(P<0.001)、血管切除(P=0.002)、肿瘤最大径>2 cm(P=0.009)及低分化(P<0.001)是预后差的独立危险因素,术后化疗(P<0.001)是有益因素。除以上预后因素外,TNM分期(P<0.001)及胰周脂肪组织浸润(P=0.005)与2年生存有关。淋巴结转移(P=0.005)、低分化(P=0.014)及TNM分期(P=0.025)与5年生存有关。
对于胰腺癌术后患者,肿瘤最大径大,分化程度差、脉管侵犯、淋巴结转移、血管切除、术后未接受化疗是影响术后生存的不利因素,除此之外,TNM分期及胰周脂肪组织浸润与术后2年生存有关,淋巴结转移、分化程度及TNM分期与患者长期生存有关,这对胰腺癌手术预后判定和合理的外科治疗具有一定的临床指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰腺癌是种高侵袭性、预后极差的肿瘤类型,已成为主要的肿瘤致死原因之一,其中95%的患者在诊断后的1年内死亡,总体5年生存率仅有6%[1]。迄今为止,手术切除仍是胰腺癌患者惟一可能获得治愈的手段。但手术切除率仅10%~20%,术后的5年生存率约为25%[2]。因此,本研究通过回顾性分析胰腺癌术后患者临床资料,探索出患者的预后因素,以期提高生存率。
收集南京医科大学第一附属医院(江苏省人民医院)2008年1月1日至2015年8月14日行胰腺癌手术并且病理证实为腺癌患者的临床病理资料,排除标准:(1)合并其他恶性肿瘤;(2)接受新辅助化疗;(3)围手术期死亡;(4)重要临床资料不完整者。共收集636例患者资料,排除其中无随访资料的167例患者,469例病例纳入本研究。本研究中手术均由我院经验丰富的医师施行,胰十二指肠切除术式视术前影像学检查和术中探查情况决定,未发现有主要血管、邻近器官直接侵犯或术中冰冻病理未提示后腹膜等淋巴结阳性,则采用标准胰十二指肠切除术;如发现血管、邻近器官直接侵犯或淋巴转移则行扩大根治术。在保证十二指肠切缘阴性和幽门上下淋巴结阴性的前提下,尽可能行保留幽门行胰十二指肠切除术。影像学检查提示或术中探查肿瘤可能侵犯后腹膜,则加行扩大的腹膜后淋巴清扫术。全胰十二指肠和胰体尾切除术中通常联合脾切除。肿瘤侵犯门静脉和SMV血管周径不到1/3者采用楔形切除修补外,受侵周径≥1/3者均常规切除受侵血管,行端端吻合。术后化疗者80%均在本院施行,根据患者情况采用以吉西他滨或氟尿嘧啶类为基础的化疗方案。
记录患者的性别、年龄、实验室检查糖链抗原19-9(CA19-9)和癌胚抗原(CEA)、分化程度、T分期、TNM分期、肿瘤部位、肿瘤最大径、淋巴结转移、脉管及神经侵犯、血管侵犯、胰周脂肪组织是否有癌细胞浸润、切缘情况、是否联合血管切除、体重减轻史及术后有无化疗。TNM分期根据美国抗癌联合会(AJCC)第7版诊断的标准。R0切除术定义为肉眼及显微镜下达到完全切除,R1为肉眼阴性但显微镜下切缘阳性。体重减轻评判标准为体重在6个月内减轻≥10%。
术后2年内每3个月复查1次,第3~5年每半年复查1次,5年后每年复查1次,复查内容主要包括CT/MRI、肿瘤标志物及体格检查,出院后电话随访,随访时间至2016年12月20日截止。
应用SPSS 22.0统计软件进行分析。总生存时间从手术日期算起,截止至死亡日期或最后一次随访时间。采用Kaplan-Meier法估计生存率,用Log Rank检验对研究因素进行比较,检验各组生存率分布是否相同,将单因素分析中P<0.05的因素纳入Cox比例风险模型进行多因素预后分析。P<0.05为差异有统计学意义。采用独立样本t检验、χ2检验和Mann-Whitney检验比较生存时间≤2年和>2年及≤5年和>5年患者的临床病理特征以及预后因素间相关性分析。
469例病例中,男共286例,女183例,手术时平均年龄为62岁,胰头癌为338例(72.1%),胰体尾/全胰为131例(27.9%),肿瘤最大径≤2 cm者共65例(13.9%),>2 cm者为404例(86.1%),神经侵犯者为150例(68%),60例(12.8%)脉管侵犯,412例(87.8%)为R0切除,影像学、手术过程发现血管侵犯者为191例(40.7%),T分期中,T1者为13例(2.8%),T2者为31例(6.6%),T3占364例(77.6%),T4者为61例(13%)。淋巴结转移者有241例(51.4%),ⅠA期患者为10例(2.1%),ⅠB期为23例(4.9%),ⅡA期占173例(36.9%),ⅡB期占186例(39.7%),Ⅲ期为58例(12.4%),Ⅳ期为19例(4.1%)。60例(12.8%)患者手术联合血管切除。术前94例(23.8%)患者有近期体重减轻史,高/中分化有188例(40.1%),低分化者为281例(59.9%),癌胚抗原CEA为8.70(0.54~223.40)(μg/L),CA19-9正常者(≤39.9 U/ml)为97例(20.7%),高于1 000 (U/ml)者为77例(16.4%),处于两者之间的占263例(56.1%),32例(6.8%)不详,术后230例(49%)有过化疗史,239例(51%)术后未予化疗。
496例患者的中位随访时间为15个月,中位生存时间为15.9个月,1、3及5年累积生存率分别为63.7%,23.0%及17.0%。见表1。单因素分析中性别、肿瘤最大径、脉管及神经侵犯、胰周脂肪组织浸润、切缘情况、血管侵犯、淋巴结转移、TNM分期、血管切除、分化程度及术后有无化疗与预后相关。多因素分析:脉管侵犯、淋巴结转移、联合血管切除、肿瘤最大径>2 cm及低分化是预后差的独立危险因素,术后化疗是预后的有益因素。见表2。独立预后因素生存曲线图的比较(图1A,图1A,图1B,图1C,图1D,图1E,图1F)。
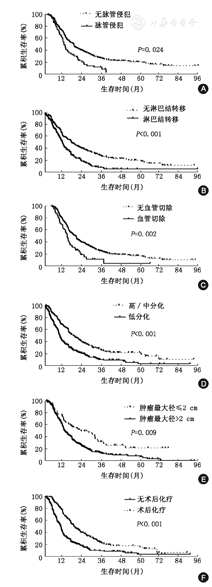

A:脉管侵犯;B:淋巴结转移(N0与N1);C:血管切除;D:分化程度(高、中分化与低分化);E:肿瘤最大径(≤2 cm与>2 cm);F:是否完成辅助化疗
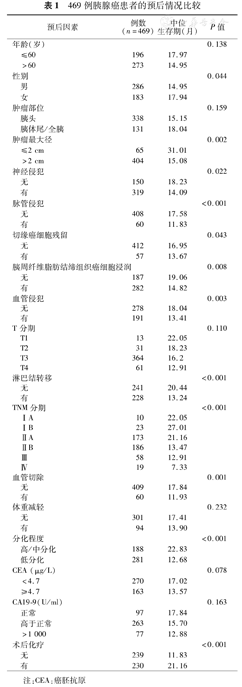
469例胰腺癌患者的预后情况比较
469例胰腺癌患者的预后情况比较
| 预后因素 | 例数(n=469) | 中位生存期(月) | P值 | |
|---|---|---|---|---|
| 年龄(岁) | 0.138 | |||
| ≤60 | 196 | 17.97 | ||
| >60 | 273 | 14.95 | ||
| 性别 | 0.044 | |||
| 男 | 286 | 14.95 | ||
| 女 | 183 | 17.94 | ||
| 肿瘤部位 | 0.159 | |||
| 胰头 | 338 | 15.15 | ||
| 胰体尾/全胰 | 131 | 18.04 | ||
| 肿瘤最大径 | 0.002 | |||
| ≤2 cm | 65 | 31.01 | ||
| >2 cm | 404 | 15.08 | ||
| 神经侵犯 | 0.022 | |||
| 无 | 150 | 18.23 | ||
| 有 | 319 | 14.09 | ||
| 脉管侵犯 | <0.001 | |||
| 无 | 408 | 17.58 | ||
| 有 | 60 | 11.83 | ||
| 切缘癌细胞残留 | 0.043 | |||
| 无 | 412 | 16.95 | ||
| 有 | 57 | 13.67 | ||
| 胰周纤维脂肪结缔组织癌细胞浸润 | 0.008 | |||
| 无 | 187 | 19.06 | ||
| 有 | 282 | 14.82 | ||
| 血管侵犯 | 0.003 | |||
| 无 | 278 | 18.04 | ||
| 有 | 191 | 13.41 | ||
| T分期 | 0.110 | |||
| T1 | 13 | 22.05 | ||
| T2 | 31 | 18.23 | ||
| T3 | 364 | 16.2 | ||
| T4 | 61 | 12.91 | ||
| 淋巴结转移 | <0.001 | |||
| 无 | 241 | 20.44 | ||
| 有 | 228 | 13.24 | ||
| TNM分期 | <0.001 | |||
| ⅠA | 10 | 22.05 | ||
| ⅠB | 23 | 27.01 | ||
| ⅡA | 173 | 21.16 | ||
| ⅡB | 186 | 13.47 | ||
| Ⅲ | 58 | 12.91 | ||
| Ⅳ | 19 | 7.33 | ||
| 血管切除 | 0.001 | |||
| 无 | 409 | 17.84 | ||
| 有 | 60 | 11.93 | ||
| 体重减轻 | 0.232 | |||
| 无 | 301 | 17.41 | ||
| 有 | 94 | 13.90 | ||
| 分化程度 | <0.001 | |||
| 高/中分化 | 188 | 22.83 | ||
| 低分化 | 281 | 12.68 | ||
| CEA (μg/L) | 0.078 | |||
| <4.7 | 270 | 17.02 | ||
| ≥4.7 | 163 | 13.57 | ||
| CA19-9(U/ml) | 0.163 | |||
| 正常 | 97 | 17.84 | ||
| 高于正常 | 263 | 15.70 | ||
| >1 000 | 77 | 12.88 | ||
| 术后化疗 | <0.001 | |||
| 无 | 239 | 11.83 | ||
| 有 | 230 | 21.16 | ||
注:CEA:癌胚抗原
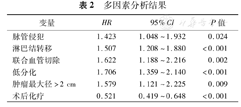
多因素分析结果
多因素分析结果
| 变量 | HR | 95%CI | P值 |
|---|---|---|---|
| 脉管侵犯 | 1.423 | 1.048~1.932 | 0.024 |
| 淋巴结转移 | 1.507 | 1.208~1.880 | <0.001 |
| 联合血管切除 | 1.622 | 1.188~2.216 | 0.002 |
| 低分化 | 1.706 | 1.359~2.140 | <0.001 |
| 肿瘤最大径>2 cm | 1.579 | 1.121~2.225 | 0.009 |
| 术后化疗 | 0.521 | 0.419~0.648 | <0.001 |
随访截止至2016年12月20日,排除失访病例,分别收集348、100例病人资料比较患者的2年及5年生存情况。表3可看出。脉管侵犯(P=0.012)、TNM分期(P<0.001)、淋巴结转移(P<0.001)、联合血管切除(P=0.014)、肿瘤最大径>2 cm(P=0.004)、胰周纤维脂肪结缔组织癌细胞浸润(P=0.005)、低分化(P<0.001)及术后化疗(P<0.001)与2年生存有关。无淋巴结转移(P=0.005)、高/中分化(P=0.014)及TNM分期早(P=0.025)与胰腺癌患者术后5年生存有关。
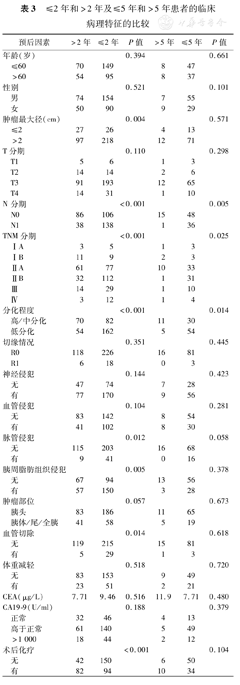
≤2年和>2年及≤5年和>5年患者的临床病理特征的比较
≤2年和>2年及≤5年和>5年患者的临床病理特征的比较
| 预后因素 | >2年 | ≤2年 | P值 | >5年 | ≤5年 | P值 | |
|---|---|---|---|---|---|---|---|
| 年龄(岁) | 0.394 | 0.661 | |||||
| ≤60 | 70 | 149 | 8 | 47 | |||
| >60 | 54 | 95 | 8 | 37 | |||
| 性别 | 0.521 | 0.101 | |||||
| 男 | 74 | 154 | 7 | 55 | |||
| 女 | 50 | 90 | 9 | 29 | |||
| 肿瘤最大径(cm) | 0.004 | 0.571 | |||||
| ≤2 | 27 | 26 | 4 | 13 | |||
| >2 | 97 | 218 | 12 | 71 | |||
| T分期 | 0.110 | 0.298 | |||||
| T1 | 5 | 6 | 1 | 3 | |||
| T2 | 14 | 14 | 2 | 6 | |||
| T3 | 91 | 193 | 12 | 65 | |||
| T4 | 14 | 31 | 1 | 10 | |||
| N分期 | <0.001 | 0.005 | |||||
| N0 | 86 | 106 | 15 | 48 | |||
| N1 | 38 | 138 | 1 | 36 | |||
| TNM分期 | <0.001 | 0.025 | |||||
| ⅠA | 3 | 5 | 1 | 3 | |||
| ⅠB | 11 | 9 | 2 | 3 | |||
| ⅡA | 61 | 77 | 10 | 33 | |||
| ⅡB | 32 | 112 | 1 | 31 | |||
| Ⅲ | 14 | 29 | 1 | 10 | |||
| Ⅳ | 3 | 12 | 1 | 4 | |||
| 分化程度 | <0.001 | 0.014 | |||||
| 高/中分化 | 70 | 82 | 11 | 30 | |||
| 低分化 | 54 | 162 | 5 | 54 | |||
| 切缘情况 | 0.351 | 0.445 | |||||
| R0 | 118 | 226 | 16 | 81 | |||
| R1 | 6 | 18 | 0 | 3 | |||
| 神经侵犯 | 0.144 | 0.423 | |||||
| 无 | 47 | 74 | 7 | 28 | |||
| 有 | 77 | 170 | 9 | 56 | |||
| 血管侵犯 | 0.104 | 0.281 | |||||
| 无 | 83 | 142 | 8 | 54 | |||
| 有 | 41 | 102 | 8 | 30 | |||
| 脉管侵犯 | 0.012 | 0.058 | |||||
| 无 | 115 | 203 | 16 | 68 | |||
| 有 | 9 | 41 | 0 | 16 | |||
| 胰周脂肪组织侵犯 | 0.005 | 0.378 | |||||
| 无 | 67 | 94 | 13 | 56 | |||
| 有 | 57 | 150 | 3 | 28 | |||
| 肿瘤部位 | 0.057 | 0.673 | |||||
| 胰头 | 83 | 186 | 11 | 65 | |||
| 胰体/尾/全胰 | 41 | 58 | 5 | 19 | |||
| 血管切除 | 0.014 | 0.618 | |||||
| 无 | 119 | 215 | 15 | 81 | |||
| 有 | 5 | 29 | 1 | 3 | |||
| 体重减轻 | 0.518 | 0.720 | |||||
| 无 | 83 | 153 | 9 | 49 | |||
| 有 | 23 | 51 | 2 | 21 | |||
| CEA(μg/L) | 7.71 | 9.46 | 0.516 | 11.9 | 7.71 | 0.480 | |
| CA19-9(U/ml) | 0.188 | 0.379 | |||||
| 正常 | 32 | 46 | 4 | 13 | |||
| 高于正常 | 61 | 140 | 5 | 49 | |||
| >1 000 | 18 | 44 | 2 | 12 | |||
| 术后化疗 | <0.001 | 0.104 | |||||
| 无 | 42 | 150 | 6 | 50 | |||
| 有 | 82 | 94 | 10 | 34 | |||
胰腺癌为预后极差的一种恶性肿瘤。手术治疗是决定胰腺癌患者生存时间的最重要预后因素。本研究回顾性分析469例行胰腺癌切除术的患者的临床病理资料,结果示分化程度、肿瘤大小、脉管侵犯、淋巴结转移、是否联合血管切除及术后是否化疗为影响预后的独立因素。除以上预后因素,TNM分期与胰周脂肪组织浸润与2年生存有关。淋巴结转移、分化程度及TNM分期与5年生存有关。
许多相关研究表明淋巴结转移与胰腺癌术后预后相关,可指导其治疗。王卓等[3]报道淋巴结转移是胰腺癌根治术后预后的独立影响因素,淋巴结转移阴性者其生存期长于有淋巴结转移者。本研究还发现无淋巴结转移与5年生存有关,与Yamamoto等[1]研究结果相似。瘤体最大径反映肿瘤的大小,是原发肿瘤浸润范围的体现,目前,在乳腺癌、肺癌、胰腺癌及其他恶性肿瘤中,肿瘤大小被纳入TNM分期标准,体现出肿瘤大小和预后密切相关,胰腺癌分期中T1及T2是以2 cm为界划分。Yamamoto等[1]发现肿瘤直径≤2 cm是有利预后因素,并且肿瘤直径≤2 cm存活超过5年的概率更大。本研究也显示瘤体最大径≤2 cm者预后比>2 cm者要好。
国内外已有多项报道肿瘤分化程度是影响胰腺癌术后预后的独立因素[4,5]。本研究也显示高/中分化患者比低分化患者预后好。Picozzi等[6]研究发现分化程度与5年生存相关,低分化者5年生存比例低于高/中分化者,差异有统计学意义,本研究与之相符。另有研究表明[7]高/中分化与10年生存率有关。许多学者认为分化差者癌细胞恶性程度高,彼此之间的黏附力减少,癌细胞与血管、淋巴管基底膜的附着机会增加,癌细胞"自身运动"增强,移入血管、淋巴管,形成远隔脏器或淋巴结转移。
关于联合血管切除,以往认为其为手术切除的禁忌证,而随着外科手术技术的进步,现已越来越普遍。许多研究[8,9]表明其与标准手术方式相比,生存率无明显差别,但有些报道却发现联合血管切除,其生存率更低,可能因为这些患者手术时已有血管侵犯,分期较晚,且R0切除率低于不需要联合血管切除的患者[10]。本研究发现血管切除患者术后生存期更短,经Mann-Whitney检验发现血管切除患者TNM分期总体较无血管切除患者分期晚(P=0.039)。且χ2检验发现血管切除患者R0切除术率更低(P<0.001)。考虑本研究中血管切除患者预后差与分期晚及R0切除率低有关。
许多报道发现脉管侵犯是影响预后的危险因素,其作为一种预测术后复发及预后的可靠指标,在肝细胞癌和睾丸癌中已正式成立,支持其并入UICC/AJCC TNM分期[11]。Perini等[12]研究发现脉管侵犯者生存期短于无侵犯者,且是影响患者术后独立危险因素。同样Aoyama等[13]发现淋巴管浸润是接受根治性手术且行辅助化疗的胰腺癌患者最重要的预后因素。本研究中脉管侵犯者预后差,差异有统计学意义。目前,对于脉管侵犯对肿瘤预后的影响尚存在争议,但大部分学者还是认为脉管内侵犯和患者的生存率及肿瘤的复发有密切的关系,且目前临床上已将脉管内侵犯的检测作为病理中常规进行的检查。而且可以根据脉管内侵犯的情况对肿瘤病人术后的辅助治疗提供参考的依据研究。
虽然,目前现有的证据发现胰腺癌术后辅助治疗改善存活有限,但许多报道均表明胰腺癌术后化疗利于生存。胰腺癌极易复发,单纯术后复发率高达95%,行术后辅助化疗消灭体内残存肿瘤细胞,延长生存时间。ESPAC-1、CONKO-001、ESPAC-3大型研究结果均表明胰腺癌术后接受辅助化疗者明显获益[14,15,16]。
TNM分期作为肿瘤患者预后的一个最重要因素,许多研究中都证实其为患者预后的独立因素,本研究中单因素分析发现肿瘤分期影响预后,但多因素分析中无差异统计学意义,考虑本研究中Ⅳ期患者极少,TNM分期主要与肿瘤最大径、淋巴结转移有关,因各因素间相关性,分期在多因素中出无意义,但TNM分期却与术后2、5年生存有关,分期晚者预后差,因此本研究中分期也是预后的相关因素。
关于胰腺周围纤维结缔脂肪组织是否有癌细胞浸润对预后影响报道不多,Jamieson等[17]曾报道胰腺周围脂肪癌细胞浸润是术后生存的独立危险因素,本研究单因素中胰腺周围脂肪组织癌细胞浸润有意义,多因素分析无意义,但与术后2年生存有关,尚需进一步研究。
本研究的局限性在于其是单中心的回顾性分析,故大规模的多中心研究尚需进行已证实本研究结果。
胰腺癌术后患者的预后受到许多因素影响,肿瘤大小、淋巴结转移、分化程度、血管切除、脉管侵犯及术后化疗是影响其预后的独立因素。早期发现及时手术以及术后积极治疗是关键。因此提高早期诊断率是改善预后的关键,应加强体检,对高位人群进行普查。术后应对患者进行评估,针对个体差异,选择合适方案化疗以提高生存时间。



























