
研究Roundabout1(Robo1)-CAR-NK92细胞在体外对神经胶质瘤细胞U87-MG及神经母细胞瘤细胞SH-SY5Y的体外杀伤以及探讨白细胞介素-15(IL-15)、IL-21和地塞米松对Robo1-CAR-NK92细胞增殖、活性和杀伤的影响以优化培养方案。
用慢病毒转染的方法构建Robo1-CAR-NK92细胞后分选扩增,并用流式细胞术检测阳性率。用流式细胞术的方法检测U87-MG及SH-SY5Y细胞表面Robo1的表达。用CCK-8试剂盒和动态活细胞成像的方法检测Robo1-CAR-NK92及NK92细胞对靶细胞的体外杀伤。用流式多重微珠阵列法检测杀伤过程中分泌的细胞因子含量。用锥虫蓝染色的方法检测经25 ng/ml的IL-15,25 ng/ml的IL-21和(或)50 nmol/L的地塞米松处理3 d后的Robo1-CAR-NK92及NK92细胞的计数及活性率。
构建Robo1-CAR-NK92细胞并经分选扩增后检测阳性率为98.89%。流式细胞术检测结果显示,Robo1在U87-MG及SH-SY5Y细胞上表达的阳性率分别为88.14%,99.75%。Robo1-CAR-NK92细胞对靶细胞的杀伤率明显高于NK92的杀伤率(P<0.05)。Robo1-CAR-NK92细胞在杀伤U87-MG细胞过程中分泌的IL-6、IL-10、TNF-α和IFN- γ较NK92细胞明显增多(P<0.05)。IL-15能促进Robo1-CAR-NK92的增殖和活性而IL-21则起相反作用。IL-21、IL-15+IL-21能增强NK92和Robo1-CAR-NK92细胞的杀伤效果。IL联用地塞米松能增强NK92和Robo1-CAR-NK92细胞的增殖和活性,但抑制二者的杀伤效果(除IL-15和地塞米松联用不影响Robo1-CAR-NK92细胞的杀伤效果外)。
与NK92细胞比,Robo1-CAR-NK92细胞对神经胶质瘤及神经母细胞瘤细胞有更强大的杀伤效果。在本试验时间内,IL-15联用地塞米松处理Robo1-CAR-NK92细胞是最有利于Robo1-CAR-NK92细胞体外增殖的培养方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来CD19-CAR-T细胞在治疗难治性或复发性B细胞恶性肿瘤患者方面取得了巨大的进步,但在治疗实体瘤方面因效果差、不良反应多仍不乐观。相较于CAR-T细胞,CAR-NK细胞有无MHC限制性、快速广泛的抗肿瘤作用、不易引发强烈的移植物抗宿主疾病(GvHD)、价格便宜、易获得及快速生产等优势[1,2],因此受到了越来越多的关注。据报道,Slit2/Robo1系统参与神经胶质瘤和神经母细胞瘤的发展过程[3],而Robo1在神经胶质瘤中明显表达上调,并与神经胶质瘤患者的预后有关[4,5],用抗Robo1单克隆抗体可以抑制多种不同肿瘤细胞的黏附、侵袭及迁移[6,7,8]。根据Robo1在肿瘤中的上调表达及其可能的作用,本试验创建了Robo1-CAR-NK92细胞,并比较其与NK92细胞在体外对神经胶质瘤(U87-MG)及神经母细胞瘤细胞(SH-SY5Y)的杀伤效果,并测试添加白细胞介素-15(IL-15)、IL-21和地塞米松对Robo1-CAR-NK92细胞的增殖,活性及杀伤的影响以进一步优化其培养条件。
高糖DMEM培养液、胎牛血清(FBS)及马血清购自美国Hyclone公司。α-MEM培养液购自美国Life Technologies公司。重组人IL-2(rhIL-2)、rhIL-15及rhIL-21购自美国Novoprotein公司。Polybrene、4%多聚甲醛购自美国Sigma-Aldrich公司。APC-抗flag抗体来自美国BioLegend公司。兔抗人Robo1一抗、磷酸钠地塞米松购自英国Abcam公司。Alexa Fluor 488-驴抗兔二抗购自美国Invitrogen公司。CCK-8(Cell Counting Kit-8)购自日本Dojindo公司。FACSAriaTM Ⅱ荧光细胞分选仪、FACS celesta流式细胞分析仪、流式微珠阵列人Th1/Th2细胞因子试剂盒来自美国的BD Biosciences公司。Multiskan FC微板光度计来自美国Thermo Scientific公司。ZC1000自动细胞计数仪来自上海的Countstar公司。IncuCyte™动态活细胞成像系统来自美国的Essen BioScience公司。
人神经胶质瘤U87-MG、神经母细胞瘤SH-SY5Y、病毒包装细胞HEK 293T、NK92购自中国医学科学院细胞库。U87-MG、SH-SY5Y、HEK293T细胞均培养在含10%FBS的高糖DMEM培养液中。NK92、Robo1-CAR-NK92细胞均培养在含100 U/ml rhIL-2、12.5%FBS及12.5%马血清的α-MEM培养液中。
利用基因合成的方法构建由对Robo1特异性识别的单链可变片段(scFv)、CD 8α铰链区连接共刺激因子4-1BB (CD137)和细胞内传递信号的CD3-ζ片段组成的Robo1-CAR片段(由南京金唯智公司提供)。将Robo1-CAR片段插入慢病毒载体质粒中。按Lipofectamine2000使用说明将慢病毒载体质粒及2种病毒包装辅助质粒共转染HEK293T细胞,培养12 h后换液、48 h后收病毒并浓缩。将包装好的慢病毒加入转染增强剂8 μg/ml polybrene转染NK92细胞3 d后,用荧光细胞分选仪分选获得Robo1-CAR-NK92细胞并继续扩大培养。
收集NK92及Robo1-CAR-NK92细胞并调整密度至106/ml,PBS洗涤2次后弃去上清,加入APC-Flag抗体后混匀避光孵育30 min后PBS洗涤、重悬,上流式细胞仪检测。收集U87-MG及SH-SY5Y细胞并调整密度至106/ml,PBS洗涤2次后弃去上清,用4%多聚甲醛固定10 min,用0.1% Triton-X和0.1% BSA透膜15 min,用兔抗人Robo1一抗和Alexa Fluor 488-驴抗兔二抗分别避光孵育30 min后PBS洗涤、重悬,上流式细胞仪检测。
体外杀伤活性测定同前所述[9]。将U87-MG,SH-SY5Y细胞作为靶细胞在96孔板中培养过夜后,各实验孔分别加入NK92,Robo1-CAR-NK92细胞,使其效靶比(E∶T)分别为0.25∶1, 0.5∶1和1∶1,同时设效应细胞对照孔、靶细胞对照孔及空白对照孔,各孔均设3个复孔。效靶细胞共同孵育16 h后,每孔加入CCK-8液20 μl,再继续孵育1 h。用微板光度计于450 nm处测定吸光度(A)值。按下列公式计算NK细胞的杀伤率:NK细胞杀伤率(%)=[1-(效靶混合组A值-效应细胞对照组A值)/(靶细胞对照组A值-空白对照孔A值)]×100%。
将效应细胞与靶细胞按照上述体外杀伤试验处理后,将96孔板置于动态活细胞成像仪16 h观察动态杀伤过程,并用自带的动态活细胞成像软件拍摄相位对比照片。
将U87-MG细胞作为靶细胞培养在96孔板中过夜后,各实验孔分别加入NK92,Robo1-CAR-NK92细胞,使其效靶比(E∶T)为0.5∶1,同时设靶细胞对照孔。效靶细胞共同孵育16 h后收集上清,根据流式微珠阵列人Th1/Th2细胞因子试剂盒说明书检测IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α和IL-17A的水平。用BD FACS celesta流式细胞分析仪读取数据并用FCAP Array™软件(v3.0.1)定量分析。
4×104/ml的NK92和Robo1-CAR-NK92细胞均用IL-15 (25 ng/ml,以下同), IL-21(25 ng/ml,以下同), IL-15+ IL-21, IL-15+地塞米松(50 nmol/l,以下同), IL-21+地塞米松,IL-15+IL-21+地塞米松分别处理3 d后,用锥虫蓝染液排除死细胞并用自动活细胞计数仪计数并检测活性率。
数据应用SPSS 23.0统计分析软件进行统计学分析,数据均以 ±s表示,各组间均数比较采用t检验和多因素方差分析(two-way ANOVA),以P<0.05为差异有统计学意义。
±s表示,各组间均数比较采用t检验和多因素方差分析(two-way ANOVA),以P<0.05为差异有统计学意义。
本实验构造的二代Robo1-CAR片段结构如图1A所示。流式细胞术检测结果(图1B,图1C)显示Robo1-CAR在Robo1-CAR-NK92细胞上阳性表达(阳性率为98.89%),而未转染NK92细胞为阴性表达。
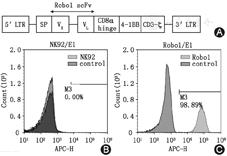

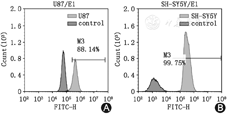
流式细胞术检测结果如图2A及图2B分别显示Robo1在U87-MG及SH-SY5Y细胞均为阳性表达,阳性率分别为88.14%和99.75%。上述结果显示,Robo1在SH-SY5Y细胞的表达水平稍高于在U87-MG细胞的表达水平。

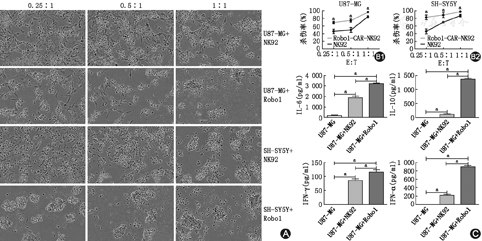

如图3B1,图3B2所示,Robo1-CAR-NK92细胞对SH-SY5Y细胞的杀伤效率为(82.335±5.512)% (0.25∶1)、(88.607±6.106)% (0.5∶1)及(97.440±1.474)% (1∶1),而NK92细胞对SH-SY5Y的杀伤效率为(45.954±5.938)%(0.25∶1)、(70.370±2.030)% (0.5∶1)及(87.230±2.820)% (1∶1)。Robo1-CAR-NK92细胞对U87-MG细胞的杀伤效率分别为(69.227±2.818)%(0.25∶1)、(74.573±3.575)% (0.5∶1)及(95.651±2.395)% (1∶1)而NK92细胞对U87-MG细胞的杀伤效率为(46.042±5.732)% (0.25∶1)、(49.780±6.328)% (0.5∶1)及(84.486±2.591)% (1∶1)。Robo1-CAR-NK92细胞对两种靶细胞的杀伤活性均显著强于NK92细胞,并且差异有统计学意义(P<0.05)。在不同的效靶比下,Robo1-CAR-NK92细胞对SH-SY5Y细胞的杀伤效率均强于对U87-MG细胞,差异有统计学意义(P<0.05)。NK92和Robo1-CAR-NK92细胞对U87-MG和SH-SY5Y细胞的杀伤率随效靶比的增加而增加,呈剂量依赖性。如图3A所示,相位照片同样印证了上述结果。另外,如图3C所示,Robo1-CAR-NK92细胞在杀伤U87-MG过程中分泌的IL-6、IL-10、TNF-α和IFN-γ较NK92细胞显著增加,更显著大于U87-MG细胞对照组,差异均有统计学意义(均P<0.05)。IL-2、IL-4和IL-17A未检测到。以上数据显示,Robo1-CAR-NK92细胞比NK92细胞有更强的功能。
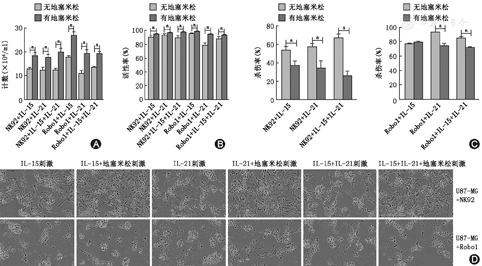
如图4A和图4B所示,与未经处理的NK92细胞相比,IL-15和(或)IL-21的处理对NK92细胞的增殖、活性无明显影响(P>0.05),与未经处理的Robo1-CAR-NK92细胞相比,IL-15处理的的细胞数目(×104/ml)和活性率分别从(14.66±0.05)和(89.22±1.12)%上升至(17.33±0.31)和(94.22±0.60)%(P<0.05),而IL-21处理的Robo1-CAR-NK92细胞急剧下降至(10.49±0.53)和(77.18±1.53)%(P<0.05),二者联用后下降至(13.03±0.25)(P<0.05)和(86.59±1.48)%(P>0.05)。如图4C所示,与未经处理的NK92和Robo1-CAR-NK92细胞相比,IL-21处理的NK92和Robo1-CAR-NK92细胞对U87-MG细胞的杀伤率分别从(49.51±1.36)%和(76.48±1.10)%增加至(55.97±2.67)%和(91.62±0.49)%(P<0.05),而IL-15的处理对二者的杀伤率无明显影响(P>0.05),二者联用后分别增加至(65.73±3.19)%和(83.46±1.74)%(P<0.05)。如图4D所示,相位照片同样印证了上述结果。
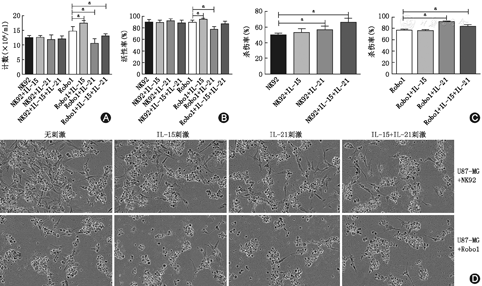

如图5A,图5B所示,与仅用IL处理的NK92和Robo1-CAR-NK92细胞相比,加用地塞米松处理的NK92和Robo1-CAR-NK92细胞数目和活性率显著升高(P<0.05)。而如图5C所示,与仅用白介素处理的NK92和Robo1-CAR-NK92细胞相比,加用地塞米松处理的NK92和Robo1-CAR-NK92细胞对U87-MG细胞的杀伤率显著降低(P<0.05),除地塞米松联用IL-15处理的Robo1-CAR-NK92细胞对U87-MG细胞的杀伤率未见明显变化(P>0.05)。如图5D所示,相位照片同样印证了上述结果。

神经胶质瘤来源于中枢神经系统的神经胶质细胞,是成人最常见的颅内恶性肿瘤[10]。神经母细胞瘤起源于胚胎性交感神经系统神经嵴细胞,是儿童最常见的颅外肿瘤[11,12]。目前,胶质母细胞瘤(GBM)和间变性神经胶质瘤的患者中位生存期分别为12~15个月和2~5年[13]。不足50%的高危神经母细胞瘤患者有长期生存的机会[14]。因此,迫切需要找到一种更有效的治疗方法。
最近几年,CD19-CAR-T细胞在治疗如急性淋巴细胞性白血病[15,16,17],慢性淋巴细胞白血病[18,19]和淋巴瘤[20,21]等血液系统恶性肿瘤方面取得了巨大的进步。然而,CAR-T细胞在实体瘤的治疗方面却因临床反应差和不良反应多而不甚乐观。自然杀伤(NK)细胞是人体固有免疫系统的效应细胞。活化的NK细胞通过释放穿孔素、颗粒酶及分泌炎性细胞因子等方式杀伤病毒感染细胞和肿瘤细胞。更重要的是,NK细胞识别和杀伤靶细胞不需要预先致敏,无MHC限制性,这使它们十分适用于实体瘤的过继性免疫治疗[22]。然而,在肿瘤微环境中,许多肿瘤细胞通过高表达MHCⅠ类分子、分泌免疫抑制因子等方式获得免疫逃逸的能力,因此需要引入CAR以靶向杀伤肿瘤细胞。目前,CAR-NK细胞已在肿瘤的体外实验及动物模型中得到应用,如用CD19作为标靶治疗淋巴瘤[23],ErbB2/HER2作为靶标治疗乳腺癌[24],GD2作为靶标治疗神经母细胞瘤[25]。
本研究通过病毒转染的方式成功构造了Robo1-CAR-NK92细胞并且证明了其相比NK92细胞对神经胶质瘤及神经母细胞瘤细胞有更快更强的靶向杀伤作用。Robo1-CAR-NK92细胞对靶细胞的杀伤活性显著强于NK92细胞,其可通过Robo1-CAR靶向识别杀伤耐NK92细胞的靶细胞。而Robo1-CAR-NK92细胞对SH-SY5Y细胞的杀伤效率均强于对U87-MG细胞,与两种靶细胞表面的Robo1表达一致,也同样证明了Robo1-CAR的靶向性。在杀伤过程中,Robo1-CAR-NK92细胞较NK92细胞分泌了更多的细胞因子IL-6、TNF-α和IFN-γ,但同时也分泌了更多的抗炎因子IL-10[26],这可能部分抵消Robo1-CAR-NK92细胞的致炎作用以减轻过继性免疫治疗的不良反应[27]。对Robo1-CAR-NK92细胞的更多功能研究后续还需要补充更多的体内外试验。
成功的过继性免疫治疗需要在体外大量扩增功能完整的CAR-NK细胞以适应体内的肿瘤抑制性微环境[28],因此常在培养基中添加细胞因子或其他因子以优化培养方案[29,30]。本研究发现,IL-15和(或)IL-21对NK92细胞的增殖和活性并无明显作用,可能与处理的时间不足有关[31]。而IL-15能促进Robo1-CAR-NK92的增殖和活性而IL-21则起相反作用。二者联用能部分抵消IL-21的抑制作用,这可能由于IL-21能诱导Robo1-CAR-NK92细胞凋亡[31]。其他文献表明IL-21对NK细胞增殖的作用取决于细胞的活化/成熟阶段及种群起源[32]。Robo1-CAR-NK92细胞对SH-SY5Y细胞杀伤作用强烈,而对U87-MG细胞相对温和,故选用U87-MG细胞作为靶细胞观察对其杀伤效果的影响。本结果显示,IL-21、IL-15+IL-21均能明显增强NK92和Robo1-CAR-NK92细胞的杀伤效果,而IL-15对2种效应细胞的杀伤均无明显影响。IL-21对NK细胞杀伤效果的增强与其促进NK细胞脱颗粒及释放细胞因子有关[31]。
之前有研究报道加用地塞米松能增强细胞因子处理的NK细胞的增殖[33]。本研究中地塞米松联合IL-15和(或)IL-21能明显增强NK92和Robo1-CAR-NK92细胞的增殖和活性,这可能与抑制细胞因子诱导的凋亡有关[33]。但地塞米松联合IL-15和(或)IL-21(除地塞米松+IL-15不影响Robo1-CAR-NK92细胞的杀伤作用外)明显抑制NK92和Robo1-CAR-NK92细胞的杀伤活性,这可能与地塞米松抑制IFN-γ的产生有关[33]。受本研究条件限制,还需在今后的研究中改变添加地塞米松和细胞因子的浓度和时间加以完善。
综上所述,与NK92细胞比,Robo1-CAR-NK92细胞对神经胶质瘤及神经母细胞瘤细胞有更加强大的靶向杀伤作用,并且分泌更多的细胞因子。Robo1可考虑作为CAR-NK92细胞免疫治疗的新靶点。在本试验时间内,IL-15联用地塞米松处理Robo1-CAR-NK92细胞3 d是最有利于Robo1-CAR-NK92细胞的体外增殖的培养方案。



























