
比较注射用紫杉醇(白蛋白结合型)(PAB)(克艾力)与原研药Abraxane用于转移性乳腺癌的生物等效性,探索PAB延长用药的安全性和疗效。
利用生物等效性研究采用随机、两周期、自身交叉对照研究设计(PAB为试验药T,Abraxane为参比药R),受试者随机接受R→T或T→R 2周期治疗(260 mg/m2共21 d);非PD受试者进入延长用药期,均应用试验药(260 mg/m2共21 d)直至疾病进展或毒性不可耐受。
2016年3月1日至5月24日,共纳入40例转移性乳腺癌患者。初始两周期交叉用药的血药浓度—时间曲线和药代动力学参数表明两种制剂为生物等效制剂。试验药与参比药不良反应发生率分别为89.7%、97.4%,其中3/4级不良反应发生率为20.5%、21.1%,两组间差异无统计学意义(P=1.000)。中位用药周期数7(1~23),中位实际用药剂量260 mg/m2(220~260 mg/m2),因毒性反应减低剂量7例(17.5%),均由260 mg/m2降低为220 mg/m2,因毒性反应结束用药22例(55%)。ORR为40%(95% CI, 24.8%~55.2%),解救一线治疗有效率高于非一线治疗(43.8%与25%),既往未接受过紫杉类治疗的患者较接受过患者有效率高(45.5%与37.9%)。中位PFS为49周(95% CI, 30周~NA)。
注射用紫杉醇(白蛋白结合型)(克艾力)与原研药Abraxane是生物等效制剂,其毒性反应及疗效亦与原研药无显著差异,国产药物的研发为中国患者创造了更多的治疗机会。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着对乳腺癌生物学特征的认识不断深入,乳腺癌治疗已进入以分子分型为基础的分类治疗时代。化疗虽然是乳腺癌最传统的全身治疗手段,然而目前无论在肿瘤早期阶段还是复发转移晚期阶段,化疗仍占有非常重要的治疗基石的地位[1]。化疗药物中紫杉类一直发挥着治疗的主导作用[2],然而紫杉醇难溶于水,因此制剂中必须包含助溶剂,助溶剂增加了毒性反应同时降低了疗效。白蛋白结合型紫杉醇(Abraxane,凯素)应运而生,该药利用独特的纳米技术使疏水性紫杉醇与白蛋白结合,无需使用溶剂;利用了白蛋白天然的独特转运机制(gp60-窖蛋白-SPARC),使紫杉醇达到更高的肿瘤细胞内浓度从而提高了疗效[3]。2008年Abraxane获批用于中国转移性乳腺癌患者。
石药集团中奇制药公司研制的注射用紫杉醇白蛋白结合型(PAB)(克艾力)是国内第一批以Abraxane为原研药物开发的化学仿制药,临床前试验显示对多种实体瘤具有抑制作用[4]。经国家食品药品监督管理局批准(临床试验批准号2015L01640),本研究开展了该药物与原研药物用于转移性乳腺癌的生物等效性研究以及延长用药安全性和疗效研究。现将临床研究数据结果报道如下。
(1)女性,年龄18~75岁;(2)经组织学确认的转移性或局部晚期乳腺癌;(3)经研究者判断,适合接受紫杉类药物单药治疗;(4)入组前解救化疗方案数≤2个;(5)至少有一个可测量病灶或者无可测量病灶,根据RECIST1.1标准具有溶骨性或混合性骨病灶的患者;(6)ECOG评分≤2分;(7)预期生存≥3个月;(8)心脏功能基本正常;(9)血常规及肝肾功能主要指标在规定范围内。
(1)既往使用过紫杉类药物且6个月内进展或复发;(2)有未控制的脑转移瘤;(3)距末次化疗时间短于4周,距末次放疗短于4周,距末次内分泌治疗短于2周;(4)既往使用抗肿瘤药物引起的未能恢复的2级及以上毒性;(5)合并严重的内科疾病。
试验药T:PAB,规格100 mg,批号32130602,32150801,32150802,由石药集团中奇制药公司生产并提供;参比药R:Abraxane,规格100 mg,由AbraxisBioScience公司生产,批号:6106172,6109206,6109944,由石药集团中奇制药公司提供。
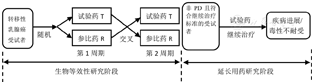
研究采用单剂、盲法、随机、两周期、自身交叉对照研究设计,主要目的是评估注射用紫杉醇(白蛋白结合型)试验药和参比药在乳腺癌患者中的生物等效性,次要目的是评估延长用药的安全性及疗效。本研究分为2个阶段(图1):(1)生物等效性研究阶段:筛选合格后受试者随机进入R→T(第1周期接受R,第2周期接受T)组或T→R(第1周期接受T,第2周期接受R)组,给药2周期,每周期给药剂量为260 mg/m2,静脉滴注30 min,两次用药之间清洗期为21 d。(2)延长用药研究阶段:生物等效性研究用药结束后,两组受试者中非PD(疾病进展)且要求继续用药者,经研究者判断认为符合继续治疗标准的,可以继续使用试验药(260 mg/m2,21 d为1周期),直至疾病进展或出现不可耐受毒性。延长用药阶段如患者出现严重中性粒细胞减少(NEUT<0.5×109/L持续≥1周)或出现严重感觉神经毒性则将后续疗程的治疗剂量减至220 mg/m2;如再次出现上述严重毒性则将后续治疗剂量再次减至180 mg/m2;对于出现3级感觉神经毒性的患者应暂停给药,待神经毒性恢复至≤2级后方可继续治疗,并在后续治疗中降低剂量。临床试验进行前研究方案经医院伦理委员会批准,患者在筛选前充分了解试验相关内容并在知情同意书上签字。

将Cmax、药时曲线下面积(AUC)0-t和AUC0-∞经对数转换后进行方差分析(ANOVA)。方差分析模型中顺序、药物、周期作为固定效应,受试者(顺序)作为随机效应。计算Cmax、AUC0-t、AUC0-∞几何均值比率(试验药/参比药)的90%置信区间,进行等效性比较,等效标准为80%~125%。同时进行双单侧t检验分析,进行等效性评价。
对接受至少1个疗程治疗的患者均进行不良反应评价,在基线期和每次用药后进行。包括不良事件、生命体征和其他实验室检查(血、尿常规、血生化、心电图),以及因安全性或耐受性原因而提前退出的情况。提前退出的患者应在退出前进行安全性评价,并在随访期每3个月进行一次安全性评价直至疾病进展或死亡。根据NCI-CTCAE4.0标准对不良反应进行分级。
主要疗效指标为无进展生存期(PFS)。次要指标是客观缓解率(ORR)。对接受至少1个疗程治疗的患者进行疗效评价。患者在基线期进行一次肿瘤评估,治疗期每2个周期进行一次疗效评估;随访期(适用于不可耐受试验药毒性,结束治疗的患者,直至疾病进展或死亡)每3个月进行一次疗效评估。以RECIST1.1标准进行疗效评价。完全缓解(CR):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10 mm;部分缓解(PR):靶病灶直径之和比基线水平减少至少30%;疾病进展(PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照),除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展);疾病稳定(SD):介于PR与PD两者之间。
疗效和安全性分析采用描述性统计以及配对χ2检验。药代动力学参数计算采用非房室模型,生物等效分析采用方差分析和双单侧t检验。药动学参数计算由WinNonlin 6.4完成,其余分析由SAS 9.4软件完成。
本研究于2016年3月1日至5月24日期间共纳入来自4个研究中心的40例受试者,年龄[中位数(范围)] 53岁(28,71),40例中来自解放军三○七医院14例、河北医科大学第四医院20例、湖南省肿瘤医院4例、复旦大学附属肿瘤医院2例。基线特征为ECOG评分0分29例(72.5%)、1分11例(27.5%)、2分0例(0.0);绝经前16例(40.0%)、绝经后24例(60.0%);既往有蒽环类治疗29例(72.5%)、无11例(27.5%);既往有紫杉类治疗29例(72.5%)、无11例(27.5%);入组前解救化疗线数为0者32例(80.0%)、为1者4例(10.0%)、为2者4例(10.0%)。完成生物等效性阶段研究37例,纳入生物等效性分析36例。进入延长用药期受试者36例,因无法耐受不良反应终止治疗22例,用药至疾病进展12例,统计分析时仍在用药2例。所有受试者均纳入安全性分析和疗效分析。中位用药周期数7(1~23),中位实际用药剂量260 mg/m2(220~260 mg/m2),因不良反应减低剂量7例(17.5%),均由260 mg/m2降低为220 mg/m2,因不良反应结束用药22例(55%)。
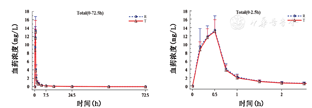
36例乳腺癌受试者总紫杉醇及游离紫杉醇的平均药-时曲线分别见图2,图3,总紫杉醇及游离紫杉醇的药代动力学参数,表1,表2。
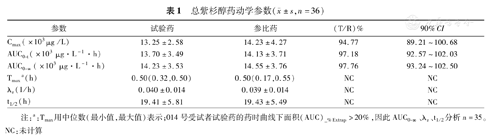
总紫杉醇药动学参数( ±s,n=36)
±s,n=36)
总紫杉醇药动学参数( ±s,n=36)
±s,n=36)
| 参数 | 试验药 | 参比药 | (T/R)% | 90%CI |
|---|---|---|---|---|
| Cmax(×103μg /L) | 13.25±2.58 | 14.23±4.27 | 94.77 | 89.21~100.68 |
| AUC0-t(×103 μg·L-1·h) | 13.70±3.49 | 14.13±3.71 | 97.18 | 92.57~102.03 |
| AUC0-∞(×103 μg·L-1·h) | 14.23±3.53 | 14.55±3.76 | 97.76 | 93.24~102.50 |
| Tmaxa(h) | 0.50(0.32,0.50) | 0.50(0.17,0.55) | NC | NC |
| λz (1/h) | 0.040±0.014 | 0.039±0.014 | NC | NC |
| t1/2(h) | 19.41±5.81 | 19.43±5.49 | NC | NC |
注:a:Tmax用中位数(最小值,最大值)表示;014号受试者试验药的药时曲线下面积(AUC)_%Extrap>20%,因此AUC0-∞、λz、t1/2分析n=35。NC:未计算
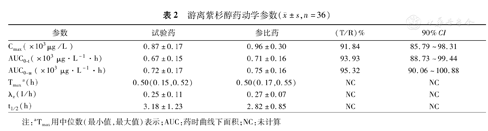
游离紫杉醇药动学参数( ±s,n=36)
±s,n=36)
游离紫杉醇药动学参数( ±s,n=36)
±s,n=36)
| 参数 | 试验药 | 参比药 | (T/R)% | 90%CI |
|---|---|---|---|---|
| Cmax(×103μg /L ) | 0.87±0.17 | 0.96±0.30 | 91.84 | 85.79~98.31 |
| AUC0-t(×103 μg·L-1·h) | 0.67±0.15 | 0.71±0.16 | 93.93 | 88.73~99.44 |
| AUC0-∞(×103 μg·L-1·h) | 0.72±0.17 | 0.75±0.16 | 95.32 | 90.06~100.88 |
| Tmaxa (h) | 0.50(0.15,0.52) | 0.50(0.17,0.55) | NC | NC |
| λz(1/h) | 0.25±0.11 | 0.27±0.07 | NC | NC |
| t1/2(h) | 3.18±1.23 | 2.82±0.85 | NC | NC |
注:aTmax用中位数(最小值,最大值)表示;AUC:药时曲线下面积;NC:未计算
 ±s,n=36)
±s,n=36)
 ±s,n=36)
±s,n=36)
 ±s,n=36)
±s,n=36)
 ±s,n=36)
±s,n=36)试验药与参比药,总紫杉醇的Cmax、AUC0-t及AUC0-∞几何均值比值的点估计和90%的置信区间分别为94.77%(89.21%~100.68%)、97.18%(92.57%~102.03%)和97.76%(93.24%~102.50%);游离紫杉醇的Cmax、AUC0-t及AUC0-∞几何均值比值的点估计和90%的置信区间分别为91.84%(85.79%~98.31%)、93.93%(88.73%~99.44%)和95.32%(90.06~100.88),均在80%~125%范围内,表明两种制剂为生物等效制剂。
在初始两周期交叉用药阶段,39例使用试验药的受试者中,有36例(92.3%)发生了不良事件,判定为不良反应的有35例(89.7%);38例使用参比药的受试者中,有37例(97.4%)发生了不良事件,判定为不良反应的有37例(97.4%)。生物等效性研究未完成(未进行第2周期给药)受试者3例,脱落率为7.5%,脱落原因为发生不良事件或严重不良事件,具体情况如下:002号受试者为第1周期应用试验药后出现纳差3级,体重降低2级,延长给药时间超过14 d未恢复退出试验(未使用参比药);036号受试者为第1周期应用参比药后发生全身肌肉酸痛住院治疗,经受试者决定退出试验(未使用试验药);040号受试者为第1周期应用试验药后出现血红蛋白降低4级,延长给药时间超过14 d未恢复退出试验(未使用参比药)。严重不良事件在试验药周期内发生1例(上述040号);在参比药周期内发生了2例:上述036号,以及031号受试者第1周期应用参比药后,PICC管周血栓形成,判定与药物相关性为"无关",继续接受第2周期治疗。
3~4级不良反应在试验药组8例(20.5%),在参比药组8例(21.1%),两组间差异无统计学意义(P=1.000)。其中试验药用药周期发生的3级以上不良反应为中性粒细胞计数降低(15.4%)、白细胞计数降低(7.7%)、血红蛋白降低(2.6%)、疲乏(2.6%)、呕吐(2.6%)等。参比药用药周期发生的3级以上不良反应为中性粒细胞计数降低(15.8%)、白细胞计数降低(5.3%)、肌肉/关节痛(5.3%)、感觉神经病变(2.6%)(表3)。
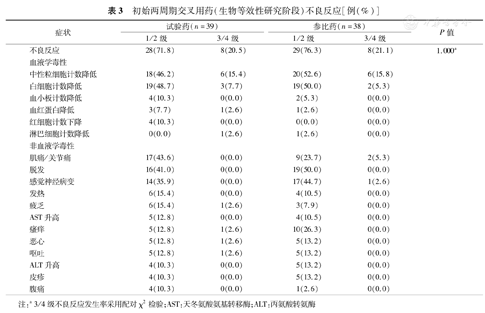
初始两周期交叉用药(生物等效性研究阶段)不良反应[例(%)]
初始两周期交叉用药(生物等效性研究阶段)不良反应[例(%)]
| 症状 | 试验药(n=39) | 参比药(n=38) | P值 | ||
|---|---|---|---|---|---|
| 1/2级 | 3/4级 | 1/2级 | 3/4级 | ||
| 不良反应 | 28(71.8) | 8(20.5) | 29(76.3) | 8(21.1) | 1.000a |
| 血液学毒性 | |||||
| 中性粒细胞计数降低 | 18(46.2) | 6(15.4) | 20(52.6) | 6(15.8) | |
| 白细胞计数降低 | 19(48.7) | 3(7.7) | 19(50.0) | 2(5.3) | |
| 血小板计数降低 | 4(10.3) | 0(0.0) | 2(5.3) | 0(0.0) | |
| 血红蛋白降低 | 3(7.7) | 1(2.6) | 1(2.6) | 0(0.0) | |
| 红细胞计数下降 | 4(10.3) | 0(0.0) | 0(0.0) | 0(0.0) | |
| 淋巴细胞计数降低 | 0(0.0) | 1(2.6) | 1(2.6) | 0(0.0) | |
| 非血液学毒性 | |||||
| 肌痛/关节痛 | 17(43.6) | 0(0.0) | 9(23.7) | 2(5.3) | |
| 脱发 | 16(41.0) | 0(0.0) | 19(50.0) | 0(0.0) | |
| 感觉神经病变 | 14(35.9) | 0(0.0) | 17(44.7) | 1(2.6) | |
| 发热 | 6(15.4) | 0(0.0) | 4(10.5) | 0(0.0) | |
| 疲乏 | 6(15.4) | 1(2.6) | 3(7.9) | 0(0.0) | |
| AST升高 | 5(12.8) | 0(0.0) | 4(10.5) | 0(0.0) | |
| 瘙痒 | 5(12.8) | 1(2.6) | 10(26.3) | 0(0.0) | |
| 恶心 | 5(12.8) | 1(2.6) | 5(13.2) | 0(0.0) | |
| 呕吐 | 5(12.8) | 1(2.6) | 5(13.2) | 0(0.0) | |
| ALT升高 | 4(10.3) | 0(0.0) | 5(13.2) | 0(0.0) | |
| 皮疹 | 4(10.3) | 0(0.0) | 5(13.2) | 0(0.0) | |
| 腹痛 | 4(10.3) | 0(0.0) | 1(2.6) | 0(0.0) | |
注:a 3/4级不良反应发生率采用配对χ2检验;AST:天冬氨酸氨基转移酶;ALT:丙氨酸转氨酶
两周期交叉用药+延长用药发生率>20%的不良反应包括白细胞计数降低、中性粒细胞计数降低、感觉神经病变、脱发、瘙痒、AST升高、乏力、ALT升高、肌痛、恶心、腹部不适、呕吐、贫血、发热、皮疹、关节痛、肢体疼痛、食欲下降,除中性粒细胞计数降低外均以1~2级为主(图4)。
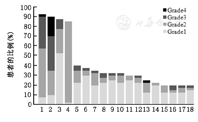

注:1:白细胞计数降低,2:中性粒细胞计数降低,3:感觉神经病变:4:脱发,5:瘙痒,6:丙氨酸氨基转氨酶,7:乏力,8:天冬氨酸氨基转氨酶,9:肌痛,10:恶心,11:腹部不适,12:呕吐,13:血红蛋白降低(贫血),14:发热,15:皮疹,16:关节痛,17:肢体疼痛,18:食欲下降
对40例接受了≥1个周期治疗的受试者,按照RECIST1.1标准进行疗效评价。CR 1例,PR 15例(37.5%),SD 22例,PD 1例,NE 1例;客观缓解率(ORR)( CR+PR共16例)为40%(95% CI, 24.8%~55.2%),进一步分析显示注射用紫杉醇(白蛋白结合型)作为解救一线治疗(14/32)有效率高于非一线治疗(二或三线)(2/8)(43.8%与25%),既往未接受过紫杉类治疗的患者(5/11)较接受过患者(11/29)有效率高(45.5%与37.9%)。中位PFS为49周(95% CI, 30周~NA)。
肿瘤治疗决策正经历从循证医学向精准医学迈进的历程[5]。精准测序可从患者肿瘤基因层面对病情进行深入分析,应用更具针对性的分子靶向药物,但目前尚未成熟,对于指南推荐的以化疗为基础的标准方案无法取而代之[6],因此,积极研发适用于中国乳腺癌患者的国产药物为患者创造了更多的治疗机会。
石药集团研制的注射用紫杉醇(白蛋白结合型)(克艾力)是Abraxane的化学仿制药,2013年完成了临床前研究。在小鼠肝癌H22、前列腺癌RM-1和Lewis肺癌实体肿瘤模型中探讨了仿制药和原研药的药效学异同,试验结果显示仿制药对肿瘤的抑制作用与原研药差异无统计学意义[4]。本研究评估了石药集团注射用紫杉醇(白蛋白结合型)与原研药Abraxane用于晚期乳腺癌患者的生物等效性,结果表明两种制剂为生物等效制剂。
本研究安全性数据显示初始两周期交叉用药过程中,3~4级不良反应发生率试验药组为20.5%,参比药组为21.1%,两组间差异无统计学意义(P=1.000)。两周期交叉用药+延长用药发生率>20%的毒性反应除中性粒细胞计数降低外均以轻度为主。这一结果与原研药Abraxane研究结果一致[7]。
原研药Abraxane治疗转移性乳腺癌ORR为48% (95% CI, 35.3%~60.0%),中位TTP时间为26.6周,中位OS为63.6周[7];Abraxane与Paclitaxel对比研究[8]显示Abraxane有效率显著高于Paclitaxel(33% vs 19%, P=0.001),TTP显著延长(23.0与16.9周,HR=0.75; P=0.006)。Abraxane治疗中国实体瘤患者研究[9]表明ORR为38%。本研究结果显示ORR为40%(95% CI,24.8%~55.2%),一线治疗有效率高于非一线治疗(43.8%与25%),未接受过紫杉类治疗有效率高于接受过的患者(45.5% vs 37.9%),中位PFS为49周(95% CI,30周-NA)。
石药集团白蛋白结合型紫杉醇(克艾力)与原研药Abraxane具有生物等效性,并且在安全性以及疗效方面与Abraxane相似,支持该药进一步进行Ⅲ期临床研究,以获得更多该药用于晚期乳腺癌的疗效与安全性数据,并开展与化疗[10]、靶向药物[11]、肿瘤免疫药物[12]等不同方向的联合治疗研究,以卓越的治疗效果造福于中国乃至全球的乳腺癌患者。



























