
探讨血清25-羟维生素D[25(OH)D]水平与女性特发性良性阵发性位置性眩晕(BPPV)之间的相关性。
选取2016年1至12月在宁波市第二医院神经内科诊治的67例女性特发性BPPV患者作为研究对象,同期选取95例无眩晕/头晕病史的健康女性作为对照组。收集所有研究对象的身高、体重、疾病史等临床资料,并测定血清25(OH)D的浓度。BPPV患者随访1年,记录期间复发以及复位次数。
BPPV组与对照组年龄、体质指数及高血压、糖尿病患病比例差异均无统计学意义(均P>0.05)。BPPV组血清25(OH)D (50.56±13.36)nmol/L,低于对照组的(56.55±16.21)nmol/L,差异有统计学意义(t=-2.485,P=0.014)。血清25(OH)D水平低的BPPV患者,其复发频率高,所需复位次数多。多因素logistic回归分析显示25(OH)D缺乏和BPPV发病相关(OR=2.054,95%CI:1.088~3.877,P=0.026)。
25(OH)D缺乏可能与女性BPPV发病相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
良性阵发性位置性眩晕(benign paroxysmal positional vertigo, BPPV),又称"耳石症",是由头部位置变动所诱发的短暂的发作性眩晕,在前庭周围性疾病中最为常见,占17%~30%[1]。BPPV的发病率随年龄增长呈上升趋势,18~39岁人群年发病率为0.7%,而60岁以上人群年发病率升至3.4%。BPPV好发于女性,男女比例为1∶1.5~1∶2.0[2]。BPPV最有效的治疗方法是耳石复位,但其很容易复发,2年复发率10%~43%,5年复发率高达50%[1,2]。
BPPV的发病机制尚不明确,普遍认为从耳石床脱落的耳石进入半规管,在头部运动时其刺激壶腹嵴前庭毛细胞,而出现眩晕发作。前庭神经元炎、梅尼埃病、特发性耳聋、药物、头部外伤、内耳手术等均可诱发BPPV,但仍有50%~70%的BPPV病因不明,称为特发性[1,2,3]。近年来研究发现BPPV患者中骨质疏松发生率和维生素D缺乏率远高于正常人群,且抗骨质疏松治疗或纠正维生素D缺乏可降低BPPV的复发率,提示钙离子代谢紊乱可能是BPPV发病的潜在机制[3,4,5,6,7,8]。目前国内尚缺乏有关维生素D和BPPV的相关性研究报道。
本课题组前期研究发现女性特发性BPPV患者的骨量减少、骨质疏松发生率和维生素D缺乏率显著高于健康人群[9]。本研究对女性BPPV患者进行随访,回顾性分析血清25-羟维生素D[25-hydroxyvitamin D, 25(OH)D]水平与BPPV复发和耳石复位情况的临床相关性,为BPPV的综合诊治提供新的思路。
选择2016年1至12月在宁波市第二医院神经内科就诊,临床诊断符合特发性BPPV的女性患者作为研究对象。纳入标准:(1)符合2006年中华医学会耳鼻咽喉科学分会制订的BPPV的诊断依据和疗效评估的诊断标准[10];(2)复位治疗后能痊愈;(3)随访期间未服用各类钙片、维生素D等药物。另外同期从体检中心选择年龄与BPPV组相匹配的健康女性作为正常对照。纳入标准:(1)无眩晕/头晕病史;(2)有血25(OH)D检测结果。排除标准:(1)BPPV患者不能或拒绝复位治疗或复位治疗无效者;(2)有偏头痛、梅尼埃病、前庭神经元炎、迷路炎、头部外伤、内耳手术等病史者;(3)既往或目前口服激素、抗骨质疏松药物等影响血维生素D水平者;(4)有慢性肾功能衰竭、慢性肝脏疾病、肾病综合征等重要脏器病变者;(5)行动不便或拒绝参与者。依据纳入和排除标准筛选研究对象,记录其年龄、身高、体重和血压,服药及疾病史情况。
BPPV患者依据半规管受累的类型,选择相应的耳石复位方法[1]。其中后半规管BPPV及多管BPPV采用Epley法复位,水平半规管BPPV采用Barbecue或Gufoni法复位,前半规管BPPV采用反向Epley法复位,1周后复诊评定复位效果。此后在第1、3、6、9和12个月进行电话随访。随访期间,如出现眩晕/头晕发作,及时就诊,由经验丰富的医师行体位诱发试验检查,且2次症状发作至少间隔1个月以上,则确认为复发,给予相应的耳石复位治疗,并记录患者症状发作至就诊的时间、受累半规管类型、复位次数以及复发次数。
清晨空腹抽血,离心机分离血清;采用美国应用生物系统公司生产的API3200质谱仪测定血25(OH)D水平。根据2011年美国内分泌学会标准[11]将25(OH)D营养状况分为4组:25(OH)D≥75 nmol/L为充足,50~75 nmol/L为不足,<50 nmol/L为缺乏,≤25 nmol/L为严重缺乏。
应用SPSS 21.0软件进行统计学分析。计量资料符合正态分布采用 ±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用Bonferroni法校正检验水准。计数资料采用例数和百分率进行描述,组间比较采用χ2检验。多因素分析采用二分类logistic回归模型。均为双侧检验,P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用Bonferroni法校正检验水准。计数资料采用例数和百分率进行描述,组间比较采用χ2检验。多因素分析采用二分类logistic回归模型。均为双侧检验,P<0.05为差异有统计学意义。
2016年1至12月期间符合纳入标准的女性特发性BPPV患者共107例,其中5例因耳石复位效果差,7例因失访,28例因接受钙尔奇、骨化三醇等治疗而未纳入研究。最终有67例女性特发性BPPV患者纳入本研究,其中后半规管45例,水平半规管20例,前半规管1例,多半规管1例。在1年的随访期间,共有17例BPPV患者复发,复发率为25.4% (17/67)。依据BPPV复发情况,BPPV组分为复发组和未复发组。BPPV复发组、未复发组和正常对照组年龄、体质指数以及高血压、糖尿病患病比例差异均无统计学意义(均P>0.05,表1)。
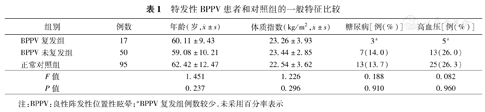
特发性BPPV患者和对照组的一般特征比较
特发性BPPV患者和对照组的一般特征比较
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 体质指数(kg/m2, ±s) ±s) | 糖尿病[例(%)] | 高血压[例(%)] |
|---|---|---|---|---|---|
| BPPV复发组 | 17 | 60.11±9.43 | 23.26±3.93 | 3a | 5a |
| BPPV未复发组 | 50 | 59.08±10.21 | 23.44±2.85 | 7(14.0) | 13(26.0) |
| 正常对照组 | 95 | 62.42±12.47 | 22.54±3.62 | 13(13.7) | 25(26.3) |
| F值 | 1.451 | 1.226 | 0.188 | 0.082 | |
| P值 | 0.237 | 0.296 | 0.910 | 0.960 |
注:BPPV:良性阵发性位置性眩晕;aBPPV复发组例数较少,未采用百分率表示
BPPV组和正常对照组血清25(OH)D分别为(50.56±13.36) nmol/L和(56.55±16.21) nmol/L,两组比较差异有统计学意义(t=-2.485,P=0.014)。BPPV组中血清25(OH)D缺乏率为56.72%(38/67),高于对照组的38.95%(37/95),差异有统计学意义(χ2=4.195,P=0.041)。多因素logistic回归分析显示25-羟维生素D缺乏与BPPV发病相关(OR=2.054,95%CI:1.088~3.877,P=0.026)。
17例复发患者中,复发1次者11例,复发2次者4例,复发3次和4次者各1例。25(OH)D在未复发、复发1次和复发2次以上的3个亚组分别为(54.32±12.11) nmol/L、(43.29±10.16) nmol/L和(32.54±8.11) nmol/L,组间差异有统计学意义(F=12.113,P<0.001)。3个亚组间两两比较,未复发亚组和复位1次及复位2次以上亚组分别比较,差异有统计学意义(P=0.017、P<0.001)。25(OH)D水平与复发次数间呈负相关(r=-0.488,P<0.001)。
BPPV患者平均需接受1.48次耳石复位治疗可使临床痊愈,其中44例复位1次,16例复位2次,5例复位3次以及2例复位4次。25(OH)D在复位1次、2次和2次以上的3个亚组中分别为(55.09±12.71) nmol/L、(44.67±8.64) nmol/L和(35.57±10.70) nmol/L,组间差异有统计学意义(F=11.07,P<0.001)。3个亚组间两两比较,复位1次亚组和复位2次及2次以上亚组分别比较,差异有统计学意义(P=0.010、P<0.001)。25(OH)D与复位次数之间呈负相关(r=-0.501,P<0.001)。
耳石是位于内耳椭圆囊斑和球囊斑上的位置觉感受器,由含钙离子的碳酸盐晶体和有机质的糖蛋白、脂蛋白组成。哺乳动物的耳石在胚胎期形成,出生后已发育成熟,此后不再生长及再生,但易受外界因素的影响[12]。生理状态下,耳石出现和年龄相关的退行性变。和成年大鼠相比,老年大鼠的耳石出现更多的凹痕、裂隙及碎裂,且碎裂的耳石之间仅以纤维丝连接[13]。
耳石是内耳中重要的钙离子存储库,参与内淋巴中钙离子的调控。耳石在矿化过程中,内淋巴液中的钙离子浓度则相应的升高;而在其他生理状态下,内淋巴液中的钙离子浓度则维持在低水平,可避免其他部位不必要的矿化。耳石的吸收与内淋巴液的低钙有关[14]。在哺乳动物的半规管中有瞬时受体阳离子通道亚家族V成员5、钙结合蛋白D9k和D28k等多种钙离子通道分布。维生素D通过调控内耳中相关钙离子通道的活性,进而影响内淋巴中钙离子的浓度[15]。维生素D受体基因敲除的小鼠会出现头位偏斜及身体侧滚等平衡功能受损相关表现[16]。临床研究报道显示维生素D缺乏的人群,其前庭诱发肌电位的异常率很高,提示维生素D缺乏可导致耳石器的功能障碍[17]。
2013年Jeong等[3]最早报道BPPV患者血25(OH)D水平显著低于健康人群,多因素分析揭示低25(OH)D是BPPV发病的独立相关因素。此后陆续有维生素D和BPPV致病关系的报道。Talaat等[4]报道BPPV患者血维生素D低于健康人群,且症状复发的BPPV患者血维生素D水平更低。Kahraman等[18]发现BPPV患者发作期的血维生素D水平显著低于BPPV症状缓解期。Büki等[5]报道BPPV患者血维生素D水平与健康人群相似,而补充维生素D可减少BPPV复发次数。然而也有研究报道BPPV患者维生素D水平和健康人群无明显差异,维生素D水平与BPPV致病并不存在相关性[19,20]。相关研究结论不一致,分析原因可能与研究中BPPV复发的定义、随访时间、维生素D检测方法以及研究对象在性别和年龄方面的差异等有关。此外维生素D水平亦受纬度、年龄、性别、季节、激素水平、营养状态、生活习惯和伴发疾病影响[21]。既往研究并未完全考虑上述因素,造成其研究结论不甚一致。
本研究为排除混杂因素的影响,选择1个整年度的女性BPPV患者为研究对象,同时从相应的月份选择来自本地区的年龄相匹配的健康女性为健康对照。另外两组在体质指数、年龄分布、罹患高血压和糖尿病方面有可比性。本组67例女性特发性BPPV患者在1年的随访中共有17例复发,复发率为25.4%,其中11例复发1次,4例复发2次,1例复发3次,1例复发4次,共有26人次复发。本研究发现,BPPV患者血清25(OH)D低于正常对照组,和既往研究结论相一致。并且血25(OH)D水平越低的BPPV患者,其复发的次数以及每次所需的耳石复位的次数更多,提示低25(OH)D可能与BPPV发病存在相关性。
维生素D具有广泛的生物学作用,可影响钙磷代谢,调节激素分泌和细胞增生与分化,影响免疫功能,与多种疾病的发生发展密切相关[21,22]。临床回顾性研究发现抗骨质疏松治疗可降低BPPV在女性骨质疏松人群中的发病率。小样本的临床研究证实,维生素D缺乏的BPPV患者,补充维生素D治疗后,不仅头晕症状明显减轻,而且BPPV的复发率显著下降[5,7,8,23]。本研究中部分骨密度降低和或维生素D缺乏的BPPV患者选择了相应的药物治疗,我们将后续报道药物治疗对BPPV的影响。
总之,BPPV患者中血25(OH)D水平低于正常人群,且血25(OH)D水平与BPPV复发次数以及所需复位次数存在负相关。但是本研究仅以女性BPPV为研究对象,样本量有限,结果可能存在差异,后期需要大样本、多中心研究进一步阐明血25(OH)D水平与BPPV的关系,为BPPV的综合诊治提供新的思路。



























