
探讨动态牵拉显微神经外科手术治疗内侧型小脑幕脑膜瘤的疗效和临床意义。
对重庆医科大学附属第一医院神经外科从2011年1月至2016年12月显微神经外科手术治疗28例内侧型小脑幕脑膜瘤的临床资料进行回顾性分析。将2011年1月至2013年12月所有术中采用牵开器牵拉手术的患者分为常规牵拉组,将2014年1月至2016年12月所有术中采用动态牵拉手术的患者分为动态牵拉组。手术入路的设计取决于肿瘤的主体位置。肿瘤切除程度采用Simpson肿瘤切除分级标准。分析和比较两组患者肿瘤大小、手术时间、住院时间、脑牵拉损伤、肿瘤Simpson切除程度以及术后6个月KPS评分。
共12例患者(常规牵拉组)术中采用脑自动牵开器手术,16例患者(动态牵拉组)术中采用了动态牵拉手术。两组患者在性别、年龄、肿瘤大小、手术时间及肿瘤Simpson切除程度方面的差异均无统计学意义(均P>0.05)。平均住院时间动态牵拉组小于常规牵拉组(分别为18.3 d±1.8 d、20.2 d±1.3 d,P=0.004);动态牵拉组术后脑牵拉损伤并发症发生比例显著低于常规牵拉组(分别为1/16及6/12,P=0.022);术后6个月神经功能恢复比例(KPS>80分)动态牵拉组显著高于常规牵拉组(分别为14/16及5/12,P=0.017)。
动态牵拉显微神经外科手术治疗内侧型小脑幕脑膜瘤是可行的,并能避免或减少脑自动牵开器的使用,降低术后神经损伤和并发症的风险,减少住院费用和改善患者预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
小脑幕脑膜瘤是相对少见的颅内肿瘤,大约占所有颅内肿瘤的5%。由于其位置深且周围有重要的神经血管结构,小脑幕脑膜瘤的显微手术对神经外科医师来说依然是一项巨大的挑战任务,术后可能带来严重的神经损伤和并发症[1,2]。根据肿瘤基底与小脑幕的关系,Gokalp等[3]提出将小脑幕脑膜瘤分为内侧型、外侧型和镰幕型,其中内侧型相当于Yasargil[4]提出的内环型T1~T2组,其肿瘤基底起源于小脑幕裂缘。本研究回顾性纳入重庆医科大学附属第一医院神经外科2014年1月至2016年12月收治的28例内侧型小脑幕脑膜瘤患者,比较了其中采用动态牵拉技术切除肿瘤和采用常规牵拉方法切除肿瘤的患者的临床特点、手术疗效和术后并发症,探讨动态牵拉显微神经外科手术治疗内侧型小脑幕脑膜瘤的疗效和临床意义。
2011年1月至2016年12月重庆医科大学附属第一医院共收治内侧型小脑幕脑膜瘤28例,所有患者都是第1次就诊且术后均通过组织病理学诊断为脑膜瘤。回顾性分析所有患者病例资料、临床和手术记录、影像数据、组织病理学诊断以及随访资料。2011年1月至2013年12月共12例患者术中都采用了脑自动牵开器手术(称为常规牵拉组),12例中男4例,女8例,年龄(53±7)岁;2014年1月至2016年12月共16例患者术中都采用了动态牵拉手术(全程不使用或间断使用牵开器,称为动态牵拉组),16例中男2例,女14例,年龄(51±8)岁。
(1)纳入标准:所有患者为首次手术且术后均通过组织病理学检查确诊为脑膜瘤;结合Gokalp和Yasargil提出的小脑幕脑膜瘤分型,术前头颅增强MRI检查确定为内侧型(T1/T2)小脑幕脑膜瘤(图1A,B);所有肿瘤主体绝大部分位于幕下的患者采用枕下乙状窦后入路,其余患者均采用颞下入路。(2)排除标准:非首次手术患者;术前头增强MRI影像检查确定为外侧型、镰幕型小脑幕脑膜瘤或其他部位脑膜瘤;采用除颞下入路和枕下乙状窦后入路其他手术入路者。
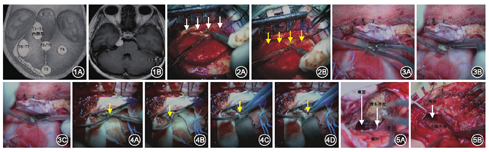

(1)影像检查:所有患者术前常规行头颅增强MRI检查,术后复查头颅增强MRI观察肿瘤切除程度,术后6个月复查头颅增强MRI观察有无肿瘤复发。(2)手术入路:手术入路的设计取决于肿瘤的主体位置。对于肿瘤主体绝大部分位于幕下的内侧型小脑幕脑膜瘤患者采用枕下乙状窦后入路,其余患者均采用颞下入路。(3)手术方法:为了增加术中暴露,常规牵拉组患者术中全程使用了脑自动牵开器,而对于动态牵拉组患者,术中全程未使用脑自动牵开器或间断使用脑自动牵开器。①颞下入路:患者均采取侧卧位,设计"马蹄形"切口。开颅时尽量磨平岩骨嵴的骨质,使手术入路平行于颅底进入(图2A,B)。打开硬膜后,若脑组织压力高,采用甘露醇和(或)速尿、过度换气、抬高头位等方式来降低颅内压。其次,对于肿瘤体积较小的内侧型小脑幕脑膜瘤,术中可以打开位于肿瘤前极和(或)后极的环池,释放脑脊液使脑组织松弛,进一步增加暴露空间(图3A~C)。对于肿瘤体积较大的内侧型小脑幕脑膜瘤术前可安置腰大池引流,术中缓慢释放50~70 ml脑脊液来降低颅内压和松弛脑组织张力。当轻轻将颞叶抬离颞窝时,常会看到由颞叶底面向颅底引流的静脉。对于这些静脉,对其两端进行游离,汇入硬膜端游离3~5 mm,脑组织端游离2~3 mm,以求增加术中术者安全牵拉颞底的程度和避免因牵拉损伤汇入颅底的静脉(图4A~D)。术中放置2~3张海绵绵条于脑组织表面,通过调节患者术中体位,利用海绵绵条的重量、摩擦力以及脑组织自身的重量使脑组织脱离颞底。然后再逐步烧灼分离肿瘤在小脑幕上的基底,逐步分块切除肿瘤。②枕下乙状窦后入路:患者均采取侧俯卧位,患者上肩用胶带向后向下牵拉,设计耳后"S"形切口。打开硬膜前,尽量磨平乙状窦后外侧、横窦下方边缘的骨质增加暴露。术中首先打开枕大池侧方缓慢释放脑脊液,待小脑半球张力降低后切开硬膜。打开硬膜后,同样放置2~3张海绵绵条于小脑外侧表面,通过调节患者术中体位,利用海绵绵条的重量、摩擦力以及脑组织自身的重量使小脑外侧表面脱离后颅窝外侧面硬膜,然后打开桥小脑角池缓慢释放脑脊液,继续降低颅内压,松弛脑组织。对于两组手术入路,动态牵拉组在术中操作时,将显微操作器械如吸引器、双极电凝,显微剪刀等作为动态牵开器使用,从而避免或减少了脑自动牵开器的使用,术毕见脑组织保护完好(图5A,B)。
所有数据使用SPSS 22.0软件进行分析,计量资料以 ±s表示,计量资料差异统计学意义检验采用t检验,计数资料采用Fisher精确概率法检验,以P<0.05为差异有统计学意义。
±s表示,计量资料差异统计学意义检验采用t检验,计数资料采用Fisher精确概率法检验,以P<0.05为差异有统计学意义。
两组患者术前常见的症状是头痛、头晕,其次是面部麻木、面部疼痛和小脑共济失调(表1)。
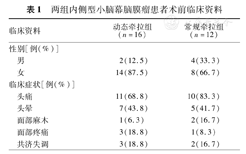
两组内侧型小脑幕脑膜瘤患者术前临床资料
两组内侧型小脑幕脑膜瘤患者术前临床资料
| 临床资料 | 动态牵拉组(n=16) | 常规牵拉组(n=12) | |
|---|---|---|---|
| 性别[例(%)] | |||
| 男 | 2(12.5) | 4(33.3) | |
| 女 | 14(87.5) | 8(66.7) | |
| 临床症状[例(%)] | |||
| 头痛 | 11(68.8) | 10(83.3) | |
| 头晕 | 7(43.8) | 5(41.7) | |
| 面部麻木 | 1(6.3) | 2(16.7) | |
| 面部疼痛 | 3(18.8) | 1(8.3) | |
| 共济失调 | 3(18.8) | 2(16.7) | |
动态牵拉组中肿瘤主体位于幕下有6例,全部采用枕下乙状窦后入路,位于幕上有10例,全部采用颞下入路;常规牵拉组中肿瘤主体位于幕下有5例,全部采用枕下乙状窦后入路,位于幕上有7例,全部采用颞下入路,两组患者手术入路比较差异无统计学意义(表2)。
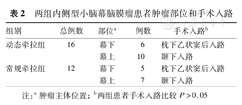
两组内侧型小脑幕脑膜瘤患者肿瘤部位和手术入路
两组内侧型小脑幕脑膜瘤患者肿瘤部位和手术入路
| 组别 | 总例数 | 部位a | 例数 | 手术入路b |
|---|---|---|---|---|
| 动态牵拉组 | 16 | 幕下 | 6 | 枕下乙状窦后入路 |
| 幕上 | 10 | 颞下入路 | ||
| 常规牵拉组 | 12 | 幕下 | 5 | 枕下乙状窦后入路 |
| 幕上 | 7 | 颞下入路 |
注:a肿瘤主体位置;b两组患者手术入路比较P>0.05
两组患者在性别、年龄、肿瘤大小、手术时间及肿瘤Simpson切除程度方面的差异均无统计学意义(均P>0.05)。平均住院时间动态牵拉组小于常规牵拉组(分别为18.3 d±1.8 d、20.2 d±1.3 d,P=0.004) ;动态牵拉组术后脑牵拉损伤并发症发生比例显著低于常规牵拉组(分别为1/16、6/12,P=0.022);术后6个月神经功能恢复比例(KPS>80分)动态牵拉组显著高于常规牵拉组(分别为14/16、5/12,P=0.017)。术后经头颅增强MRI证实,动态牵拉组肿瘤SimpsonⅠ~Ⅱ级切除10例,Simpson Ⅲ~Ⅳ级切除6例,常规牵拉组肿瘤SimpsonⅠ~Ⅱ级切除7例,Simpson Ⅲ~Ⅳ级切除5例,差异无统计学意义(表3)。
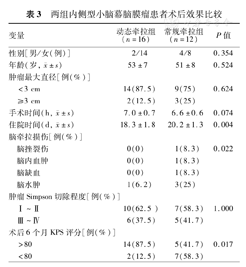
两组内侧型小脑幕脑膜瘤患者术后效果比较
两组内侧型小脑幕脑膜瘤患者术后效果比较
| 变量 | 动态牵拉组(n=16) | 常规牵拉组(n=12) | P值 | |
|---|---|---|---|---|
| 性别[男/女(例)] | 2/14 | 4/8 | 0.354 | |
年龄(岁, ±s) ±s) | 53±7 | 51±8 | 0.524 | |
| 肿瘤最大直径[例(%)] | ||||
| <3 cm | 14(87.5) | 9(75) | 0.624 | |
| ≥3 cm | 2(12.5) | 3(25) | ||
手术时间(h,  ±s) ±s) | 7.0±0.7 | 6.6±0.6 | 0.074 | |
住院时间(d,  ±s) ±s) | 18.3±1.8 | 20.2±1.3 | 0.004 | |
| 脑牵拉损伤[例(%)] | ||||
| 脑挫裂伤 | 0(0) | 1(8.3) | 0.022 | |
| 脑内血肿 | 0(0) | 1(8.3) | ||
| 脑缺血 | 0(0) | 1(8.3) | ||
| 脑水肿 | 1(6.2) | 3(25) | ||
| 肿瘤Simpson切除程度[例(%)] | ||||
| Ⅰ~Ⅱ | 10(62.5 ) | 7(58.3) | 1.000 | |
| Ⅲ~Ⅳ | 6(37.5) | 5(41.7) | ||
| 术后6个月KPS评分[例(%)] | ||||
| >80 | 14(87.5) | 5(41.7) | 0.017 | |
| <80 | 2(12.5) | 7(58.3) | ||
常规安排术后3、6个月及每年各随访1次头颅增强MRI,随访时间6~72个月。常规牵拉组有2例在随访6个月后失访。在最近1次随访中,大多数患者术前的神经系统症状明显好转,且能恢复到术前的正常生活水平(KPS>80分)。术后出现新的并发症,包括7例暂时性复视,1例新出现面部麻木,3例新出现小脑共济失调,1例出现肿瘤对侧肢体乏力。有5例肿瘤Simpson Ⅲ~Ⅳ级切除患者术后进行了立体定向放射治疗(伽马刀),目前随访患者无复发。
小脑幕脑膜瘤的显微外科手术位置深,难以到达;其次是其周围有许多重要的神经血管结构环绕[1,2,3,4]。脑自动牵开器的诞生对显微神经外科手术的发展产生了巨大的作用。术中为了得到更好的手术空间,脑自动牵开器常规被神经外科医师用于颅内手术。作为神经外科重要和不可或缺的显微器械,脑自动牵开器,被称为神经外科医师的"第三只手",它能在大多数颅内手术操作中有效的扩大手术视野并且把重要的结构和手术目标暴露在视野中[5]。但是,据报道[6,7],持续的脑组织牵拉能使局部脑血管变形、闭塞,破坏颅内静脉的循环,对周围脑组织造成一定的创伤,增加了牵拉损伤的风险。我们发现,术中用了固定牵开器的小脑幕脑膜瘤患者术后局部脑组织的复张较差,而用动态牵拉的患者术后局部脑组织的复张能取得满意的效果。
动态牵拉手术,首先由Spetzler和Sanai[8]教授提出,他在分析223例脑血管病变和颅底病变的手术中发现,仅仅只有7%的患者术中需要牵开器持续的牵拉脑组织,其余患者都可以采用动态牵拉技术完成,并提出将手持设备,如吸引器、双极电凝、显微剪刀等手术显微器械作为动态牵开器,从而减少了脑自动牵开器的使用。2013年赵继宗和赵连泽[9]首先在国内介绍推广动态牵拉手术。2015年叶迅等[10]报道了动态牵拉技术治疗127例脑血管病及67例颅内肿瘤,对比同期手术,术后并发症和死亡率并未增加,然而脑牵拉伤比例却降低至2%。同期,康德智教授团队报道了动态牵拉技术在颅内动脉瘤的应用[11],前瞻性研究对比分析了采用动态牵拉技术和传统牵拉技术经翼点锁孔入路治疗前交通动脉瘤的手术效果,发现动态牵拉组脑牵拉伤的比例明显低于常规牵拉组,且动态牵拉组术中没有监测到脑组织缺血,然而传统常规牵拉组监测到有近23.1%的患者有一过性的脑组织缺血。从本研究可见,可以得出一个重要的结论:动态牵拉组患者术后比常规牵拉组患者术后有较低牵拉损伤的发生率,并且带来更好的神经功能恢复和生活质量,差异有统计学意义。并且,两组患者相比,动态牵拉组手术时间没有明显延长,但是动态牵拉组患者的住院时间明显较常规牵拉组缩短。
众所周知,脑深部病变的切除,暴露是关键,是增加肿瘤全切率,减少手术副损伤及减少牵开器使用的重要前提。术中在牵拉脑组织前,有许多松弛脑组织增加暴露的操作[12],称之为"无牵拉"暴露,往往能减少牵开器的使用,使对脑组织的任何"牵动"最小化。比如安全充分的磨除颅骨、邻近蛛网膜和脑池的广泛分离,利用脑组织自身重力辅助牵拉,麻醉监护中短暂的过度换气,缓慢或分次释放脑脊液、CUSA瘤内切肿瘤,甚至是手术节奏的掌握,适当等待肿瘤随着脑搏动逐渐娩出,即所谓以时间换取空间。同时,还可以通过旋转手术床与改变显微镜位置的良好配合来进一步增加暴露。Raheja和Couldwell[13]学者提出,通过采用最大限度磨除颅骨来增加术区视野的改良手术入路能最大程度的减少对脑组织的操控,并且患者能得到可接受的术后外观形象和神经功能恢复结果。牵开器牵移脑组织,但脑组织有保持原位的张力。如果骨窗没有足够大,牵拉脑组织时由于骨质的遮挡会对脑组织形成压迫。在采用颞下入路切除内侧型小脑幕脑膜瘤时,本组病例常规的磨除岩骨嵴,采用枕下乙状窦后入路时,尽量安全的向骨窗外上磨除横窦和乙状窦边缘颅骨,不仅增加了手术视野,而且能减少对脑组织的牵拉需求。术中通过释放脑脊液、分块切除肿瘤等办法来创造手术操作空间。
此外,术区引流静脉的显微解剖不仅可以提供一个更开阔的手术视野,还对利用重力牵拉脑组织起到重要作用。颞下入路术中轻轻将颞叶从颞窝抬起时,往往会有几条或数条由颞叶底面向颅底引流的静脉。在操作深部病变时这些静脉就阻碍了术者的视野。过去,为了建立足够的手术空间或视野,术中操作有时就会牺牲这些静脉。这可能会造成静脉回流障碍,脑水肿,脑淤血性出血等并发症,带来严重的神经损伤。因此,无论何时尝试保护这些静脉是明智且可取的。在动态牵拉显微手术中对于这些静脉,采取的方法是对其两端进行游离,将汇入硬膜端游离3~5 mm,脑组织端游离2~3 mm,不仅开阔了手术视野,而且还增加术中术者安全牵拉颞底的程度和避免因牵拉损伤汇入颅底的静脉。这些静脉往往被一层蛛网膜包裹,使其牵拉很困难,所以对于蛛网膜的解剖剥离会使静脉更容易牵拉延伸。在动态牵拉显微手术组中还充分利用棉片的保护与自然牵引作用,术中通常放置2~3张海绵绵条于脑组织表面,通过调节患者术中体位,利用海绵绵条的重量、摩擦力以及脑组织自身的重量使脑组织脱离颞底(采用颞下入路时),或使小脑外侧表面脱离后颅窝外侧面硬膜(采用枕下乙状窦后入路时),术中无需脑自动牵开器或脑压板的额外牵拉。并且,由于明胶海绵具有收缩膨胀的变形能力,在一些狭窄的空间可以作为一种"微牵开器",与脑自动牵开器相比,其优点在于对脑组织表面不会产生牵拉损伤。
动态牵拉可以降低由于长时间使用脑自动牵开器可能导致的脑损伤发生概率,本研究并不是一味盲目的追求不用脑自动牵开器,而是术中定时松开牵开器,在相同的暴露范围下减少脑牵拉的时间,最大限度的减少创伤。这样做的目的并不是为了重新更重的牵拉脑组织,而是为了暂时缓解对脑组织的牵拉。由于颅底手术的手术视野通常太狭窄,所以在没有牵开器的帮助下很难达到深部病变。原则是,该用牵开器的时候果断用上,不必要用的时候坚决不用。暴露需要操作的地方,不刻意去牵拉或暴露不操作的地方,要逐渐养成习惯于在狭小空间进行显微手术操作。在本研究中动态牵拉组仍然有3例经颞下入路和2例经枕下乙状窦后入路术中短暂的使用了牵开器:颞下入路中有2例患者术中在切开天幕和打开环池前短暂的使用了脑自动牵开器,另外1例患者因为肿瘤较大,在暴露深部肿瘤边界时,由于空间的需要,术中短暂的使用了脑自动牵开器,避免了在进行深部操作时显微器械对周围脑组织的损伤;枕下乙状窦后入路的2例患者都是在开始释放脑脊液减压或肿瘤切除的早期阶段短暂使用了脑牵开器。
总之,动态牵拉显微神经外科手术能避免或减少脑自动牵开器的使用,降低术后神经损伤和并发症的风险,减少住院费用和改善患者预后。



























