
探讨分析肺原发性黏膜相关淋巴组织(MALT)淋巴瘤的临床特征。
回顾性分析2007年5月至2017年5月于复旦大学附属中山医院住院并经病理确诊为肺MALT淋巴瘤的14例患者的临床特点、病理特征、诊断、治疗及预后。
病理取材中4例通过电视辅助胸腔镜手术(VATS),2例通过经皮穿刺肺活检,8例经支气管镜肺穿刺活检。病理检查结果:瘤细胞主要由中心细胞样淋巴细胞、小淋巴细胞样瘤细胞、单核样B细胞组成;瘤细胞均表达B细胞相关抗原。中心细胞样细胞型10例,单核细胞型和小淋巴细胞型各2例。4例行IgH基因重排检测,其中3例出现单克隆条带。6例行双色荧光原位杂交(FISH)MALT1基因分离探针检测,其中3例阳性。14例患者单纯化疗8例,手术切除5例;手术病例术后化疗2例,1例放弃治疗;随访12例,随访时间1~9年,复发2例,死亡2例。
肺原发性MALT淋巴瘤临床表现缺乏特异性,确诊主要依据病变部位病理组织活检、免疫组织化学检测、IgH克隆性检测以及FISH检测MALT1基因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺黏膜相关淋巴组织(MALT)淋巴瘤是一种罕见的肺部恶性肿瘤,占所有原发性肺肿瘤的0.5%[1]。肺MALT淋巴瘤恶性程度不高,进展缓慢,预后较好,但临床易误诊,确诊主要依赖病理学组织形态和免疫组织化学染色。本研究回顾性分析了复旦大学附属中山医院2007年5月至2017年5月经病理确诊肺MALT淋巴瘤的14例病例完整的临床资料,从临床特征、病理表现、诊断过程、接受的综合治疗及预后随访等方面对肺MALT淋巴瘤进行探讨和分析,旨在提高临床医师对MALT淋巴瘤的认识。
在复旦大学附属中山医院病案室查找2007年5月至2017年5月出院诊断为肺MALT淋巴瘤的患者,共32例,在其中筛选出病理诊断符合的14例患者,对其临床资料进行回顾性分析并随访其预后。所有患者病理诊断符合2008年WHO关于淋巴造血组织肿瘤分类标准[2]。
本分析研究纳入的14例患者肺组织活检标本均取材后经由4%甲醛固定,石蜡包埋,常规切片,HE染色,并进一步完善免疫组化检查。抗体CD45、CD45RO、CD20、CD5、CD30、CD10、CD79a、Bcl-2、Bcl-6、CyclinD1以及免疫球蛋白IgH由DAKO公司提供。操作步骤按照说明书进行,同时设立阴性和阳性对照。总结患者的临床资料、影像学检查、病理表现、治疗和随访情况。
应用SPSS 20.0统计软件,正态分布计量数据以 ±s表示,计数资料以构成比(%)表示。
±s表示,计数资料以构成比(%)表示。
14例患者中,男7例,女7例;年龄47~79(57±8)岁。症状主要表现为咳嗽10例,咳痰7例,痰中带血3例,胸闷气短4例,胸痛1例,低热1例。CT显示病灶4例位于左肺,4例位于右肺,6例双肺同时累及。肿块直径0.8~11.0 cm,不同病灶对比后可发现其密度不等,边缘不光滑。详细临床特征、治疗以及随访结果见表1。
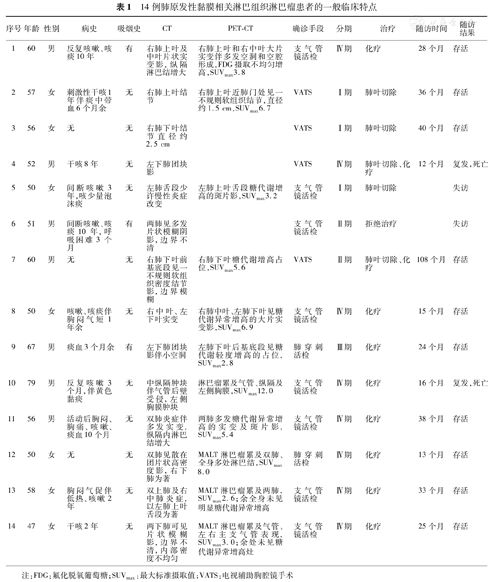
14例肺原发性黏膜相关淋巴组织淋巴瘤患者的一般临床特点
14例肺原发性黏膜相关淋巴组织淋巴瘤患者的一般临床特点
| 序号 | 年龄 | 性别 | 病史 | 吸烟史 | CT | PET-CT | 确诊手段 | 分期 | 治疗 | 随访时间 | 随访 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 结果 | |||||||||||
| 1 | 60 | 男 | 反复咳嗽、咳痰10年 | 有 | 右肺上叶及中叶片状实变影,纵隔淋巴结增大 | 右肺上叶和右中叶大片实变伴多发空洞和空腔形成,FDG摄取不均匀增高,SUVmax3.8 | 支气管镜活检 | Ⅳ期 | 化疗 | 28个月 | 存活 |
| 2 | 57 | 女 | 刺激性干咳1年伴痰中带血6个月余 | 无 | 右肺上叶结节 | 右肺上叶近肺门处见一不规则软组织结节,直径约1.5 cm,SUVmax6.7 | VATS | Ⅰ期 | 肺叶切除 | 36个月 | 存活 |
| 3 | 56 | 女 | 无 | 无 | 右肺下叶结节直径约2.5 cm | VATS | Ⅰ期 | 肺叶切除 | 40个月 | 存活 | |
| 4 | 52 | 男 | 干咳8年 | 无 | 左下肺团块影 | VATS | Ⅳ期 | 肺叶切除、化疗 | 12个月 | 复发,死亡 | |
| 5 | 50 | 女 | 间断咳嗽3年,咳少量泡沫痰 | 无 | 左肺舌段少许慢性炎症改变 | 左肺上叶舌段糖代谢增高的斑片影,SUVmax3.2 | 支气管镜活检 | Ⅰ期 | 肺叶切除 | 失访 | |
| 6 | 51 | 男 | 间断咳嗽、咳痰10年,呼吸困难3个月 | 有 | 两肺见多发片状模糊阴影,边界不清 | 支气管镜活检 | Ⅱ期 | 拒绝治疗 | 失访 | ||
| 7 | 60 | 男 | 无 | 无 | 右肺下叶前基底段见一不规则软组织密度结节影,边界模糊 | 右肺下叶糖代谢增高占位,SUVmax5.6 | VATS | Ⅱ期 | 肺叶切除、化疗 | 108个月 | 存活 |
| 8 | 50 | 女 | 咳嗽、咳痰伴胸闷气短1年余 | 无 | 右中叶、左下叶实变 | 右肺中叶、左肺下叶见糖代谢异常增高的大片实变影,SUVmax6.9 | 支气管镜活检 | Ⅳ期 | 化疗 | 15个月 | 存活 |
| 9 | 67 | 男 | 痰血3个月余 | 有 | 左下肺团块影伴小空洞 | 左肺下叶后基底段见糖代谢轻度增高的占位,SUVmax2.8 | 肺穿刺活检 | Ⅲ期 | 化疗 | 24个月 | 存活 |
| 10 | 79 | 男 | 反复咳嗽3个月,伴黄色黏痰 | 无 | 中纵隔肿块伴气管后壁受侵,左侧胸膜肿块 | 淋巴瘤累及气管、纵隔及左侧胸膜,SUVmax12.0 | 支气管镜活检 | Ⅳ期 | 化疗 | 16个月 | 复发,死亡 |
| 11 | 56 | 男 | 活动后胸闷、胸痛、咳嗽、痰血10个月 | 无 | 双肺炎症伴多发实变,纵隔内淋巴结增大 | 两肺多发糖代谢异常增高的实变及斑片影,SUVmax5.4 | 支气管镜活检 | Ⅳ期 | 化疗 | 38个月 | 存活 |
| 12 | 50 | 女 | 无 | 无 | 双肺见散在团片状高密度影,右下肺为著 | MALT淋巴瘤累及双肺、全身多处淋巴结,SUVmax8.0 | 肺穿刺活检 | Ⅳ期 | 化疗 | 13个月 | 存活 |
| 13 | 58 | 女 | 胸闷气促伴低热、咳嗽2年 | 无 | 双上肺及右中肺炎症,以左肺上叶舌段为著 | MALT淋巴瘤累及两肺,SUVmax2.6;余全身未见明显糖代谢异常增高 | 支气管镜活检 | Ⅳ期 | 化疗 | 33个月 | 存活 |
| 14 | 47 | 女 | 干咳2年 | 无 | 两下肺可见片状模糊影,边界不清,内部密度不均匀 | MALT淋巴瘤累及气管、左右主支气管表现,SUVmax3.0;余处未见糖代谢异常增高灶 | 支气管镜活检 | Ⅳ期 | 化疗 | 25个月 | 存活 |
注:FDG:氟化脱氧葡萄糖;SUVmax:最大标准摄取值;VATS:电视辅助胸腔镜手术
病理诊断标本4例源自电视辅助胸腔镜手术(VATS)切除,2例源自经皮穿刺肺穿刺活检,8例源自经支气管镜肺穿刺活检。组织病理及免疫组化结果显示14例均为B细胞来源的非霍奇金淋巴瘤,HE染色14例病例出现不同程度的以下表现:淋巴瘤细胞单一性弥漫增生,主要由中心细胞样细胞、小淋巴细胞和单核样细胞组成,核分裂象少见;其间可见增生性淋巴滤泡(反应性淋巴滤泡);数量不一的淋巴瘤细胞浸润于支气管黏膜上皮,形成淋巴上皮样病变(LEL),淋巴瘤细胞浸润肺组织形成串珠样小结,浸润肺间质形成飘带样结构。免疫组化检查中,14例均不同程度表达B细胞标志物CD20、CD79a,对T细胞标志物CD3、CD45RO无反应,5例CD45/LCA(+),10例Bcl-2(+),8例CD10(-),5例CD5(-),3例CD30(-),6例Bcl-6(-),3例CyclinD1(-),Ki-67核增殖指数5%~20%。4例行IgH基因重排检测,其中3例出现单克隆条带,具有确诊意义;6例行双色荧光原位杂交(FISH)MALT1基因分离探针检测,其中3例阳性。
14例患者首诊时疾病分期为5例患者为Ⅳ期A组,3例为Ⅳ期B组,1例为Ⅲ期A组,2例Ⅱ期A组,3例Ⅰ期A组。主要的治疗包括手术和化疗,手术均为VATS切除,化疗应用RC方案(利妥昔单抗+环磷酰胺)、FCR方案(福达拉滨+环磷酰胺+利妥昔单抗)联合化疗和鞘内注射(甲氨蝶呤+地塞米松)等。14例患者中应用手术切除治疗5例,其中2例合并术后化疗,单纯手术2例,单纯化疗8例,1例放弃治疗;随访中2例失访,随访的12例患者随访时间1~9年,死亡2例,首诊时分别为Ⅳ期A组及Ⅳ期B组,分别采用化疗、肺叶切除加化疗不同治疗方案,死亡原因为多器官功能衰竭,其余10例患者至此次随访病情控制良好。
Isaacson和Wright[3]在1983年首次提出肺MALT淋巴瘤的概念。1998年WHO提议将MALT淋巴瘤单独分型,称之为"边缘区B细胞淋巴瘤,MALT型"。它最早在胃肠道被发现,之后在肺、甲状腺等部位也发现MALT淋巴瘤的存在[4]。目前研究发现,该病的总体发病率较低,大多为惰性且进展缓慢,预后较好,是肺内最为常见的恶性淋巴瘤。女性发病率稍高于男性,发病高峰在65周岁左右[5]。复旦大学附属中山医院近10年的回顾性研究,32例中女性17例略高于男性15例,本报道的14例完整病例中男女相等。32例年龄47~82(58±8)岁,本报道中14例年龄47~79(57±8)岁,临床基本特征与文献报道相似,肺MALT淋巴瘤在中老年人中发病率较高,我们推测这与中老年人自身免疫低下、容易发生肺部感染、感染控制不佳有关,慢性炎症的刺激,引发淋巴细胞增生、浸润,导致MALT淋巴瘤的发生。MALT淋巴瘤患者的预后较好、存活率较高。本研究中死亡2例,首诊为Ⅳ期A组及Ⅳ期B组,考虑为疾病相对晚期,预后较差。
肺MALT淋巴瘤病因尚不清楚,目前认为与吸烟、肺部感染、自身免疫性疾病以及多种抗原刺激引起淋巴组织反应性增生有关[6]。临床上大约有一半的患者无症状,只是在常规体检时被发现,其症状主要包括咳嗽、胸痛、胸闷、呼吸困难、血痰、发热、体重减轻等,往往缺乏特异性,与呼吸道其他疾病难以鉴别[7];本回顾性研究中,吸烟患者占21.4%,平均吸烟指数为(533±62),淋巴瘤确诊后均已戒烟。
肺MALT淋巴瘤的诊断和随访需胸部CT检查,CT影像学表现各异,其病灶可以为单发结节或肿块,多发结节或肿块或成弥漫性分布的片状病灶,结节或肿块位于肺脏中心或边缘,中央型可在肺门形成一个弥漫的实质性肿块,周围型在叶间裂、脏层胸膜,沿淋巴管或支气管肺泡囊走行,也可呈类似间质型肺炎表现,肿块密度变化差异较大[8,9]。本研究中,表现为单发结节的约占28.6%,表现为多发结节或弥漫性分布的约占71.4%。肺MALT淋巴瘤临床诊断较为困难,容易与肺癌、肺结核、肺结节病、韦格纳肉芽肿、肺部感染等疾病混淆,确诊主要依赖病理,组织来源于支气管镜下肺活检、CT或B超引导下经皮肺穿刺活检和外科手术肺活检等,有条件时可作PCR检测IgH基因重排,是MALT淋巴瘤的确诊依据。
PET-CT对肺MALT淋巴瘤诊断有一定意义,病灶多表现为高代谢病变,最大标准摄取值(SUVmax)在2.2~26.0不等[10,11]。单发肿块型病灶放射性摄取明显增高,SUVmax常>7.0;肺炎样实变型病灶放射性摄取呈轻、中度增高;多发结节型病灶放射性摄取呈轻、中度增高;混合型病灶放射性摄取呈轻、中度增高。同时,PET-CT也有助于肺MALT淋巴瘤的分期,PET-CT较CT对MALT淋巴瘤分期准确性提高了18.7%[12]。但仅凭PET-CT检查将肺MALT淋巴瘤与肺部其他疾病进行准确鉴别仍较为困难。本研究中纳入病例中12例行PET-CT检测,协助了疾病分期,且病灶SUVmax值波动于2.6~12.0,与既往报道相似。
肺部MALT淋巴瘤病理主要有以下特点[13,14,15]:(1)瘤细胞由边缘区B淋巴细胞组成,包括中心细胞样细胞、单核细胞和小淋巴细胞样细胞,核分裂象少见;(2)可见增生性淋巴滤泡(反应性淋巴滤泡),瘤细胞呈边缘区或滤泡间分布,可向滤泡内浸润形成淋巴滤泡克隆化;(3)瘤细胞浸润黏膜上皮或腺上皮形成淋巴上皮样病变;(4)伴有浆细胞分化,浆细胞沿支气管血管束及叶间隔分布,可见Dutcher小体。肺部MALT淋巴瘤还应与淋巴细胞性间质性肺炎、滤泡性细支气管炎、慢性非特异性炎症反应以及其他低度恶性B细胞淋巴瘤鉴别[16,17]。本研究中,14例患者均为B细胞低度恶性MALT淋巴瘤,其中中心细胞样细胞型10例,单核细胞型和小淋巴细胞型各2例。
肺MALT淋巴瘤的治疗方案目前尚未形成共识。治疗方案主要有手术治疗、单独或联合应用化疗、放疗等。本研究中,两例Ⅰ期患者采取了单纯手术切除,术后均存活。一般认为手术、放疗适用于局限期患者,化疗适用于双肺、播散期、复发或进展期患者[18]。化疗在肺MALT淋巴瘤治疗中也尚无统一方案,苯丁酸氮芥、苯达莫司汀、氟达拉滨、米托蒽醌、蒽环类药物等在肺MALT淋巴瘤中均可应用。免疫治疗或毒性较低的化学治疗联合免疫治疗日趋成为肺MALT淋巴瘤治疗的新选择。肺MALT淋巴瘤是一种惰性淋巴瘤,Ki-67核增殖指数通常较低,预后较好,5年生存率超过80%,中位生存期超过10年[1,7,19]。但长期随访仍有必要,超过50%的患者有在手术两年后复发的风险[20,21,22]。本研究随访的12例患者3年生存率为91.7%,5年生存率为83.3%,复发率为16.7%。
综上所述,肺原发性MALT淋巴瘤临床表现缺乏特异性,临床上有不明原因肺部肿块或阴影且难以确诊的患者,应考虑此病的可能,尽早行病理活检予以确诊,以免贻误诊治时机。此外,影像学检查、IgH克隆性检测、FISH检测MALT1基因均可辅助诊断[23]。



























