
系统评价非典型抗精神病药奥氮平、利培酮、喹硫平治疗痴呆患者精神行为症状的疗效和安全性。
系统检索EMBASE、the Cochrane Library、Medline、万方数字知识服务平台、中国知网(CNKI),截至2016年2月为止的有关非典型抗精神病药奥氮平、利培酮、喹硫平治疗痴呆精神行为症状的随机、双盲、非安慰剂对照试验。对文献进行质量评价后,应用RevMan5.3软件进行数据处理。
本系统评价共纳入16个随机对照试验,包括1 727例患者(奥氮平组672例,喹硫平组395例,利培酮组660例)。结果显示:(1)奥氮平组嗜睡发生率高于利培酮组[OR=1.49,95% CI (-1.01~2.21),P=0.05],在头晕、激越、意外受伤、体质量增长、步态异常、乏力、睡眠障碍、锥体外系症状等不良反应方面,两组间差异无统计学意义。(2)利培酮组锥体外系症状发生率高于喹硫平组[OR=0.11,95% CI (0.04~0.27),P=0.64],嗜睡发生率低于喹硫平组[OR=0.03,95% CI (1.06~3.51),P=0.03],在意外受伤、头晕、疲乏、失眠、便秘等不良反应方面,两组间差异无统计学意义。(3)奥氮平组锥体外系症状发生率高于喹硫平组[OR=11.10,95% CI (3.35~36.75),P<0.000 1],在嗜睡、睡眠障碍、便秘、激越、体质量增长、头晕等不良反应方面,两组间差异无统计学意义。(4)中国人群与欧美人群间的亚组分析结果提示,在中国人群中利培酮组在激越、睡眠障碍方面的发生率高于奥氮平组[OR=0.26,95% CI (0.08~0.82);OR=0.31,95% CI (0.10~0.99)],奥氮平组在体质量增长方面,其发生率高于喹硫平组[OR=6.8,95% CI (2.00~23.14)]。
在奥氮平、利培酮、喹硫平三者中,利培酮嗜睡症状发生率最低,喹硫平锥体外系症状发生率最低。中国人群与欧美人群相比,利培酮激越、睡眠障碍发生率高于奥氮平,奥氮平体重增长发生率高于喹硫平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
痴呆是一种慢性、获得性、进行性的智能障碍综合征,痴呆患者除了有认知功能减退所致的记忆、智能下降外,同时有激越、易激惹等精神神行为症状。临床上常见的痴呆类型有:阿尔茨海默病(Alzheimer′s disease,AD)、血管性痴呆、帕金森病及混合性痴呆[1,2]。据研究表明,60%~80%的痴呆患者伴有精神行为症状(behavioural and psychological symptoms of dementia,BPSD)[3],如抑制行为、妄想和幻觉、精神错乱、攻击性、进食障碍及不恰当的社会行为和性行为等。目前临床上关于BPSD的治疗是在使用胆碱酯酶抑制剂、美金刚等改善认知药物的基础上,联合使用抗精神病药物。抗精神病药包括传统抗精神病药物(如氯丙嗪、氟哌啶醇)及非典型抗精神病药物(如奥氮平、利培酮、喹硫平),在临床上应用广泛,但关于它们在安全性上的优劣目前尚有争议。奥氮平、利培酮、喹硫平是临床上应用较多的三种非典型抗精神病药,本研究用系统评价的方法头对头比较三者治疗痴呆患者BPSD的安全性,以期为临床用药提供有效的循证学证据。
以"痴呆"、"奥氮平"、"利培酮"、"喹硫平"为主要检索词,检索EMBASE、the Cochrane Library、Medline、中国知网(CNKI)、万方数字知识服务平台,由建库至2016年2月已发表的所有中文及英文文献。
纳入标准:(1)试验设计:前瞻性、随机、双盲、非安慰剂对照试验;(2)患者类型:根据精神疾病诊断与统计手册-第四版(DSM-Ⅳ)[4]或国际疾病分类第十版(ICD-10)[5]或中国精神障碍分类与诊断标准第3版(CCMD-3)[6]诊断为痴呆,且伴有妄想、幻觉、攻击性等精神行为症状之一,排除伴有原发的精神病(如精神分裂症和双相情感障碍);(3)干预措施:奥氮平组每日剂量范围为0~20 mg;利培酮组每日剂量范围0~4.0 mg;喹硫平组每日剂量范围0~600 mg。上述药物均为口服给药,干预时间为2~12周;(4)结局指标:出现乏力、锥体外系症状、头晕等任一不良反应。
采用Cochrane随机对照试验风险评估工具[7],对随机分组方法、分组方案隐藏、盲法、结果数据的完整性、选择性报告研究结果、其他偏倚来源进行评价,并提取数据。
应用Revman5.3软件进行数据处理分析。各研究的结果异质性采用χ2检验及I2检验。当异质性检验的结果为P>0.05(I2≤50%),表示研究间异质性良好,采用固定效应模型(fixed effects model)计算其合并统计量;反之,则采用随机效应模型(randomized effect model)。
当研究纳入的文献数≥10篇时,本研究将通过漏斗图进行发表偏倚的评价,若没有发表偏倚时,其图形成对称的倒漏斗状;反之,漏斗图不对称越明显,存在发表偏倚的可能性越大。当研究纳入的文献数<10篇时,则认为该研究存在发表偏倚的可能性大。
共检索相关文献333篇,排除重复文献50篇,非随机对照试验、空白对照、研究对象非痴呆、回顾性分析260篇,未提及相关研究指标7篇,最终纳入16项研究。
奥氮平组与利培酮组:随机分配方法、结果测量值盲法的采用、分配隐藏方面,偏倚风险为不确定。在选择性报告、研究人员和患者的盲法、结果数据完整性、其他偏倚方面,为低风险偏倚。
喹硫平组与利培酮组:在随机分配方法、分配隐藏、研究人员和患者的盲法、结果测量值盲法的使用方面,偏倚风险为不确定;在结果数据完整性、选择性报告、其他偏倚方面,为低风险偏倚。
奥氮平组与喹硫平组:在随机分配方法、分配隐藏、结果测量值的盲法、研究人员和患者的盲法、方面偏倚风险为不确定。在选择性报告、结果数据完整性、其他偏倚方面,为低风险偏倚。
所纳入的16篇文献,5篇英文文献,11篇中文文献,纳入的16项研究均为随机、双盲、非空白对照试验,药物干预时间为4~12周,其中Deberdt等[8]、Gareri等[9]、Schneider等[10]、Rainer等[11]、Mulsant等[12]、蔡鸣等[13]、黄文平等[14]、蒋文竹等[15]、孟森等[16]为奥氮平与利培酮的对照研究,Schneider等[10]、方向明等[17]、袁刚等[18]、张赟等[19]、赵红梅等[20]为喹硫平与利培酮的对照研究,Schneider等[10]、王秀芳等[21]、徐清等[22]、徐燕[23]为奥氮平与喹硫平的对照研究(表1)。
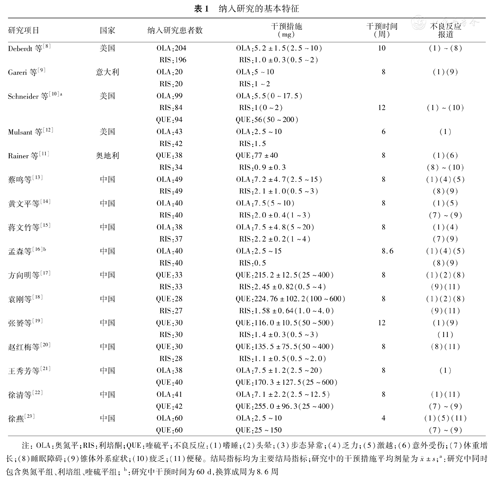
纳入研究的基本特征
纳入研究的基本特征
| 研究项目 | 国家 | 纳入研究患者数 | 干预措施(mg) | 干预时间(周) | 不良反应报道 |
|---|---|---|---|---|---|
| Deberdt等[8] | 美国 | OLA: 204 | OLA:5.2±1.5(2.5~10) | 10 | (1)~(8) |
| RIS:196 | RIS:1.0±0.3(0.5~2) | ||||
| Gareri等[9] | 意大利 | OLA: 20 | OLA:5~10 | 8 | (1)(9) |
| RIS:20 | RIS:1~2 | ||||
| Schneider等[10]a | 美国 | OLA: 99 | OLA:5.5(0~17.5) | ||
| RIS:84 | RIS:1(0~2) | 12 | (1)~(10) | ||
| QUE:94 | QUE:56(50~200) | ||||
| Mulsant等[12] | 美国 | OLA: 43 | OLA: 2.5~10 | 6 | (1) |
| RIS:42 | RIS:1.5 | ||||
| Rainer等[11] | 奥地利 | QUE:38 | QUE:77±40 | 8 | (1)(6) |
| RIS:34 | RIS:0.9±0.3 | (8)~(10) | |||
| 蔡鸣等[13] | 中国 | OLA: 49 | OLA:7.2±4.7(2.5~15) | 8 | (1)(4)(5) |
| RIS:49 | RIS:2.1±1.0(0.5~3) | (8)(9) | |||
| 黄文平等[14] | 中国 | OLA:40 | OLA:7.5(5~10) | 8 | (1)(5) |
| RIS:40 | RIS:2.0±0.4(1~3) | (7)~(9) | |||
| 蒋文竹等[15] | 中国 | OLA: 38 | OLA:7.5±4.8(5~20) | 8 | (1)(4) |
| RIS:37 | RIS:2.2±0.2(1~4) | (7)(9) | |||
| 孟森等[16]b | 中国 | OLA: 40 | OLA:2.5~15 | 8.6 | (1)(4)(5) |
| RIS:40 | RIS:0.5 | (8)(9) | |||
| 方向明等[17] | 中国 | QUE:33 | QUE:215.2±12.5(25~400) | 8 | (1)(2)(8) |
| RIS:33 | RIS:2.45±0.82(0.5~4) | (9)(11) | |||
| 袁刚等[18] | 中国 | QUE:28 | QUE:224.76±102.2(100~600) | 8 | (1)(2)(8) |
| RIS:27 | RIS:1.58±0.64(1.0~4.0) | (9)(11) | |||
| 张赟等[19] | 中国 | QUE:30 | QUE:116.0±10.5(50~500) | 12 | (1)(9) |
| RIS:30 | RIS:1.4±0.3(0.5~3) | (11) | |||
| 赵红梅等[20] | 中国 | QUE:30 | QUE:135.5±75.5(50~400) | 8 | (8)(11) |
| RIS:28 | RIS:1.1±0.5(0.5~2.0) | ||||
| 王秀芳等[21] | 中国 | OLA: 38 | OLA:7.5±1.2(2.5~20) | 8 | (1) |
| QUE:40 | QUE:170.3±127.5(25~600) | ||||
| 徐清等[22] | 中国 | OLA:41 | OLA:7.1±2.2(2.5~12.5) | 8 | (1)(11) |
| QUE:42 | QUE:255.0±96.3(25~400) | (7)~(9) | |||
| 徐燕[23] | 中国 | OLA: 60 | OLA:2.5~10 | 4 | (1)(5)(11) |
| QUE:60 | QUE:25~150 | (7)~(9) |
注:OLA:奥氮平;RIS:利培酮;QUE:喹硫平;不良反应:(1)嗜睡;(2)头晕;(3)步态异常;(4)乏力;(5)激越;(6)意外受伤;(7)体重增长;(8)睡眠障碍;(9)锥体外系症状;(10)疲乏;(11)便秘。结局指标均为主要结局指标;研究中的干预措施平均剂量为 ±s;a:研究中同时包含奥氮平组、利培组、喹硫平组;b:研究中干预时间为60 d,换算成周为8.6周
±s;a:研究中同时包含奥氮平组、利培组、喹硫平组;b:研究中干预时间为60 d,换算成周为8.6周
有7项关于奥氮平与利培酮的头对头研究[8,9,12,13,14,15,16]同时报道了嗜睡这一不良反应,进行异质性检验后,P=0.84,χ2=2.73,I2=0%<50%,表明各试验效应量异质性较小,采用固定效应模型合并效应量,OR=-1.49, 95% CI (1.01~2.21),P=0.05,结果显示奥氮平组嗜睡症状的发生率高于利培酮组,且差异具有统计学意义(图1)。
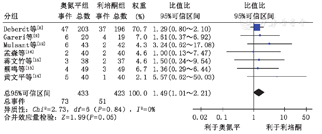

有6项研究[9,10,13,14,15,16]报道了锥体外系症状,进行异质性检验,P=0.13,χ2=8.48,I2=41%<50%,表明各研究效应量异质性较小,采用固定效应模型合并效应量,OR=0.42, 95% CI (0.24~0.72),P=0.002,结果显示奥氮平组锥体外系症状发生率低于利培酮组,且差异具有统计学意义(图2)。

有7项研究[8,9,12,13,14,15,16]对头晕、步态异常、乏力、激越、意外受伤、体重增长、睡眠障碍进行了报道,分别进行异质性检验后合并效应量,结果显示奥氮平组与利培酮组相比,上述不良反应的发生率无明显差异[头晕:OR=-1.19, 95% CI (0.59~2.39),P=0.62;步态异常:OR=1.04, 95% CI (0.57~1.92) P=0.89;乏力:OR=1.04, 95% CI (0.58~1.87), P=0.002;激越:OR=0.93, 95% CI (0.60~1.42), P=0.73;意外受伤:OR=1.65, 95% CI (0.99~2.77), P=0.06;体重增长:OR=1.53, 95% CI (0.94~2.48), P=0.09;睡眠障碍:OR=0.80,95% CI (0.45~1.42), P=0.09]。
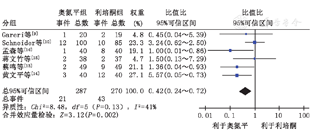
有5项关于喹硫平与利培酮的头对头研究[10,11,17,18,19]报道了嗜睡、锥体外系症状、疲乏、失眠、意外伤害、头晕、便秘的不良反应。在嗜睡方面,异质性分析显示P=0.26,χ2=4.44,I2=10%<50%,表明各研究异质性较小,采用固定效应模型合并效应量,OR=1.93,95% CI (1.06~3.51), P=0.35,结果显示喹硫平组嗜睡症状发生率高于利培酮组,且差异具有统计学意义(图3);在锥体外系症状方面,异质性分析显示P=0.91,χ2=0.99,I2=0%<50%,表明各研究异质性较小,采用固定效应模型合并效应量,OR=0.11,95% CI (0.04~0.30),P=0.64,结果显示喹硫平组锥体外系症状发生率低于利培酮组,且差异具有统计学意义(图4)。


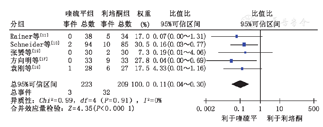

在疲乏、失眠、意外伤害、头晕、便秘方面,分别进行异质性检验后合并效应量,结果显示喹硫平组与利培酮组相比,上述不良反应的发生率无明显差异[疲乏:OR=1.98,95% CI (0.55~7.20), P=0.30;失眠:OR=0.92, 95% CI (0.37~2.32),P=0.87;意外伤害:OR=0.80,95% CI (0.32~2.00),P=0.64;头晕:OR=0.99,95% CI (0.24~4.12), P=0.98;便秘:OR=0.97,95% CI(0.39~2.40), P=0.94]。
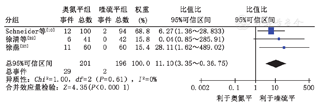
纳入的3项奥氮平与喹硫平的头对头研究[10,22,23]报道了锥体外系症状的不良反应,进行异质性检验,P=0.61,χ2=1.00,I2=0%<50%,表明各研究异质性较小,采用固定效应模型合并效应量,OR=11.10,95% CI (3.35~36.75),P<0.000 1,结果显示奥氮平组锥体外系症状发生率高于喹硫平组,且差异具有统计学意义(图5)。

纳入研究同时对嗜睡、体重增长、便秘、头晕、睡眠障碍、激越的不良反应进行了报道,分别进行异质性检验后合并效应量,结果显示奥氮平组与喹硫平组相比,上述不良反应的发生率无明显差异[嗜睡:OR=1.59,95% CI (0.70~3.63),P=0.27;体重增长:OR=3.35,95% CI (0.68~16.45),P=0.14;便秘:OR=1.73,95% CI (0.73~4.03),P=0.21;头晕:OR=1.05,95% CI(0.49~2.27),P=0.90;睡眠障碍:OR=1.19,95% CI (0.49~2.87]), P=0.70;激越:OR=0.63,95% CI (0.28~1.41),P=0.27]。
将纳入研究根据纳入对象的地域分布,即中国人群、欧美人群进行进行亚组分析。(1)奥氮平组与利培酮组:利培酮组在中国人群中激越、睡眠障碍的不良反应发生率高于奥氮平组[OR=0.26,95% CI (0.08~0.82);OR=0.31,95% CI (0.10~0.99)],而在欧美人群中,利培酮组及奥氮平组在激越与睡眠障碍方面的差异无统计学意义[OR=1.23,95% CI (0.76~1.99);OR=1.19,95% CI (0.59~2.40)]。(2)利培酮组与喹硫平组:欧美人群与中国人群在嗜睡、锥体外系症状等各方面不良反应的发生率上的差异无统计学意义[嗜睡:OR=1.91,95% CI (0.92~3.93),OR=1.99,95% CI (0.68~5.78);锥体外系症状:OR=0.13,95% CI (0.03~0.50),OR=0.09,95% CI (0.02~0.40)]。(3)奥氮平组与喹硫平组:中国人群与欧美人群相比,奥氮平组在体重增长方面,其发生率高于喹硫平组[OR=6.8, 95% CI (2.00~23.14)]。
将纳入的奥氮平与利培酮头对头研究中的嗜睡、锥体外系症状及喹硫平与利培酮的头对头研究中的嗜睡及锥体外系症状分别进行发表偏倚分析,由于各研究纳入文献均<10篇,因此,其荟萃分析结果可能存在一定的发表偏倚。
非典型抗精神病药目前在BPSD的治疗中应用非常广泛,近年来对其疗效的研究表明非典型抗精神病药相比于其他的药物治疗方法,被证实是首选的治疗方法[24],在安全性方面,研究显示非典型抗精神病药比传统抗精神病药具有更好的耐受性[25,26],且锥体外系反应较少[27]。而Schneider等[10]发表的研究表明非典型抗精神病药组与安慰剂相比,可能发生嗜睡、步态异常、水肿、泌尿道感染、尿失禁的风险更高,但目前关于非典型抗精神病药物的研究多以安慰剂对照研究为主,药物间的头对头对比研究较少,非典型抗精神病药物间的安全性差异尚无明确结论,在临床药物选择过程中存在争议。2008年有学者针对AD患者进行的CATIE-AD研究证明,相比安慰剂,非典型抗精神病药物奥氮平、利培酮及喹硫平一方面可以减少患者的攻击行为、激越、幻觉和妄想等精神病性症状,但另一方面可能增加患者认知功能损伤的风险,但该研究并未进行非典型抗精神病药物间头对头对比分析,同时未对锥体外系症状、胃肠道症状等不良反应进行报道[28,29]。Tan等[30]针对痴呆患者纳入了23项随机对照研究进行的荟萃分析,比较了利培酮和阿立哌唑较安慰剂的有效性和安全性,研究表明利培酮及阿立哌唑较安慰剂可能存在更高的嗜睡、泌尿系感染、水肿和步态不稳等风险。本文采用系统评价的方法,以奥氮平、利培酮、喹硫平治疗BPSD的头对头研究为对象,针对3种临床常用的非典型抗精神病药的安全性进行了分析。结果显示,在安全性方面,奥氮平、利培酮、喹硫平三者中,利培酮嗜睡症状发生率最低,喹硫平锥体外系症状发生率最低。在其他纳入研究的不良反应方面,各药之间无明显差异。在临床应用方面,喹硫平组锥体外系症状发生率最低,可能更适用于伴有锥体外系症状的痴呆患者。
本系统评价根据纳入人群的地域分布进行的亚组分析显示,在中国人群中,利培酮激越、睡眠障碍发生率高于奥氮平,奥氮平体质量增长发生率高于喹硫平。这为非典型抗精神病药在中国人群,甚至亚裔人群中的应用安全性提供了进一步的循证医学证据。
同时本研究也存在一些不足之处,由于目前国内外缺少关于非典型精神病药之间头对头的大样本高质量研究,故本研究纳入文献偏少;另一方面,本研究未检索灰色文献,且漏斗图缺乏对称性,故可能存在发表偏倚,对结果可靠性有一定影响。



























