
探讨应用内镜神经外科技术结合脑室内抗生素盐水灌洗治疗化脓性脑室炎的疗效。
回顾分析2001至2017年北京世纪坛医院、北京协和医院等6家医院诊治的45例化脓性脑室炎患者。2001至2009年采用脑室置管外引流结合脑室内抗生素用药治疗化脓性脑室炎24例(非内镜组),2010至2017年采用内镜神经外科技术结合脑室内抗生素盐水灌洗治疗化脓性脑室炎21例(内镜组)。比较内镜组和非内镜组脑室外引流管留置时间、患者住院时间、死亡率以及6个月后改良Rankin评分(mRS)。
(1)脑室外引流管留置时间:内镜组(20±6)d,非内镜组(42±10)d,P<0.001;(2)住院时间:内镜组(29±7)d,非内镜组(51±11)d,P<0.001;(3)死亡情况:非内镜组8例(33.3%)死亡,内镜组仅1例(4.76%)死亡,P=0.017;(4)随访情况:治疗6个月后疗效满意(mRS ≤3)率,内镜组66.67%,非内镜组为29.17%,P=0.001。
内镜神经外科技术结合脑室内抗生素盐水灌洗能够有效诊疗化脓性脑室炎,值得进一步推广应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑室炎又称脑室管膜炎,是发生在脑室系统及其周围的炎症,以脑脊液白细胞增多并且培养出致病菌以及脑室影像学改变为特征的颅内感染。脑室炎主要发生在颅脑外伤或手术(特别是长期脑室外引流)后细菌入侵脑室引起[1]。化脓性脑室炎是神经外科手术后的严重并发症之一,病死率可高达30%~40%[2,3],及早诊断和合理治疗对化脓性脑室炎患者至关重要。2001至2007年首都医科大学附属北京世纪坛医院等6家医院应用内镜神经外科技术结合术中及术后脑室内抗生素盐水灌洗治疗对化脓性脑室炎与脑室置管外引流结合脑室内抗生素用药治疗化脓性脑室炎的疗效进行分析比较,报道如下。
为首都医科大学附属北京世纪坛医院、北京协和医院、北京大学第三医院、首都医科大学附属北京同仁医院、南京医科大学附属第二医院及北京房山区良乡医院神经外科诊治的45例化脓性脑室炎患者,依据内镜神经外科技术开展的时间分为两组,非内镜组24例(2001至2009年期间采用脑室置管外引流结合脑室内抗生素用药治疗化脓性脑室炎);内镜组21例(2010至2017年采用内镜神经外科技术结合术中及术后脑室内抗生素盐水灌注冲洗治疗化脓性脑室炎)。比较两组患者的脑室外引流管留置时间、住院时间、死亡率以及随访6个月改良Rankin评分(mRS)。
(1)神经外科手术或操作史;(2)患者伴有发热、头痛、颈和(或)上背痛、癫痫、意识障碍等症状;(3)脑膜刺激征阳性;(4)脑脊液(CSF)白细胞≥3/高倍镜;(5) CSF细菌培养连续阳性≥2次;(6) CT和MRI扫描显示脑室壁线样强化、脑室内沉渣和(或)脑室内脓肿形成,或伴有脑室内分隔。
(1)德国蛇牌0°、30°脑室镜,外径4.5 mm,单工作通道、双冲洗通道;(2)德国蛇牌Minop Invent 30°镜,8.3 mm的外径,4个通道:窥镜通道:内径2.8 mm;冲洗通道:内径1.0 mm;两个融合通道:①大型器械/排水通道3.7 mm×6.5 mm,②小型器械通道:内径2.2 mm。
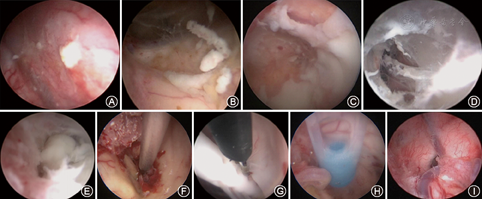
(1)非内镜组:局麻或全麻下经双侧侧脑室额角置管外引流术,引流管深度距脑皮质约5~6 cm。引流管皮下潜行后穿出体外并固定;(2)内镜组:均采用全身麻醉神经内镜下双侧额角入路。将神经内镜置入侧脑室、第三脑室及第四脑室(中脑导水管扩张直径>5 mm)探查、评估脑室感染程度(图1A,图1B,图1C,图1D,图1E);清除脑室内炎性沉渣、脓苔和积血(重力原因常沉积于三脑室、侧脑室颞角和枕角等处);贯通脑室内分隔,重建脑脊液循环;对于大量脑室内炎性沉渣、被覆物和脑室内脓肿,可将镜内操作技术转换为镜外操作技术,应用吸引器吸除的方式加以清除(图1F);游离被脉络丛或炎性纤维条索包裹的人工植入材料并取出(图1G);脑室内脓肿采用切除或行脓肿囊壁开窗引流术;在神经内镜引导下于双侧侧脑室内留置14F脑室外引流管(图1H),术后给予脑室内抗生素盐水灌洗;需多次内镜手术清理脑室内炎性沉积物的患者,内镜下可再次评估脑室炎的严重程度以及脑室内抗生素盐水灌洗效果(图1I)。

内镜组和非内镜组脑室内用药均依据细菌学培养结果选用符合循证医学的敏感抗生素如万古霉素、庆大霉素或丁胺卡那。(1)非内镜组:按照全身静脉应用抗生素剂量的1/10~1/20,将抗生素用生理盐水稀释至2~3 ml,注入脑室内,夹闭引流管0.5~2 h后开放,2~3次/d;(2)内镜组:术中及术后采取脑室内抗生素盐水间断或持续灌注冲洗方式,药物配制浓度为全身静脉用药的1/10~1/20配制成250 ml溶液。依据抗生素半衰期,每4~6小时更换一组抗生素灌洗溶液。
均采用门诊或电话随访观察。
连续变量采用Mann-Whitney U检验,分类变量采用χ2检验进行分析。所有统计学分析均应用SPSS 17.0统计软件进行分析。
内镜组与非内镜组患者平均发病年龄、性别比例、脑室内脓肿所占比率以及脑室炎感染前mRS≤3的患者例数差异均无统计学意义(表1)。内镜组年龄均数40.1岁(30~63岁),非内镜组年龄均数45.3岁(28~70岁),P>0.05;内镜组男12例(57.14%),非内镜组男14例(58.33%),P>0.05;脑脓肿,内镜组4例(19.05%),非内镜组5例(20.83%),P>0.05。脑室炎感染前mRS≤3例数,内镜组17例(80.95%),非内镜组16例(66.67%),P>0.05。
两组化脓性脑室炎患者临床疗效比较
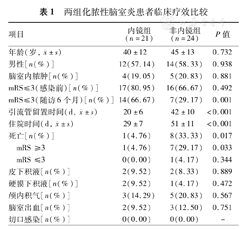
两组化脓性脑室炎患者临床疗效比较
| 项目 | 内镜组(n=21) | 非内镜组(n=24) | P值 | |
|---|---|---|---|---|
年龄(岁, ±s) ±s) | 40±12 | 45±13 | 0.732 | |
| 男性[n(%)] | 12(57.14) | 14(58.33) | 0.938 | |
| 脑室内脓肿[n(%)] | 4(19.05) | 5(20.83) | 0.881 | |
| mRS≤3(感染前)[n(%)] | 17(80.95) | 16(66.67) | 0.492 | |
| mRS≤3(随访6个月)[n(%)] | 14(66.67) | 7(29.17) | 0.001 | |
引流管留置时间(d,  ±s) ±s) | 20±6 | 42±10 | <0.001 | |
住院时间(d,  ±s) ±s) | 29±7 | 51±11 | <0.001 | |
| 死亡[n(%)] | 1(4.76) | 8(33.33) | 0.017 | |
| mRS ≥3 | 1(4.76) | 7(29.17) | 0.033 | |
| mRS ≤3 | 0(0.00) | 1(4.17) | 0.344 | |
| 皮下积液[n(%)] | 2(9.52) | 2(8.33) | 0.889 | |
| 硬膜下积液[n(%)] | 2(9.52) | 1(4.17) | 0.472 | |
| 颅内积气[n(%)] | 3(14.29) | 5(20.83) | 0.567 | |
| 脑室出血[n(%)] | 2(9.52) | 3(12.50) | 0.751 | |
| 切口感染[n(%)] | 0(0.00) | 0(0.00) | - | |
随访6个月后患者疗效满意(mRS≤3),内镜组14例(66.67%),非内镜组仅7例(33.33%),P=0.001。内镜组脑室外引流管留置时间(20±6)d,非内镜组(42±10)d,P<0.001。住院时间,内镜组(29±7)d,非内镜组(51±11)d,P<0.001。
非内镜组8例(33.33%)患者死亡,而内镜组仅1例(4.76%)死亡,P<0.05。脑室炎感染前mRS≥3的患者经过治疗后,非内镜组死亡7例(29.17%),内镜组仅死亡1例(4.76%),P=0.033。脑室炎感染前mRS≤3的患者经过治疗后,非内镜组死亡1例(4.17%),内镜组无死亡,两组比较P>0.05。两组皮下积液、硬膜下积液、颅内积气、脑室出血以及切口感染等并发症差异均无统计学意义(P>0.05),表1。
神经内镜展现了微侵袭、照明好、可视化、全景化术野等优点,尤其适合脑脊液为介质的脑室内操作[4,5,6,7]。内镜神经外科技术的运用也丰富了脑室感染的治疗手段。早在1978年Ogata等[8]报道应用脑室内窥镜观察30例脑室炎患者的脑室内状况。此后,直到2007年Mori[9]报道1例44岁男性链球菌导致的脑室炎的神经内镜下表现,首次描述了内镜下脑室炎的"颗粒性室管膜炎"表现,同时也证实脑室腹腔分流管脑室端的周围容易聚集形成菌落,将人们对脑室炎的认识又向前推进了一步。2014年关峰等[10]报道了14例脑室感染的神经内镜诊治经验。系统的介绍应用内镜神经外科技术治疗脑室感染的技术特点,治愈率达到90%以上,真正意义上将内镜神经外科技术由诊断、评估脑室感染过渡到了治疗阶段。2017年Wang等[11]报道41例脑室炎的内镜神经外科治疗,这也是迄今为止病例数最多的一项研究,该研究进一步完善了内镜神经外科治疗脑室炎的技术特点,患者治愈率也达到了90%以上,进一步印证了内镜神经外科技术在脑室炎治疗中发挥的突出作用。2015年Kumar等[12]报道神经内镜下脑室内灌洗治疗脑室炎的经验,明确了脑室内抗生素盐水灌洗对彻底纠正脑室炎的重要性。以上研究为内镜神经外科技术结合脑室内抗生素盐水灌洗治疗脑室炎提供了理论基础和临床实践探索。
与非内镜置管持续引流结合脑室内用药相比,内镜神经外科技术结合脑室内抗生素盐水灌洗治疗脑室炎的优势体现为:(1)内镜神经外科手术过程中,在可视化的条件下能够进行高流量的灌洗从而置换炎性或血性脑脊液、炎性沉渣和组织碎屑,减轻术后炎症反应;(2)与脑室置管外引流术相比,神经内镜利用其可视化的操作可彻底清除脑室内的脓苔沉渣和条索。贯通闭锁和分隔,重建脑脊液循环,从而利于脑室内用药的弥散,有助于彻底纠正化脓性脑室炎;(3)对于化脓性脑室炎继发的脑室内脓肿,单纯脑室内用药,很难彻底治愈脑脓肿。只有采取内镜神经外科手术清除脑室内脓肿或行脑室内脓肿穿刺外引流术结合脑室内抗生素盐水灌洗才能从根本上治愈化脓性脑室炎;(4)神经内镜的引导下调整脑室引流管的位置,将引流管放置在理想的位置既能充分的灌洗及引流,又可以避免与脉络丛和脑室壁的粘连;(5)神经内镜下可以留取炎性被覆物、沉渣和条索的标本,有助于对脑室炎病理生理学的深入研究。本项研究表明内镜神经外科技术结合术中及术后脑室内抗生素盐水灌洗可以将脑室外引流置管的平均时间从42.3 d大幅缩短到20 d(P<0.001)。同时,也可以将脑室炎患者的平均住院时间从50.8 d大幅缩短至29 d(P<0.001)。非内镜组患者死亡率为33.3%,与文献报道30%~50%的死亡率大致相同[2,3],而内镜组患者死亡率显著降低至4.76%(P<0.05)。本项研究中,脑室炎感染前mRS≥3的患者经过治疗后,非内镜组死亡7例(29.17%),而内镜组仅死亡1例(4.76%),两组比较差异有统计学意义。因此,我们认为将内镜神经外科技术结合脑室抗生素盐水灌洗治疗早期应用于mRS≥3的脑室炎患者将有助于明显改善其预后。
(1)本项研究是一项回顾性研究,并且内镜组和非内镜组的病例是在不同时期和多个医学中心内完成诊治。相信随着研究的逐步深入将进一步规范应用内镜神经外科技术结合脑室内抗生素盐水灌洗治疗脑室炎的流程;(2)目前,国内外尚无内镜神经外科技术治疗脑室炎的大宗病例报道,后续研究仍需收集更多病例资料并进行长期、多中心的研究及随访观察;(3)目前内镜神经外科技术尚无法评估脑室炎患者蛛网膜下腔的状况,相信随着基础研究和内镜设备及器械的不断完善,将逐步解决这部分问题。



























