
观察并分析白细胞介素7(IL-7)对非小细胞肺癌(NSCLC)患者CD8+ T细胞抗肿瘤活性的影响。
入组2017年1—7月在郑州市中心医院就诊的27例NSCLC患者(肺癌组)和10例健康对照者(对照组)。分离肺癌组血浆、外周血单个核细胞(PBMCs)和肿瘤部位和非肿瘤部位的支气管肺泡灌洗液(BALF)及对照组血清和PBMCs,检测IL-7水平和IL-7受体CD127 mRNA相对表达量。使用重组IL-7刺激纯化的CD8+ T细胞和原代NSCLC,观察细胞增殖、分泌细胞因子和IL-7信号通路相关蛋白的表达变化。建立CD8+ T细胞和原代NSCLC细胞的直接/间接接触共培养系统,观察IL-7刺激对CD8+ T细胞的细胞杀伤和非细胞杀伤功能的变化。
肺癌组外周血中IL-7水平显著低于对照组[1 731(1 364,2 536)比2 686(1 692,4 786)ng/L,P=0.023],肺癌组肿瘤部位分离的BALF中IL-7水平亦显著低于非肿瘤部位[(1 045(562,1 550)比1 599(1 166,2 107)ng/L,P=0.006 9]。两组间CD127 mRNA相对表达量差异无统计学意义。IL-7刺激原代NSCLC细胞后对细胞增殖及分泌细胞因子无影响,但IL-7刺激可显著增加CD8+ T细胞的增殖及干扰素γ和肿瘤坏死因子α的分泌,CD8+ T细胞中信号传导及转录激活因子5的磷酸化和细胞因子信号抑制物3的表达亦明显升高。IL-7刺激还显著提升CD8+ T细胞对原代NSCLC细胞的杀伤功能和非细胞杀伤功能。
IL-7可增强NSCLC患者CD8+ T细胞的抗肿瘤功能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌中非小细胞肺癌(NSCLC)约占80%,其1年生存率仅10%左右[1]。针对表皮生长因子受体基因突变的靶向药物及针对程序性死亡受体1的抗体等免疫检查点抑制剂为NSCLC的治疗提供了新的手段[2]。通过抑制负性免疫调控因子或使用外源性免疫源刺激免疫细胞,可诱导机体产生强烈的抗肿瘤免疫应答,抑制肿瘤生长,减少复发和转移[3]。白细胞介素7(IL-7)与其受体α链(CD127)结合所介导的信号转导通路可促进CD8+ T细胞的免疫应答[4,5]。但是,有关IL-7对肺癌患者CD8+ T细胞调控作用的研究较少。本研究检测NSCLC患者外周血及支气管肺泡灌洗液(BALF)中IL-7水平和CD127 mRNA的相对表达量,并用体外细胞培养系统观察IL-7对NSCLC患者CD8+ T细胞抗肿瘤活性的影响。
选择2017年1—7月、志愿入组本研究的、于郑州市中心医院诊断为NSCLC的患者27例,其中男21例,女6例,年龄(45.3±12.7)(范围33~68岁)。患者均符合NSCLC 2015年美国国家综合癌症网络(NCCN)指南的标准;均进行了手术或肺活检,并经病理学检查确诊为NSCLC;其中鳞癌17例,腺癌10例。根据影像学结果,19例为中央型(14例鳞癌、5例腺癌),8例为周围型(3例鳞癌、5例腺癌)。27例患者中,20例(12例鳞癌、8例腺癌)接受手术治疗。标准:(1)自身免疫性疾病患者;(2)长期接受免疫抑制治疗患者,合并严重肺部感染或败血症的患者;(3)合并活动性肝炎病毒或人类免疫缺陷病毒感染的患者。患者在接受手术前均未进行化疗、放疗或免疫治疗。同时,入组2017年1—3月在郑州市中心医院进行健康体检的、年龄和性别相匹配的健康对照者为对照组,其中男7例,女3例,年龄(50.1±16.3)(范围27~65)岁。
本研究通过郑州市中心医院伦理委员会批准(批准文号:ZZCH-LL-2016112401),入组者或家属均签署知情同意书。
Ficoll淋巴细胞分离液(美国Sigma公司); CD8+ T细胞分选试剂盒(德国美天旎公司);重组人IL-7(美国Peprotech公司);Transwell培养平板(美国康宁公司); IL-7、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试验检测试剂盒(美国R&D公司);CCK-8试剂盒、乳酸脱氢酶(LDH)细胞毒性检测试剂盒(武汉碧云天公司)。
于晨起空腹留取入组者抗凝外周血10 ml,于1 000×g离心10 min收集上层血浆,-70 ℃冰箱冻存备用。下层血细胞用Ficoll淋巴细胞分离液、采用密度梯度离心法分离PBMCs,调整细胞浓度至107个/ml,加入含10% DMSO的胎牛血清(FBS),液氮冻存备用。
首先在灌洗肺段经活检孔通过硅胶管注入利多卡因行局部麻醉,将纤维支气管镜顶端紧密楔入肿瘤部位亚段支气管开口处,经硅胶管快速注入37 ℃无菌生理盐水,共灌洗4次,每次50 ml。用100 mmHg(1 mmHg=0.133 kPa)负压吸引回收灌洗液,保证回收效率>50%。用双层无菌纱布过滤灌洗液,记录总量,导入无菌离心管中,于4 ℃、1 000 ×g离心10 min,收集上清-70 ℃冰箱冻存备用。经离心沉淀的细胞成分用RPMI 1640培养液洗涤2次,加入含10% FBS的RPMI 1640培养液,将细胞浓度调整至106个/ml。可耐受灌洗的肺癌组患者,对未发生肿瘤的肺部也进行灌洗,作为对照进行检测。
应用CD8+ T细胞分选试剂盒对PBMCs和BALF中的CD8+ T细胞进行分选。复苏冻存的PBMCs或收集新鲜分离的BALF,加入RPMI 1640培养液洗涤后于4 ℃、300×g离心10 min,用40 μl缓冲液重悬细胞,并加入10 μl生物素标记的抗体鸡尾酒,混匀后于4 ℃孵育5 min,加入30 μl缓冲液,再加入20 μl CD8+ T细胞磁珠鸡尾酒,混匀后于4 ℃孵育10 min。用3 ml缓冲液浸润置于MACS分离架上的分离柱,加入标记的细胞悬液,收集通过分离柱的未标记细胞(为CD8+ T细胞),应用3 ml缓冲液洗涤分离柱,收集通过分离柱的细胞,于4 ℃、300 ×g离心10 min,用含10% FBS的RPMI 1640培养液培养备用。取9例肺癌组患者外周血分离的105个CD8+ T细胞接种于96孔板中,设立4个复孔,其中2个复孔加入等量的培养液,另外2个复孔加入终浓度为5 μg/L的重组人IL-7刺激培养,12 h后收集细胞和培养上清进行后续检测。
对接受手术的肺癌组患者,取新鲜的NSCLC组织,加入适量的PBS,去除组织上的血液、脂肪组织和结缔组织,保留肿瘤细胞丰富的区域,用PBS洗涤2次后加入少量RPMI 1640培养液,将组织建成约1 mm3大小碎块。将组织碎块转入离心管中,用PBS洗涤数次,组织碎块自动下沉后移除PBS。将组织块转入培养瓶中,加入5 ml胶原酶,吹散,置37 ℃恒温摇床上消化,调节摇床速度为150次/min,每隔30 min于显微镜下观察1次。待组织块呈絮状、且透光性良好时,转入离心管中,于1 000×g离心10 min后弃上清,加入PBS洗涤数次,反复吹打后于1 000×g离心10 min,弃上清。转入培养板中,加入含10% FBS的RPMI 1640培养液培养备用。取8例肺癌组患者分离的105个原代NSCLC接种于96孔板中,设立4个复孔,其中2个加入等量的培养液,另2个加入终浓度为5 μg/L的重组人IL-7刺激培养,12 h后收集细胞和培养上清进行后续检测。
建立CD8+ T细胞与原代NSCLC细胞直接接触培养和间接接触培养系统[6]。收集11例患者外周血和BALF中分离的CD8+ T细胞,加入终浓度为5 μg/L的重组人IL-7刺激培养12 h,收集上清,进行后续检测。然后洗涤细胞2次,去除IL-7,再将CD8+ T细胞与自体分离的原代NSCLC细胞以1∶5的比例进行共培养。在直接接触培养系统中,将CD8+ T细胞与原代NSCLC细胞直接混合培养,并加入终浓度为1 μg/L的抗CD3/CD28抗体刺激培养。在间接接触培养系统中,CD8+ T细胞与原代NSCLC细胞分别接种于Transwell培养平板的上层小室和下层培养孔中,上层小室的底部为孔径直径为0.4 μm的滤膜,细胞不能通过滤膜,但可溶性的细胞因子可以通过滤膜。向上层小室中加入抗CD3/CD28抗体。培养48 h后收集培养上清,进行后续检测。
使用ELISA检测试剂盒检测血清、BALF或细胞培养上清中IL-7、IFN-γ和TNF-α的水平。
取106个纯化的CD8+ T细胞,使用Trizol试剂提取总RNA。反转录反应体系:5×缓冲液2 μl,反转录酶混合物I 0.5 μl,寡聚胸腺嘧啶引物0.5 μl,随机六核苷酸引物0.5 μl,总RNA 1 μg,加入不含RNA酶的去离子水调整总体积至10 μl。反应条件:37 ℃ 15 min,85 ℃ 5 s。SYBR实时定量PCR反应体系:SYBR预混Taq酶10 μl,上游引物(10 μmol/L)0.4 μl,下游引物(10 μmol/L)0.4 μl,ROX参考染料0.4 μ,cDNA 2 μl,灭菌水6.8 μl。反应条件:预变性:95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 30 s。应用2-ΔΔCT法对目的片段的相对表达量进行分析。引物序列:(1)CD127:上游5′ AAAGTTTTAATGCACGATGTAGCTT 3′,下游5′ TGTGCTGGATAAATTCACATGC 3′;(2)β-肌动蛋白:上游5′ TGGCACCAGCACAATGAA 3′,下游5′ CTAAGTCATAGTCCGCCTAGAAGCA 3′。
应用CCK-8试剂盒按说明书操作。在培养的最后4 h,向培养孔中加入20 μl CCK-8反应液,检测细胞培养液在450 nm处的吸光度,同时设立标准曲线,计算培养细胞的细胞数。
用PBS洗涤细胞,加入50 μl 2×SDS缓冲液和1 μl β-巯基乙醇,孵育5 min后用细胞刮将细胞完全刮下,转移至离心管中,95 ℃孵育10 min,12 000×g离心1 min。将待测蛋白样本加入SDS-PAGE电泳浓缩胶孔中,将蛋白分离后转移至PVDF膜,用含5%脱脂奶粉的封闭缓冲液封闭转膜后的PVDF膜,洗涤后将抗信号传导及转录激活因子5(STAT5)、抗磷酸化STAT5(pSTAT5)、抗细胞因子信号抑制物3(SOCS3)、抗磷酸甘油醛脱氢酶(GAPDH)用一抗稀释液以1∶1 000进行稀释,加入PVDF膜,4 ℃孵育过夜。洗涤后将抗兔IgG-HRP用封闭缓冲液以1∶2 000进行稀释,加入PVDF膜,室温孵育1 h。洗涤后化学发光成像。利用Image J软件对蛋白条带进行半定量检测,将目标蛋白的灰度值以看家基因GAPDH的灰度值作为参照进行半定量分析。
通过检测培养上清中LDH评估原代NSCLC细胞的死亡比例。应用LDH细胞毒性检测试剂盒检测培养上清中LDH水平,以原代NSCLC细胞培养上清中的LDH水平作为"低水平LDH对照",以Triton X-100处理的原代NSCLC细胞培养上清中的LDH水平作为"高水平LDH对照",按以下公式计算靶细胞死亡比例:(样本LDH水平-低水平LDH对照)/(高水平LDH对照-低水平LDH对照)×100%。
使用SPSS 19.0统计软件进行数据分析。正态分布的计量资料采用 ±s表示,采用Student t检验或配对t检验进行两组间数据比较,非正态分布的计量资料采用M(Q1,Q3)表示,采用Mann-Whitney U检验或Wilcoxon配对检验进行两组间数据比较。P<0.05为差异有统计学意义。
±s表示,采用Student t检验或配对t检验进行两组间数据比较,非正态分布的计量资料采用M(Q1,Q3)表示,采用Mann-Whitney U检验或Wilcoxon配对检验进行两组间数据比较。P<0.05为差异有统计学意义。
肺癌组外周血IL-7水平显著低于对照组,但外周血IL-7水平在肺鳞癌和肺腺癌中的差异无统计学意义。肿瘤部位收集的BALF中IL-7水平显著低于非肿瘤部位,但肿瘤部位收集的BALF中IL-7水平在肺鳞癌和肺腺癌中的差异亦无统计学意义。外周血CD8+ T细胞中CD127 mRNA的相对表达量在肺癌组和对照组中的差异无统计学意义,BALF中CD8+ T细胞CD127 mRNA的相对表达量在肿瘤部位和非肿瘤部位的差异亦无统计学意义(表1)。
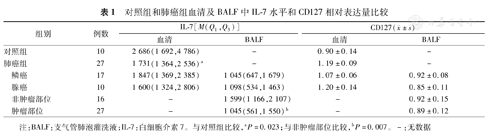
对照组和肺癌组血清及BALF中IL-7水平和CD127相对表达量比较
对照组和肺癌组血清及BALF中IL-7水平和CD127相对表达量比较
| 组别 | 例数 | IL-7[M(Q1,Q3)] | CD127( ±s) ±s) | |||
|---|---|---|---|---|---|---|
| 血清 | BALF | 血清 | BALF | |||
| 对照组 | 10 | 2 686(1 692,4 786) | - | 0.90±0.14 | - | |
| 肺癌组 | 27 | 1 731(1 364,2 536)a | - | 1.19±0.09 | - | |
| 鳞癌 | 17 | 1 847(1 369,2 385) | 1 045(647,1 679) | 1.07±0.06 | 0.92±0.08 | |
| 腺癌 | 10 | 1 600(1 324,2 806) | 1 098(534,1 463) | 1.20±0.14 | 0.85±0.11 | |
| 非肿瘤部位 | 16 | - | 1 599(1 166,2 107) | - | 0.92±0.15 | |
| 肿瘤部位 | 27 | - | 1 045(561,1 550)b | - | 0.89±0.12 | |
注:BALF:支气管肺泡灌洗液;IL-7:白细胞介素7。与对照组比较,aP=0.023;与非肿瘤部位比较,bP=0.007。-:无数据
经IL-7刺激的CD8+ T细胞增殖显著高于无IL-7刺激的CD8+ T细胞,但有无IL-7刺激对原代NSCLC的增殖数量的差异无统计学意义。经IL-7刺激的CD8+ T细胞分泌IFN-γ和TNF-α的水平显著高于无IL-7刺激的CD8+ T细胞,但原代NSCLC细胞几乎不分泌IFN-γ和TNF-α。8例肺癌组患者分离的原代NSCLC细胞中,6例在未刺激或IL-7刺激后培养上清中均检测不到IFN-γ和TNF-α,另2例IFN-γ和TNF-α水平极低。经IL-7刺激的CD8+ T细胞中pSTAT5和SOCS3相对表达量显著高于无IL-7刺激的CD8+ T细胞,而STAT5相对表达量在经IL-7刺激和无IL-7刺激的CD8+ T细胞中相对表达量的差异无统计学意义(表2)。
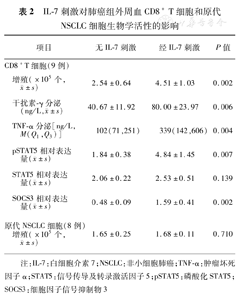
IL-7刺激对肺癌组外周血CD8+ T细胞和原代NSCLC细胞生物学活性的影响
IL-7刺激对肺癌组外周血CD8+ T细胞和原代NSCLC细胞生物学活性的影响
| 项目 | 无IL-7刺激 | 经IL-7刺激 | P值 | |
|---|---|---|---|---|
| CD8+T细胞(9例) | ||||
增殖(×105个, ±s) ±s) | 2.54±0.64 | 4.51±1.03 | 0.002 | |
干扰素-γ分泌(ng/L, ±s) ±s) | 40.67±11.92 | 80.00±23.97 | 0.006 | |
| TNF-α分泌[ng/L,M(Q1,Q3)] | 102(71,251) | 339(142,606) | 0.004 | |
pSTAT5相对表达量( ±s) ±s) | 1.84±0.38 | 4.84±1.45 | 0.007 | |
STAT5相对表达量( ±s) ±s) | 2.06±0.22 | 2.53±0.51 | 0.139 | |
SOCS3相对表达量( ±s) ±s) | 0.48±0.09 | 1.59±0.41 | 0.002 | |
| 原代NSCLC细胞(8例) | ||||
增殖(×105个, ±s) ±s) | 1.65±0.25 | 1.68±0.11 | 0.710 | |
注:IL-7:白细胞介素7;NSCLC:非小细胞肺癌;TNF-α:肿瘤坏死因子α;STAT5:信号传导及转录激活因子5;pSTAT5:磷酸化STAT5;SOCS3:细胞因子信号抑制物3
经IL-7刺激后,无论外周血分离的CD8+ T细胞还是BALF中分离的CD8+ T细胞,其细胞杀伤功能显著高于无IL-7刺激的CD8+ T细胞,主要表现为在直接接触和间接接触培养系统中,靶细胞死亡率在经IL-7刺激的CD8+ T细胞中均显著高于无IL-7刺激的CD8+ T细胞。在直接接触培养系统中,经IL-7刺激后,无论外周血分离的CD8+ T细胞还是BALF中分离的CD8+ T细胞,分泌IFN-γ和TNF-α的水平均显著高于无IL-7刺激的CD8+ T细胞;但在间接接触培养系统中,经IL-7刺激的CD8+ T细胞分泌IFN-γ的水平明显升高,但在经IL-7刺激和无IL-7刺激之间分泌TNF-α的水平的差异无统计学意义(表3)。
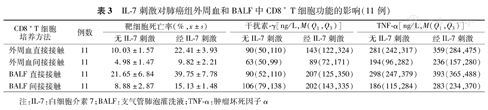
IL-7刺激对肺癌组外周血和BALF中CD8+ T细胞功能的影响(11例)
IL-7刺激对肺癌组外周血和BALF中CD8+ T细胞功能的影响(11例)
| CD8+T细胞培养方法 | 例数 | 靶细胞死亡率(%, ±s) ±s) | 干扰素-γ[ng/L,M(Q1,Q3)] | TNF-α[ng/L,M(Q1,Q3)] | |||
|---|---|---|---|---|---|---|---|
| 无IL-7刺激 | 经IL-7刺激 | 无IL-7刺激 | 经IL-7刺激 | 无IL-7刺激 | 经IL-7刺激 | ||
| 外周血直接接触 | 11 | 10.03±1.57 | 22.41±3.93 | 90(50,110) | 143(122,324) | 281(242,317) | 359(284,475) |
| 外周血间接接触 | 11 | 4.98±1.47 | 9.82±2.21 | 63(50,99) | 89(72,171) | 194(96,282) | 236(157,280) |
| BALF直接接触 | 11 | 21.65±6.84 | 39.75±7.78 | 90(52,110) | 207(125,350) | 298(247,379) | 393(365,488) |
| BALF间接接触 | 11 | 8.88±2.87 | 15.13±1.48 | 106(79,138) | 202(143,335) | 186(115,284) | 283(234,370) |
注:IL-7:白细胞介素7;BALF:支气管肺泡灌洗液;TNF-α:肿瘤坏死因子α
研究发现,IL-7在NSCLC患者的肺癌组织中高表达,但在正常支气管上皮、腺体和肺泡上皮细胞中不表达[7];骨转移的NSCLC细胞可高表达IL-7[8]。本研究结果与文献并不完全一致,这种差异可能与检测不同组织类型及不同疾病的免疫状态有关[9]。慢性病毒感染和肿瘤等机体免疫应答受抑制可能导致IL-7水平下降,这可能是造成NSCLC患者IL-7水平降低的原因之一。另外,IL-7对NSCLC细胞的生物学活性并无显著影响,但可显著增加CD8+ T细胞增殖和分泌细胞因子的能力,进一步说明IL-7可能主要影响淋巴细胞功能。
CD8+ T细胞是重要的抗肿瘤免疫细胞,恢复CD8+ T细胞功能是肿瘤治疗的研究热点之一。在IL-7治疗黑色素瘤和肾癌的临床试验中,CD8+ T细胞的增殖与IL-7用量呈显著正相关[10]。但尚未见到IL-7对NSCLC患者CD8+ T细胞功能调控作用的相关报告。CD8+ T细胞可通过细胞杀伤功能和非细胞杀伤功能发挥抗肿瘤活性。本研究利用直接和间接接触细胞培养系统,观察CD8+ T细胞的这些功能在抗NSCLC中的作用。在直接接触培养中,BALF的CD8+ T细胞的直接细胞杀伤功能较外周血CD8+ T细胞的增强,这可能与肺癌部位的T细胞长期接受肿瘤抗原和肿瘤细胞的刺激有关。IL-7刺激后,靶细胞的死亡显著增加,并伴有分泌IFN-γ和TNF-α的水平增加,提示IL-7可增强细胞杀伤和非细胞杀伤的双重功能。在间接接触培养中,虽然IL-7刺激亦可增加靶细胞的死亡,但主要表现为分泌IFN-γ的水平增加,而分泌TNF-α的水平无明显变化,提示IFN-γ是发挥抗肿瘤效应的主要细胞因子。
总之,NSCLC患者中低表达的IL-7可能与NSCLC患者中CD8+ T细胞抗肿瘤效应降低有关。外源性的IL-7可能增强NSCLC患者CD8+ T细胞的抗肿瘤活性。但本研究入组数量相对较少,且均为体外试验,结论还需扩大样本量并进行体内试验以进一步验证。



























