
探讨血清骨代谢物Ⅰ型胶原羧基端肽β特殊序列(β-CTX)、Ⅰ型前胶原氨基端延长肽(PINP)浓度及β-CTX/PINP比值对于多发性骨髓瘤骨病(MMBD)及骨转移瘤的临床意义。
纳入2016年10月至2017年10月分别于河南省人民医院血液科、肿瘤科及体检中心就诊的初诊MM 31例、骨转移瘤46例及健康对照12例。依据影像学表现将MMBD分为0~4级,骨病0~2级为A组(8例),3~4级为B组(23例)。化疗两疗程后评价疗效,将MM分为化疗有效组(部分缓解以上,22例)和无效组(未达部分缓解,9例);ELISA法检测血清β-CTX、PINP表达水平并计算β-CTX/PINP比值。
初诊MM、骨转移瘤及健康对照血清β-CTX浓度分别为(3 563±544) ng/L、(6 690±343) ng/L、(2 726±1 026) ng/L(χ2 =22.207, P<0.001),PINP浓度分别为(72±14) ng/L、(112±62) ng/L、(171±62) ng/L (χ2=7.418,P=0.024)及β-CTX/PINP比值分别为93±19、141±21、17±8(χ2=20.192,P<0.001),差异均有统计学意义。初诊MM β-CTX/PINP比值高于健康对照(P=0.001),骨转移瘤β-CTX浓度(P=0.003)及β-CTX/PINP比值(P<0.001)均高于健康对照。初诊MM血清β-CTX浓度低于骨转移瘤(P<0.001)。初诊骨髓瘤A、B两组血清β-CTX、PINP浓度差异均无统计学意义,但A组血清β-CTX/PINP比值低于B组,差异有统计学意义。化疗两疗程后,MM血清β-CTX浓度(P= 0.023)及β-CTX/PINP比值(P<0.001)均降低;A组血清β-CTX、PINP浓度及β-CTX/PINP比值较治疗前差异均无统计学意义,B组患者血清PINP浓度较治疗前无明显变化,但血清β-CTX浓度及β-CTX/PINP比值较治疗前均降低[(4 027± 647)ng/L比(2 370 ± 460)ng/L, P=0.043;111 ± 23比30±6, P=0.002]。化疗有效组血清β-CTX/PINP比值降低,差异有统计学意义;化疗无效组血清β-CTX、PINP浓度及β-CTX/PINP比值较前差异均无统计学意义。
血清β-CTX在初诊MMBD与骨转移瘤中存在差异,或可成为鉴别诊断的辅助指标。β-CTX/PINP比值与MMBD严重程度正相关,可用于评价骨病的严重程度;其比值对于MM的治疗有一定的监测意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(Multiple myeloma, MM)是由于骨髓中浆细胞恶性增殖引起的血液系统恶性疾病。由于骨质破坏所导致的一系列骨痛、骨质疏松、高钙血症、病理性骨折、脊髓压迫等一系列溶骨性病变称为骨髓瘤骨病(Multiple myeloma bone disease, MMBD)。约70%MM患者以MMBD为首诊症状,且在疾病进展过程中超过90%患者会出现MMBD[1],严重降低了MM患者的生存质量及生存率。除MMBD外,恶性肿瘤并发骨转移的发生率也较高,出现一系列骨病症状,易与MMBD相混淆。早期明确骨病原因并治疗,改善患者生存质量成为当前亟待解决的重要临床问题。研究表明,血清Ⅰ型胶原蛋白羧基末端肽(CTX)和Ⅰ型前胶原氨基端前肽(PINP)分别是临床上评价破骨细胞(OC)和成骨细胞(OB)活性最具参考价值的生化指标[2],且其变化早于影像学表现,有助于早期诊断与治疗。为探讨血清Ⅰ型胶原羧基端肽β特殊序列(β-CTX)、PINP浓度及β-CTX/PINP比值在MMBD诊疗中的临床意义,本研究检测了MMBD、骨转移瘤及健康对照的血清β-CTX、PINP浓度及β-CTX/PINP比值,证实了血清β-CTX、PINP浓度及β-CTX/PINP比值在MMBD中的意义。
纳入89例2016年10月至2017年10月于河南省人民医院确诊的MMBD、骨转移瘤患者及健康对照者,所有入组人员均知情同意并自愿参与本研究。MM 31例,其中男18例,女13例;中位年龄62(43~83)岁;IgG型22例,IgA型5例,IgD型3例,轻链型1例。国际分期体系(ISS分期):Ⅰ期3例,Ⅱ期9例,Ⅲ期19例。骨转移瘤46例,男22例,女24例;中位年龄54(32~89)岁。其中,肺癌28例,乳腺癌6例,肝癌3例,前列腺癌2例,卵巢癌1例,胰腺癌1例,尿路上皮癌1例,恶性神经鞘瘤1例,膀胱癌1例。健康对照12例,男6例,女6例;中位年龄51(26~63)岁,近期无骨折、外伤、肿瘤等病史。
MM诊断标准参照中国多发性骨髓瘤诊治指南(2017年修订)[3],分期体系参照ISS分期[4],MMBD诊断标准参照多发性骨髓瘤骨病诊治指南[5], MMBD严重程度分级主要根据X线平片分为0~4级[6]:0级为无骨病变,1级为弥漫性骨质疏松,2级为1个解剖学部位的1个以上溶骨性损害,3级为1个以上解剖学部位的多个溶骨性损害,4级为溶骨性损害严重、并发病理性骨折。骨病0~2级者为A组,3~4级者为B组。
MM化疗方案为BCD方案:硼替佐米(1.3 mg/m2,d1、d4、d8、d11,3个部位皮下注射)+环磷酰胺(600 mg/m2, d1、d11,静脉点滴)+地塞米松(20 mg/d, d1~2, d4~5, d8~9, d11~12,静脉点滴),每12天为一个疗程。MMBD患者每月给予唑来膦酸4 mg/次,静脉点滴。化疗两疗程后疗效评判标准参考2016年IMWG疗效标准[7],将疗效达部分缓解(PR)以上者归为化疗有效组,未达PR者归为化疗无效组。
抽取入组对象清晨6:00空腹静脉血标本,MMBD组标本采集时机为化疗前及两疗程后第10天、骨转移瘤组于确诊骨转移后采集标本、健康对照组每月采集一次标本(共3次)。室温下静置60 min后,3 000 r/min离心10 min,提取上清,ELISA法检测I型胶原羧基端肽β特殊序列(β-CTX)和Ⅰ型前胶原氨基端前肽(PINP)OD值,用Curve Expert 1.4软件计算对应浓度,并计算β-CTX/PINP比值。
统计学分析采用SPSS 22.0软件,符合正态分布的计量资料采用 ±s表示,两组间比较采用t检验或校正的t检验;非正态分布的采用中位数(范围)表示,两组间的比较采用非参数检验;两组间率的比较采用χ2检验或Fisher确切概率检验。P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验或校正的t检验;非正态分布的采用中位数(范围)表示,两组间的比较采用非参数检验;两组间率的比较采用χ2检验或Fisher确切概率检验。P<0.05为差异有统计学意义。
MM组一般临床特点:28例MMBD发生溶骨性病变,初诊时伴骨痛者22例,无骨痛者9例。根据影像学表现,MMBD 0级1例,1级3例,2级4例,3级14例,4级9例。A组(骨病0~2级)8例、B组(骨病3~4级) 23例,两组性别、年龄、诊断分型、初诊时血清乳酸脱氢酶(LDH)、血红蛋白(Hb)、血清白蛋白、血肌酐(Cr)、血钙、β2-微球蛋白差异无统计学意义(P>0.05);但A组的白球比(A/G)高于B组(P=0.032),差异有统计学意义(表1)。
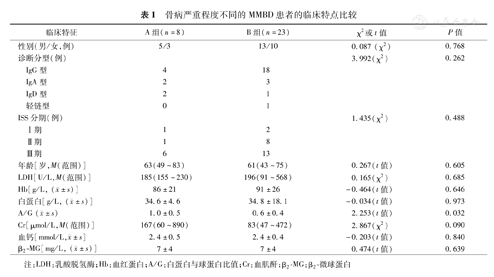
骨病严重程度不同的MMBD患者的临床特点比较
骨病严重程度不同的MMBD患者的临床特点比较
| 临床特征 | A组(n=8) | B组(n=23) | χ2或t值 | P值 | |
|---|---|---|---|---|---|
| 性别(男/女,例) | 5/3 | 13/10 | 0.087 (χ2) | 0.768 | |
| 诊断分型(例) | 3.992(χ2) | 0.262 | |||
| IgG型 | 4 | 18 | |||
| IgA型 | 2 | 3 | |||
| IgD型 | 2 | 1 | |||
| 轻链型 | 0 | 1 | |||
| ISS分期(例) | 1.435(χ2) | 0.488 | |||
| Ⅰ期 | 1 | 2 | |||
| Ⅱ期 | 1 | 8 | |||
| Ⅲ期 | 6 | 13 | |||
| 年龄[岁,M(范围)] | 63(49~83) | 61(43~75) | 0.267(t值) | 0.605 | |
| LDH[U/L,M(范围)] | 185(155~230) | 196(91~568) | 0.165(χ2) | 0.685 | |
Hb[g/L, ( ±s)] ±s)] | 86±21 | 91±26 | -0.464(t值) | 0.646 | |
白蛋白[g/L, ( ±s)] ±s)] | 34.6±4.6 | 34.8±18.1 | -0.034(t值) | 0.973 | |
A/G ( ±s) ±s) | 1.0±0.5 | 0.6±0.4 | 2.253(t值) | 0.032 | |
| Cr[μmol/L,M(范围)] | 167(60~890) | 83(47~472) | 2.867(χ2) | 0.090 | |
血钙[mmol/L, ±s] ±s] | 2.4±0.5 | 2.4±0.4 | -0.203(t值) | 0.840 | |
β2-MG[mg/L, ( ±s)] ±s)] | 7±4 | 7±4 | 0.474(t值) | 0.639 | |
注:LDH:乳酸脱氢酶;Hb:血红蛋白;A/G:白蛋白与球蛋白比值;Cr:血肌酐;β2-MG:β2-微球蛋白
初诊MMBD、骨转移瘤及健康对照3组血清β-CTX浓度分别为(3 563±544) ng/L、(6 690±343) ng/L、(2 726±1 026)ng/L(χ2=22.207,P<0.001), PINP分别为(72±14) ng/L、(112±62) ng/L、(171±62) ng/L (χ2=7.418,P=0.024),而β-CTX/PINP比值分别为93±19、141±21、17±8(χ2=20.192,P<0.001),差异均有统计学意义。三组两两比较时,初诊MMBDβ-CTX/PINP比值高于健康对照(P=0.001),骨转移瘤组β-CTX浓度(t=3.663,P=0.003)及β-CTX/PINP比值(t=5.570,P<0.001)均高于健康对照,初诊MM血清β-CTX浓度低于骨转移瘤组(t=-4.861,P<0.001)。
治疗前,MMBD A、B两组血清β-CTX、PINP浓度差异均无统计学意义,A组血清β-CTX/PINP比值低于B组(40±22比111±23, t=-2.232,P=0.036),差异有统计学意义。A组患者在治疗前及两疗程后比较,血清β-CTX、PINP浓度变化及β-CTX/PINP比值差异均无统计学意义,B组患者治疗治疗前及两疗程后血清PINP浓度无明显差别,但血清β-CTX浓度及β-CTX/PINP比值较治疗前均降低[(4 027±648)ng/L比(2 370±460) ng/L,P=0.043;111±23比30±6,P=0.002],差异有统计学意义。两疗程后A组患者血清β-CTX浓度仍低于B组(P=0.029),差异有统计学意义(表2)。两疗程后MMBD血清β-CTX浓度降至(2 026±366)ng/L,低于治疗前,差异有统计学意义(t=-2.344,P=0.023);PINP治疗前后差异无统计学意义[(72±14)比(135±35) ng/L,t=-1.643,P=0.106],两疗程后31例MMBD患者的血清β-CTX/PINP低于治疗前,且差异有统计学意义(93±19比26±5,t=3.474,P<0.001)。
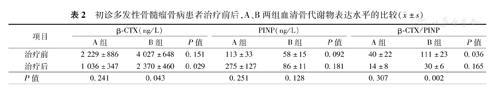
初诊多发性骨髓瘤骨病患者治疗前后,A、B两组血清骨代谢物表达水平的比较( ±s)
±s)
初诊多发性骨髓瘤骨病患者治疗前后,A、B两组血清骨代谢物表达水平的比较( ±s)
±s)
| 项目 | β-CTX(ng/L) | PINP(ng/L) | β-CTX/PINP | ||||||
|---|---|---|---|---|---|---|---|---|---|
| A组 | B组 | P值 | A组 | B组 | P值 | A组 | B组 | P值 | |
| 治疗前 | 2 229±886 | 4 027±648 | 0.151 | 113±33 | 58±15 | 0.092 | 40±22 | 111±23 | 0.036 |
| 治疗后 | 1 036±347 | 2 370±460 | 0.029 | 275±127 | 86±11 | 0.181 | 14±8 | 30±6 | 0.165 |
| P值 | 0.241 | 0.043 | 0.251 | 0.128 | 0.307 | 0.002 | |||
化疗有效组(MMBD,22例)血清PINP、β-CTX浓度治疗前及两疗程后相比差异均无统计学意义;而治疗前及两疗程后血清β-CTX/PINP比值分别为112±24、28±6(P=0.003)差异有统计学意义。化疗无效组(MMBD,9例)患者治疗前、两疗程后血清骨代谢物浓度变化差异均无统计学意义(表3)。
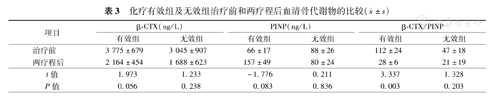
化疗有效组及无效组治疗前和两疗程后血清骨代谢物的比较( ±s)
±s)
化疗有效组及无效组治疗前和两疗程后血清骨代谢物的比较( ±s)
±s)
| 项目 | β-CTX(ng/L) | PINP(ng/L) | β-CTX/PINP | ||||
|---|---|---|---|---|---|---|---|
| 有效组 | 无效组 | 有效组 | 无效组 | 有效组 | 无效组 | ||
| 治疗前 | 3 775±679 | 3 045±907 | 66±17 | 88±26 | 112±24 | 47±18 | |
| 两疗程后 | 2 164±454 | 1 688±623 | 157±49 | 80±24 | 28±6 | 21±19 | |
| t值 | 1.973 | 1.233 | -1.776 | 0.211 | 3.337 | 1.328 | |
| P值 | 0.056 | 0.238 | 0.083 | 0.836 | 0.003 | 0.203 | |
MMBD的发生主要是由于MM细胞恶性增殖浸润,与骨髓基质细胞相互作用并释放破骨细胞活化因子激活OC细胞并抑制OB细胞活性,从而导致骨吸收与骨形成严重失衡引起的。骨基质中90%以上为Ⅰ型胶原蛋白,其合成速率及骨形成情况可由血清PINP浓度来表示,而其降解时产生交联产物CTX并释放入血,经肾脏代谢,血清β-CTX可反应骨吸收的情况。骨吸收与骨形成的失衡程度可由β-CTX/PINP比值来表示[2]。
本研究结果显示,初诊MMBD组、骨转移瘤组、健康对照组三组血清β-CTX、PINP浓度及β-CTX/PINP比值差异均有统计学意义。Ting等[8]比较了86例MM(初诊32例、缓解31例、复发23例)和26例对照的血清β-CTX及PINP水平,发现血清β-CTX浓度在初诊MM组最高[(0.8±0.4)μg/L],高于对照组,缓解组最低[(0.10±0.07)μg/L](P<0.001),血清PINP浓度的差异均无统计学意义。但本研究中初诊MMBD血清β-CTX/PINP比值高于健康对照,且差异有统计学意义。除MMBD外,血清β-CTX、PINP在骨转移瘤中的研究也有所进展。Lumachi等[9]检测了34例非小细胞肺癌患者的血清CTX、PINP、抗酒石酸酸性磷酸酶(TRACP-5b)、癌胚抗原(CEA),其中伴有骨转移组16例,无骨转移对照组18例,结果发现骨转移组的血清CTX及PINP均明显高于对照组,其他标志物无明显差异。在本研究中,骨转移瘤组血清β-CTX浓度(P=0.003)及β-CTX/PINP比值(P<0.001)明显高于对照组,由此可见,血清β-CTX浓度及β-CTX/PINP比值在骨转移瘤的筛查及诊断中具有重要意义,与CT、MRI等联用有助于早期明确骨转移瘤的诊断。MMBD只存在溶骨性病变,骨转移瘤既存在溶骨性病变,也存在成骨性病变,本研究中初诊MMBD组β-CTX浓度低于骨转移瘤,差异有统计学意义[(3 563±544) ng/L比(6 690±343)ng/L,P<0.001],可见骨转移瘤破骨细胞活性更强,溶骨更加严重,测定因骨病首诊患者的血清β-CTX可用于鉴别MM和骨转移瘤。
Auzina等[10]比较初诊MMBD与健康对照血清β-CTX浓度后发现健康对照组血清β-CTX浓度低于初诊MMBD组(P<0.001),并且MMBD组骨病分级越严重,β-CTX浓度越高(rs=0.51,P<0.001)。本研究中初诊MMBD组血清β-CTX/PINP比值高于健康对照,骨病较轻的A组β-CTX/PINP低于骨病较重的B组,两疗程后B组血清β-CTX浓度及β-CTX/PINP比值较治疗前均显著降低,说明血清β-CTX/PINP比值与骨病分级呈正相关,可用于治疗前评价MMBD严重程度。
本研究中31例MMBD总体β-CTX水平较治疗前下降(P=0.023)、β-CTX/PINP也降低(P<0.001);有效组血清β-CTX/PINP比值较治疗前明显降低,且差异有统计学意义,而血清β-CTX、PINP浓度变化差异无统计学意义,与国内外文献报道类似[10,11]。对于MM疗效的监测,血清β-CTX/PINP比值可能比血清β-CTX、PINP浓度更加灵敏。但在化疗无效组中,血清骨代谢物浓度及其比值在治疗前后并无明显变化,或与疗程较短、样本量较少相关,应扩大样本量、进一步评价更多疗程后的血清骨代谢物浓度与疗效的关系。
综上所述,初诊MMBD组与骨转移瘤组血清β-CTX浓度差异显著,或可作为鉴别诊断的辅助指标;血清β-CTX/PINP比值不仅可用于评价MMBD骨病严重程度,对于MM化疗效果也有一定的监测价值。































