
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性高热(MH)是一种具有家族遗传性的肌肉病,是主要由挥发性吸入麻醉药和去极化肌松药-琥珀酰胆碱所触发的骨骼肌异常高代谢状态。MH易感者一旦发病,病情进展迅速,表现为全身肌肉痉挛、体温急剧持续升高、耗氧量急速增加、CO2大量生成,产生呼吸性和代谢性酸中毒,在没有特异性治疗药物的情况下,一般的临床降温及治疗措施难以控制病情进展,最终患者可因多器官功能衰竭而死亡[1,2,3,4,5]。
MH的流行病学资料很难确定,主要原因是:大规模的MH诊断试验难以实施;依靠单纯的临床征象诊断MH仍有争议;MH易感者接触诱发因素有时并无典型的MH临床表现;统计时未能搜集所有MH病例等。
根据国外文献报道[1,2],儿童MH的发病率(1/15 000)高于成人(1/50 000),男性多于女性,在先天性疾病如特发性脊柱侧弯、斜视、上睑下垂、脐疝、腹股沟疝等患者中多见。20世纪60年代MH的病死率高达90%,随着对MH认识的不断深入、诊断治疗水平的不断提高及特异性治疗药物的普及,目前发达国家已将MH病死率控制在5%~10%以下。我国近年来也出现多例MH病例的报道,但病死率非常高(73.5%)[6,7]。
<推荐意见1>儿童MH发病率高于成人,我国MH有散在报道,病死率高。
MH是骨骼肌细胞的钙离子调节障碍导致的细胞内钙离子水平异常升高进而引起的一系列功能障碍。MH易感者的骨骼肌神经肌肉接头功能正常,肌细胞的结构正常,未发作时肌浆中钙离子浓度也正常。但因肌浆网膜上的Ryanodine受体(蓝尼定受体)存在异常,在触发因素(主要是挥发性吸入麻醉药和琥珀酰胆碱)的作用下,发生钙离子释放的异常增加而不能有效重摄取,导致肌浆内钙离子浓度异常增高,骨骼肌细胞发生强直收缩,产热增加,氧耗和CO2生成急剧增加,进而出现一系列高代谢症候群。患者可出现代谢性酸中毒、呼吸性酸中毒、低氧血症、高钾血症、心律失常、肌酸磷酸激酶(CPK)增高、肌红蛋白尿、肌肉水肿等病理生理变化,严重者可出现脑水肿、弥散性血管内凝血(DIC)、心肾功能衰竭等表现[1,2,3,4,5]。
<推荐意见2>MH易感者骨骼肌细胞存在异常,钙离子调节障碍,在触发因素(主要是挥发性吸入麻醉药和琥珀酰胆碱)的作用下,发生钙离子释放的异常增加而不能有效重摄取,导致细胞内钙离子水平异常升高进而引起一系列高代谢症候群。
MH的遗传方式主要是常染色体显性遗传。研究证实蓝尼定受体-1(RYR1)基因异常是大部分MH发生的分子生物学基础。该基因(OMIM:180901)位于人类染色体19q12-q13.2,约160 kb,包括106个外显子,编码骨骼肌肌浆网钙通道蛋白——RYR1。与MH相关的突变主要集中在该通道蛋白N端35~614位氨基酸(外显子2~18)、C端3 916~4 973位氨基酸(外显子90~104)和中间区域2 163~2 458位氨基酸(外显子39~46)。在人类其他染色体上的基因改变也可能与MH有关,这些基因包括:(1)17q11.2-q24上编码二氢吡啶受体α1亚单位的基因(MHS2;OMIM:154275);(2)7q21-22上编码L-型Ca2+离子通道α2/δ亚单位的基因(MHS3;OMIM:154276);(3) 3q13.1上的基因(MHS4;OMIM:600467);(4) 1q32上编码Na+离子通道α亚单位和L-型Ca2+离子通道β和γ亚单位的CACNA1S基因(MHS5;OMIM:601887)[1,8,9]。
<推荐意见3>MH的遗传方式主要是常染色体显性遗传。RYR1基因异常是大部分MH发生的分子生物学基础。
MH可分成以下几种类型[1,5,10,11],其中爆发型MH具有典型的临床表现,是临床通常所指的MH,但其他类型也存在,且可因为诱发药物的作用时间延长而转变为爆发型MH,也应引起足够重视。
突然发生的高碳酸血症(呼气末二氧化碳持续升高)、高钾血症、心动过速、严重缺氧和酸中毒(呼吸性和代谢性)、体温急剧升高(可能是早期,也可能是晚期体征,每15分钟可升高0.5 ℃,最高可达40 ℃以上)和肌肉僵硬,多数患者在数小时内死于顽固性心律失常和循环衰竭。即使早期抢救成功,患者也往往死于严重的DIC和继发性肌红蛋白尿引起的肾功能衰竭。在发病的24~36 h内,上述症状可能再次发作。爆发型MH至少包括以下症状体征中的3种:心脏症状、酸中毒、高碳酸血症、发热、肌肉强直。
使用琥珀酰胆碱后出现咬肌僵硬,可能是MH的早期症状。肌酸磷酸激酶(CPK)可发生变化。
不常见。可能在全身麻醉结束不久才出现,通常在术后1 h之内开始。
术后24 h内出现,肌肉的坏死程度超过预期的伴随疾病的严重程度。
MH的典型临床表现源于骨骼肌高代谢与损伤。虽然心血管、呼吸系统与肝脏在MH危象中均受到影响,但这些器官系统的改变都是继发于骨骼肌强直收缩而出现的继发变化。肾脏衰竭也是继发于骨骼肌损伤造成的肌红蛋白尿。MH患者的体温中枢调节正常,体温升高是由于骨骼肌强烈收缩产生的热量不能及时散发到周围环境中造成的。
<推荐意见4>MH包括几种类型,其中爆发型MH具有典型的临床表现,骨骼肌高代谢与损伤导致多脏器、系统的受损,直至衰竭。
可通过临床表现和血生化检查进行MH的诊断评估,评估指标、相应评分及发生MH可能性见表1,表2[5,10]。

恶性高热的临床评分标准
恶性高热的临床评分标准
| 项目 | 指标 | 分数 |
|---|---|---|
| 肌肉僵硬 | 全身肌肉僵硬(不包括由于体温降低和吸入麻醉苏醒期间及苏醒后即刻所导致的寒颤) | 15 |
| 静脉注射琥珀酰胆碱后咬肌痉挛 | 15 | |
| 肌溶解 | 静脉注射琥珀酰胆碱后肌酸磷酸激酶>20 000 U | 15 |
| 未应用琥珀酰胆碱 | 15 | |
| 麻醉后肌酸磷酸激酶>10 000 U | 10 | |
| 围手术期出现肌红蛋白尿,尿肌红蛋白>60 μg/L | 5 | |
| 血清肌红蛋白>170 μg/L | 5 | |
| 全血/血清/血浆K+>6 mEq/L(不包括合并肾衰时) | 3 | |
| 呼吸性酸中毒 | 在适当的控制呼吸条件下,呼气末CO2分压>55 mmHg | 15 |
| 在适当的控制呼吸条件下,动脉血CO2分压>60 mmHg | 15 | |
| 在自主呼吸条件下,呼气末CO2分压>60 mmHg | 15 | |
| 在自主呼吸条件下,动脉血CO2分压>65 mmHg | 15 | |
| 异常的高碳酸血症 | 15 | |
| 异常的呼吸过速 | 10 | |
| 体温升高 | 围手术期体温异常快速的升高(需根据麻醉医师的判断) | 15 |
| 围手术期体温异常升高(>38.8 ℃)(需根据麻醉医师的判断) | 10 | |
| 心律失常 | 异常的心动过速 | 3 |
| 室性心动过速或室颤 | 3 | |
| 家族史(仅用于筛选易感者) | 直系亲属中有恶性高热家族史 | 15 |
| 非直系亲属中有恶性高热家族史 | 5 | |
| 其他 | 动脉血气显示碱剩余低于-8 mEq/L | 10 |
| 动脉血气显示pH<7.25 | 10 | |
| 静脉注射丹曲林钠后呼酸及代酸很快纠正 | 5 | |
| 有恶性高热家族史伴有静息状态下肌酸磷酸激酶升高 | 10 | |
| 有恶性高热家族史伴有以上表现的任一种 | 10 |
注:1 mmHg=0.133 kPa
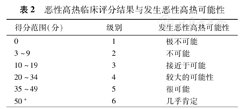
恶性高热临床评分结果与发生恶性高热可能性
恶性高热临床评分结果与发生恶性高热可能性
| 得分范围(分) | 级别 | 发生恶性高热可能性 |
|---|---|---|
| 0 | 1 | 极不可能 |
| 3~9 | 2 | 不可能 |
| 10~19 | 3 | 接近于可能 |
| 20~34 | 4 | 较大的可能性 |
| 35~49 | 5 | 很可能 |
| 50+ | 6 | 几乎肯定 |
目前,国际上公认咖啡因-氟烷骨骼肌收缩试验为确诊MH易感者的金标准[1,2,5]。该试验一般在8岁以上、体重超过20 kg的患者中实施。具体操作程序:取患者股四头肌或其他长肌近肌腱部位的肌纤维2~3 cm,固定于37 ℃恒温Krebs液内并持续通入含5% CO2的氧气,连接张力传感器和电刺激仪,给予一定电刺激,测定不同浓度氟烷和(或)咖啡因作用下肌肉张力的改变。根据欧洲MH研究组和北美MH研究组不同的实验条件和相应结果作出诊断。
欧洲MH诊断标准要求氟烷及咖啡因试验均为阳性才诊断为MH易感者,均为阴性时诊断为非MH易感者,如果仅咖啡因试验阳性则诊断为咖啡因型可疑MH(MHEc);如果仅氟烷试验阳性则诊断为氟烷型可疑MH(MHEh)。北美MH诊断标准则强调氟烷及咖啡因试验中任一试验阳性就诊断为MH易感者,均阴性才诊断为非MH易感者[11,12]。
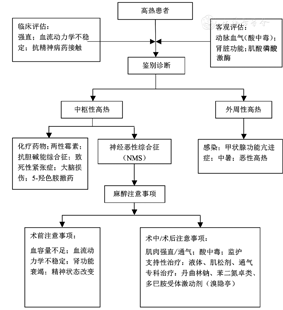
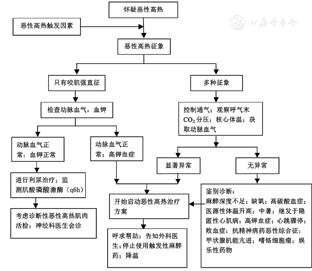
NMS是一种与使用抗精神病药相关的危及生命的代谢紊乱。与NMS相关的代表药包括氟哌啶醇和氟哌利多,但使用任何抗精神病药的患者均有风险。NMS在发病后有肌肉强直收缩,其临床表现也与MH非常相似,但两种疾病发病原因与机制完全不同。NMS有四大临床主征:肌强直、高热、植物神经功能紊乱及精神异常。表现为肌肉强直和横纹肌溶解症,中枢神经系统出现锥体外系征、意识改变和癫痫发作等。全身的症状包括体温过高(>38 ℃)、血压不稳、心动过速、呼吸急促和多汗。目前尚缺乏公认的NMS诊断标准,其诊断主要经鉴别诊断排除下列情况而定:(1)中枢性原因:其中包括药物反应(抗胆碱药物、两性霉素或化疗药物,五羟色胺撤退反应等)、创伤性脑损伤和致死性紧张症;(2)外周性原因:传染性疾病、甲状腺功能亢进、中暑和MH。对NMS有效的治疗药物包括溴隐亭(多巴胺激动剂)、丹曲林钠、苯二氮卓类药物和有助于改善强直患者通气的肌肉松弛剂。患者术后应转送重症监测病房继续支持性治疗,慎防肾功能衰竭。围手术期高热患者的鉴别诊断及麻醉注意事项见图1[5,14,15]。

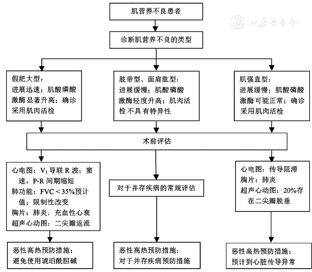
肌营养不良是指一组以进行性加重的肌无力和支配运动的肌肉变性为特征的遗传性疾病群[16,17]。肌营养不良患者麻醉管理流程见图2。

对于MH易感者,关键是避免MH发作,应做到以下几点[1,5,20,21]。
1.仔细询问家族麻醉史:对所有拟行全身麻醉的患者,特别是计划使用挥发性吸入麻醉药和琥珀酰胆碱者,应常规仔细询问家族麻醉史。
2.评估患者对MH的易感性:如前所述,有异常高代谢性的麻醉不良反应病史的患者、MH易感者一级亲属和患有先天性骨骼肌肉疾病的患者,是术中发生MH的高危患者。如果术前有不明原因的乳酸脱氢酶(LDH)或CPK显著升高,也应提高警惕,具体处理流程见图3。
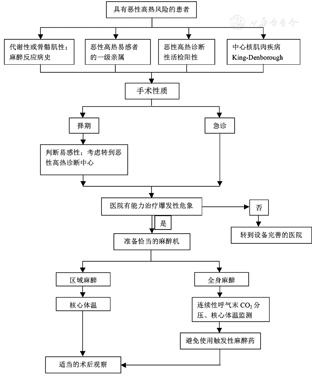

3.充足、适合的人员和设备:确保MH高危患者的围手术期安全。(1)配备训练有素的应急小组,随时准备应对和治疗MH危象。(2)实验室应可以快速进行血气、电解质、肌红蛋白、心肌酶谱等检查。配备适用设施设备,用于对症处理MH发作。(3)使用二氧化碳监护仪、核心体温监测仪、心电图(ECG)、血压监测仪、听诊器和脉搏血氧监测仪进行监测。(4)使用新的麻醉面罩和呼吸回路。如有条件可准备一台未使用过吸入性麻醉药的麻醉机或呼吸机。(5)如果设备不足以治疗爆发性MH的发作,应选择合适的医院重新安排手术。(6)有条件者,可依法合规备好治疗MH的特效药物(丹曲林钠)。目前我国大陆尚未生产及进口该药。现阶段如接受国外捐赠,应严格遵守我国颁布的有关规定。
4.避免使用诱发MH的麻醉药物:对于可疑或确诊的MH易感者,区域麻醉是较好的选择。一般情况下,局部麻醉药物均可安全使用。如果必须实施全身麻醉,应避免使用表3中所列的禁用药物。

恶性高热易感者禁用及可安全使用的药物
恶性高热易感者禁用及可安全使用的药物
| 禁用药物 | 可安全使用的药物 |
|---|---|
| 氟烷及所有挥发性吸入麻醉药 | 苯二氮卓类药、巴比妥类药、氧化亚氮、麻醉性镇痛药 |
| 琥珀酰胆碱 | 非去极化肌松药、异丙酚、局麻药(不加肾上腺素) |
5.如果麻醉过程无异常,术后观察患者至少3 h。如果观察到任何MH反应的显著征象,在MH征象最终消失后的12~24 h密切观察患者。
6.建议MH患者及家属进行实验室诊断及基因检测。
7.告知患者及其家属MH相关信息并进行随访。如果他们今后要接受麻醉,嘱其主动向麻醉科医师告知MH家族史。
<推荐意见7>对于MH,重在预防,对可疑易感者,避免使用能触发MH的麻醉药,选择安全的麻醉药物和麻醉方式。加强体温、呼气末CO2等术中监测和术后的随访。建议患者进行实验室诊断及基因检测。
目前国际上治疗MH的有效药物是丹曲林钠[22,23,24,25]。其机制是通过抑制肌浆网内钙离子释放,在骨骼肌兴奋-收缩耦联水平上发挥作用,使骨骼肌松弛。丹曲林钠不影响神经肌肉接头功能,也不影响骨骼肌细胞电活动。临床所用的Dantrium是冻干制剂,每瓶含有丹曲林钠20 mg、甘露醇3 g和一定量的氢氧化钠,pH值9.5。使用时每瓶丹曲林钠需用60 ml注射用水溶解。该药不良反应包括肌无力、髙血钾、消化道紊乱及血栓性静脉炎等,其与维拉帕米合用可产生显著的心肌抑制作用。该药在体内通过肝微粒体酶降解,代谢物经尿和胆汁排出,另有4%以原形从尿中排出。其消除半衰期为6~12 h。首次剂量为2.5 mg/kg,每5分钟可追加1次,直至症状消失,最大剂量可达10~20 mg/kg。一般不超过40 mg/kg。丹曲林钠新剂型——Ryanodex,每瓶含有250 mg丹曲林钠,用时5 ml注射用水溶解稀释,不可以用5%葡萄糖水或0.9%生理盐水代替,充分混匀成橘色不透明混悬液。目前尚无国产注射用丹曲林钠。
值得强调的是,丹曲林钠只是抢救MH的治疗措施之一,无论是否应用丹曲林钠,均应根据患者的具体情况及所在医疗机构的条件,积极进行物理降温,纠正内环境紊乱,保护重要脏器功能等对症处理措施。
<推荐意见8>目前国际上治疗MH有效药物是丹曲林钠。其治疗MH的可能机制是通过抑制肌质网内钙离子释放,在骨骼肌兴奋-收缩耦联水平上发挥作用,使骨骼肌松弛。丹曲林钠只是抢救MH的治疗措施之一,无论是否应用丹曲林钠,均应根据患者的具体情况及现有条件,积极进行物理降温,纠正内环境紊乱,保护重要脏器功能等对症处理措施。

如出现MH的临床表现,应尽快求助人员帮助并通知外科医师,尽快获取丹曲林钠。应立即终止吸入麻醉药和琥珀酰胆碱等,更换钠石灰和呼吸管路,呼吸环路吸入和呼出两侧加用活性炭过滤器(至少每1小时更换),并用高流量氧进行过度通气洗脱挥发性麻醉药物并降低呼气末CO2,尽快结束手术,如不能短时间内结束手术,应更换为使用不诱发MH的药物维持麻醉。大孔径通路静脉注射丹曲林钠,首次剂量2.5 mg/kg,必要时,丹曲林应用可能超过10 mg/kg,一般不超过40 mg/kg。重复应用,直至MH体征消退[1,5,23]。
MH发作急性期迅速开始下列治疗措施:核心体温>39 ℃时立即降温(包括戴冰帽及酒精擦浴、静脉输注冷生理盐水、体腔内冰盐水灌洗、甚至体外循环降温等),体温降到38 ℃时停止降温,防止体温过低;纠正酸中毒(过度通气,pH<7.2时静滴碳酸氢钠);纠正电解质紊乱,主要治疗高钾血症(过度通气、碳酸氢钠、葡萄糖、胰岛素和钙剂等,难以纠正时及早考虑血液净化治疗)并监测血糖;纠正心律失常(纠正酸中毒和高钾血症通常有效);适当应用血管活性药等,以稳定血流动力学;持续监测呼气末二氧化碳分压(ETCO2)、分钟通气量、电解质、血气分析、CPK、核心体温、尿量和颜色、凝血功能等,监测尿量,如果CPK和(或)钾离子短时间迅速升高或者尿量降至0.5 ml·kg-1·h-1以下,应用利尿药物以维持尿量>1 ml·kg-1·h-1,并用碳酸氢钠碱化尿液,防止肌红蛋白尿导致肾功能衰竭[1,5,20]。
除了以上处理,如条件允许,通过相关专科评估积极进行血液净化治疗,主要考虑解决酸碱失衡和电解质紊乱、肌红蛋白尿、高体温等问题[26,27]。注意以下相关内容:
(1)血液净化治疗包括肾脏替代治疗(RRT)、血液灌流(HP)及血浆置换(PE)等。RRT的基本模式有:①血液透析(HD):采用弥散、渗透和超滤原理清除血液中小分子物质和过多水分;②血液滤过(HF):模仿肾小球滤过和肾小管重吸收的原理,以对流方式清除过多水分和中分子物质;③血液透析滤过(HDF):是血液透析和血液滤过的结合,可通过弥散和对流的方式清除体内溶质。连续肾脏替代治疗(CRRT)利于维持内环境稳定,清除肌红蛋白、炎性介质等,利于防治肾功能衰竭。血液灌流(HP)是将患者血液引到体外,通过灌流器中吸附剂吸附毒物、药物、代谢产物,达到清除这些物质的一种血液净化疗法。血浆置换(PE)是一种用来清除血液中大分子物质的方法,将患者血液引出体外,通过血浆分离器分离血浆和细胞成分,去除致病血浆或选择性去除血浆中的某些致病因子,然后将细胞成分、净化的血浆及所需补充的置换液输回体内。
(2)肌红蛋白的相对分子质量为17 500,血浆浓度正常是30~80 μg/L,出现横纹肌溶解时血浆浓度明显升高。CPK高于10 000 U/L是横纹肌溶解症和肌红蛋白尿的可疑表现。尿液颜色深色或者褐色时,应进行CPK、血和尿液的肌红蛋白检测。加大输液量、利尿和碱化尿液利于防止肌红蛋白尿导致的肾功能衰竭。
(3)MH发病早期,尚无肌红蛋白尿表现时,如果出现难以纠正的高钾血症和酸中毒时,可以选择血液透析(HD)或血液透析滤过(HDF),针对性地清除酸性代谢产物和钾离子,对维持内环境稳定起到积极作用。
(4)随着MH病程的发展,肌细胞遭到破坏,肌红蛋白入血可能造成急性肾功能衰竭。可以选择血液滤过(HF)联合血浆置换(PE),重点清除肌红蛋白等较大分子物质,防治肾小管肌红蛋白管型的形成,减少肾功能损伤。血浆置换清除肌红蛋白不可避免地损失凝血因子和蛋白质等物质,应动态监测凝血功能,及时补充凝血因子和蛋白质等。
(5)与传统的冰敷、灌洗、擦拭等方法相比,CRRT降温效果更为确切,同时具备体温易于监测、温度可控性强的特点。相较于体外循环,持续血液滤过损伤更小,实施也更加方便。
(6)MH患者抢救过程中的血液净化措施,选择的具体血液净化方式、滤过膜孔径大小、抗凝方式(根据出血倾向,选择肝素、低分子肝素、枸橼酸钠或不抗凝)等,请相关专科医师协助处理。
加强监测和治疗以确保患者安全度过围手术期[1,5,20]。体征消失后24 h持续监测,发病24~48 h内25%的MH可能复发,未行监测和积极处理可能致命。如出现无寒颤时肌肉僵硬逐渐增强、异常高碳酸血症伴呼吸性酸中毒、无其他原因导致代谢性酸中毒、体温异常升高等则提示MH复发,应尽早启动治疗。给予丹曲林钠1 mg/kg静注,每4~6小时一次,或0.25 mg·kg-1·h-1静脉输注,持续至少24 h,根据临床情况,有时需要更长时间。如果患者24 h内代谢稳定、核心体温低于38 ℃、CPK下降、没有肌红蛋白尿表现且无肌肉僵硬,丹曲林钠可以停用或给药间期延长到每8~12小时一次。持续监测,复查血气,6 h一次CPK检测,如果结果下降可以适当降低检测次数。CPK高于10 000 U/L是横纹肌溶解症和肌红蛋白尿的可疑表现,此时应采用标准治疗措施:补液水化和利尿治疗(碱化尿液维持尿量>2 ml·kg-1·h-1,密切监测尿液和血pH值)。
有条件者,可做"骨骼肌收缩试验"以明确诊断,并对患者及其直系亲属进行基因检测,筛选MH易感者并建立档案,告知患者及MH易感者在接受手术麻醉之前,告知接诊医生相关病史,做好相应预案,以防止MH发生。
<推荐意见9>MH抢救的关键是早期发现,早期应用丹曲林钠治疗,积极对症处理,包括积极降温、维持内环境稳定和防治肾功能衰竭等。在没有丹曲林钠的情况下,建议尽早实施血液净化治疗,加强恢复期的监测,防治MH的再次发作。
MH是致命的麻醉并发症之一,近年在国内屡有发生。尽管国内麻醉界对其严重性已有较充分的认识,但因目前尚缺乏特效治疗药物,一旦发生往往不能及时采取有效的抢救措施,现阶段强化普及提高对MH的预防至关重要[28,29]。鉴于我国国情,特别强调对MH患者应尽早实施物理降温、纠正内环境紊乱、尽早实施血液透析、滤过等肾脏替代措施。现阶段,有条件的医疗中心在备用丹曲林钠,尤其是接受国外捐赠用药时,应遵守国家的有关规定,事先经上级主管部门的审批,医院医务处及药剂科备案[30]。在抢救用药时,须征得患者家属知情同意。
执笔者:王颖林(同济大学附属东方医院麻醉科);王军(北京大学第三医院麻醉科)
顾问:罗爱伦(北京协和医院麻醉科);黄宇光(北京协和医院麻醉科);刘进(四川大学附属华西医院麻醉科);于布为(上海交通大学附属瑞金医院麻醉科);熊利泽(空军医科大学附属西京医院麻醉科);姚尚龙(华中科技大学同济医学院附属协和医院麻醉科);米卫东(解放军总医院麻醉科);薛张刚(复旦大学附属中山医院麻醉科);李天佐(首都医科大学附属世纪坛医院麻醉科);王天龙(首都医科大学附属宣武医院麻醉科);邓小明(海军医科大学附属长海医院麻醉科);俞卫峰(上海交通大学附属仁济医院麻醉科);左云霞(四川大学附属华西医院麻醉科);曹锡清(美国华盛顿特区中心医院麻醉科);刘前进(美国华盛顿大学医学院附属Barnes-Jewish医院麻醉科);童传耀(美国维克森林大学医学院麻醉科);魏华峰(美国宾夕法尼亚大学医学院麻醉科);周洪柱(北京大学第三医院医务处);胥雪东(北京大学第三医院医务处);郑雪倩(中国医院协会医疗法制专业委员会)
共识制定专家组成员(按姓氏汉语拼音排序):艾来提·塔来提(新疆医科大学第一附属医院麻醉科);曹剑(陆军医科大学附属大学西南医院麻醉科);陈绍辉(北京协和医院麻醉科);戴茹萍(中南大学湘雅二医院麻醉科);邓立琴(宁夏医科大学总医院麻醉科);董补怀(西安市红会医院麻醉科);冯秀玲(甘肃省中医学院附属医院麻醉科);冯泽国(解放军总医院麻醉科);顾小萍(南京鼓楼医院麻醉科);何荷番(福建医科大学附属第二医院麻醉科);金善良(上海交通大学医学院附属第三人民医院麻醉科);李传翔(南方医科大学第三附属医院麻醉科);李军(温州医科大学附属第二医院麻醉科);李龙云(吉林大学中日联谊医院麻醉科);林成新(广西医科大学第一附属医院麻醉科);刘洪涛(中国医科大学附属盛京医院麻醉科);柳兆芳(皖南医学院弋矶山医院麻醉科);陆智杰(海军医科大学附属东方肝胆外科医院麻醉科);马挺(首都医科大学宣武医院麻醉科);牛骊(解放军第二一一医院麻醉科);邱颐(内蒙古医科大学第二附属医院麻醉科);舒海华(广东省第二人民医院麻醉科);汪晨(空军医科大学附属西京医院麻醉科);王庚(北京积水潭医院麻醉科);王秀丽(河北医科大学第三医院麻醉科);王颖林(同济大学附属东方医院麻醉科);伍静(华中科技大学同济医学院附属协和医院麻醉科);肖实(江西省武警总队医院麻醉科);徐懋(北京大学第三医院麻醉科);杨建新(山西医科大学第二医院麻醉科);杨静(首都医科大学附属北京同仁医院麻醉科);杨涛(海军医科大学附属长海医院麻醉科);喻文立(天津市第一中心医院麻醉科);袁红斌(海军医科大学附属长征医院麻醉科);张富荣(昆明市延安医院麻醉科);张建欣(解放军第一四八中心医院麻醉科);张兰(四川省骨科医院麻醉科);张伟(郑州大学第一附属医院麻醉科);张熙哲(北京大学人民医院麻醉科);张晓光(复旦大学附属中山医院麻醉科);章放香(贵州省人民医院麻醉科)

























