
用代谢组学分析不同性别成人支气管哮喘(简称哮喘)患者血清甘油磷脂的差异。
纳入2015年1—12月北京大学第三医院门诊诊断的51例(男17例,女34例)成人哮喘患者,搜集性别、年龄、体质指数、肺功能等临床资料,采用液相色谱-质谱联用技术(LC-MS)检测血清甘油磷脂代谢谱,用偏最小二乘-判别分析(PLS-DA)法分析甘油磷脂代谢谱模式,对比分析不同性别患者血清甘油磷脂谱相对水平的差异,对重要差异物进行受试者工作特征(ROC)曲线分析。
不同性别哮喘患者血清甘油磷脂代谢谱存在显著差异,女性患者磷脂酰乙醇胺(PE)、磷脂酰胆碱缩醛磷脂(PCP)、溶血磷脂酰乙醇胺(LPE)、烷基磷脂酰乙醇胺[PE(O)]相对水平均显著高于男性患者[PE36:2、PCP32:1、LPE18:0、PE(O40:7)分别为0.050(0.037,0.079)比0.043(0.000,0.071)、0.057(0.035,0.727)比0.034(0.000,0.057)、0.233(0.129,0.390)比0.126(0.075,0.212)、0.007(0.000,0.041)比0.000(0.000,0.000),均P<0.05],血清溶血磷脂酰胆碱(LPC)、溶血磷脂丝氨酸(LPS)、溶血烷基磷脂酰胆碱[LPC(O)]相对水平也均显著低于男性患者[其中LPS22:6、LPS20:4、LPS18:1分别为0.000(0.000,0.003)比0.009(0.000,0.012)、0.015(0.010,0.026)比0.047(0.022,0.081)、0.008(0.003,0.179)比0.020(0.008,0.040),均P<0.05]。LPS(LPS20:4)分析的ROC曲线下面积为0.814。
不同性别成人哮喘患者血清甘油磷脂谱存在显著差异,LPS可能是性别表型差异的重要原因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(简称哮喘)是常见的慢性气道炎症性疾病,全球患病人数超过3亿人[1]。流行病学调查显示,儿童中男性哮喘发病率高,但在青春期后女性哮喘发病率为男性的2倍,且重症哮喘中女性为主[2],造成此种差异的机制尚不清楚。性激素、瘦素水平及肥胖可能是导致哮喘相别差异的因素[3,4,5,6],提示脂质可能参与哮喘免疫应答。甘油磷脂是细胞膜重要成分,经磷脂酶的代谢水解脂肪链后产生溶血磷脂,与膜上G蛋白偶联受体(GPCR)结合,调控细胞内信号传导途径,参与人体内炎症、免疫、肿瘤等多种疾病的发病过程[7]。代谢组学研究终末代谢产物,是近年来研究疾病发病机制的重要手段。研究显示,不同性别慢性阻塞性肺病患者存在代谢谱的差异,与性别相关的自毒素-溶血磷脂酶D-溶血磷脂酸代谢途径异常[8];而哮喘患者的代谢谱也会发生变化,且代谢谱与哮喘控制水平、炎症类型等疾病特征有关[9,10]。本研究用代谢组学分析不同性别成人哮喘患者血清甘油磷脂的差异。
采用横断面研究,纳入2015年1—12月就诊于北京大学第三医院的51例成人哮喘患者。患者均符合中华医学会呼吸病学分会哮喘学组的《支气管哮喘防治指南》的哮喘诊断标准[11];排除合并慢性阻塞性肺疾病、支气管扩张、肺炎、阻塞性睡眠呼吸暂停、恶性肿瘤、各种急慢性呼吸衰竭以及严重心血管疾病,并排除哮喘急性发作者。
本研究经北京大学第三医院伦理委员会批准(批准文号:2014071),入组患者均签署知情同意书。
记录所有研究对象的性别、年龄、体质指数等人口学信息资料;记录哮喘控制测试(ACT)评分。所有受试者均接受标准肺功能检查,所用设备为美国MedGraphics公司生产的Elite系列肺功能仪,记录用力肺活量(FVC)、第1秒用力呼气量(FEV1)占预计值的百分比(FEV1%预计值)及FEV1/FVC。检测诱导痰炎症细胞分类及计数及外周血常规中嗜酸粒细胞计数,并留取外周血2 ml检测血清磷脂谱。
除按性别分组外,还根据以下指标分组如下:(1)根据ACT评分分为完全控制(25分)、良好控制(20~24分)、未控制(<20分);(2)根据诱导痰炎症细胞比例[12],分为嗜酸粒细胞增高型(≥3%)、非嗜酸粒细胞增高型(<3%);痰中性粒细胞增高型(≥61%)、非中性粒细胞增高型(<61%)。
采集标本前禁食12 h以上,并填写食物频率问卷调查表,以备后期分析饮食对检测结果的影响。抽取外周静脉血2 ml,不抗凝,1 300 g离心分离血清,分装后-80 ℃冰箱保存。
(1)取血浆100 μl(加入脂质组学内标混合物母液10 μl),用75%冰甲醇400 μl混匀,涡旋2 min;(2)加入1 ml甲基叔丁基醚,室温涡旋1 h;(3)加入250 μl H2O,静置10 min分层;(4)13 000 g,4 ℃离心10 min;(5)取上层于新管中吹干;6.1%甲醇溶解,过滤后装入样品瓶。脂质组学内标混合物母液:磷脂酰胆碱(PC)(17:0/17:0)(17:0/17:0表示磷脂酰胆碱上有2个脂肪酸链,每个脂肪酸链上有17个碳原子,0个双键,全文同),磷脂酰乙醇胺(PE)(17:0/17:0),磷脂酰甘油(PG)(17:0/17:0),磷脂酰肌醇(PI)(17:0/17:0),磷脂酸(PA)(17:0/17:0),磷脂酰丝氨酸(PS)(17:0/17:0),各20 μg/ml。
采用液相色谱-质谱联用技术(LC-MS)检测血清磷脂谱:采用超高效液相色谱仪(美国Waters公司),亚乙基桥杂化颗粒(BEH C18)色谱柱(2.1 mm× 100 mm,1.7 μm),柱温25 ℃,流速0.25 ml/min。A液:60%乙腈(5 mmol/L乙酸铵),B液:异丙醇与乙腈体积比为9∶1;液相色谱洗脱梯度:0~3 min ,流动相中B液比例为15%;3~15 min,流动相中B液比例由15%线性递增至99%;15~17 min,流动相中B液的比例维持在99%;17~19 min,流动相中B液比例由99%线性下降至15%;19~20 min,流动相中B液比例维持在15%。质谱仪为美国AB Sciex 5500 QTRAP,采用电喷雾离子源(型号Turbo V ESI),扫描模式:多反应监测,离子源参数:气帘气压力=40 psi(1 psi=6.895 kPa),雾化气压=30 psi,去溶剂气压=30 psi,离子源电压=-4 500 V,中等碰撞强度,离子化温度=350 ℃。具体见表1。
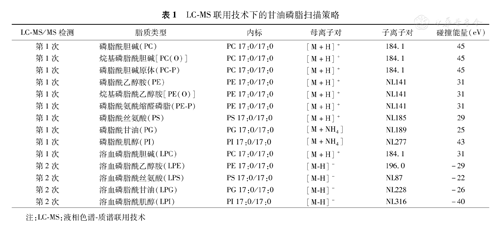
LC-MS联用技术下的甘油磷脂扫描策略
LC-MS联用技术下的甘油磷脂扫描策略
| LC-MS/MS检测 | 脂质类型 | 内标 | 母离子对 | 子离子对 | 碰撞能量(eV) |
|---|---|---|---|---|---|
| 第1次 | 磷脂酰胆碱(PC) | PC 17:0/17:0 | [M+H]+ | 184.1 | 45 |
| 第1次 | 烷基磷脂酰胆碱[PC(O)] | PC 17:0/17:0 | [M+H]+ | 184.1 | 45 |
| 第1次 | 磷脂酰胆碱原体(PC-P) | PC 17:0/17:0 | [M+H]+ | 184.1 | 45 |
| 第1次 | 磷脂酰乙醇胺(PE) | PE 17:0/17:0 | [M+H]+ | NL141 | 31 |
| 第1次 | 烷基磷脂酰乙醇胺[PE(O)] | PE 17:0/17:0 | [M+H]+ | NL141 | 31 |
| 第1次 | 磷脂酰氨酰缩醛磷脂(PE-P) | PE 17:0/17:0 | [M+H]+ | NL141 | 31 |
| 第1次 | 磷脂酰丝氨酸(PS) | PS 17:0/17:0 | [M+H]+ | NL185 | 29 |
| 第1次 | 磷脂酰甘油(PG) | PG 17:0/17:0 | [M+NH4] | NL189 | 25 |
| 第1次 | 磷脂酰肌醇(PI) | PI 17:0/17:0 | [M+NH4] | NL277 | 43 |
| 第1次 | 溶血磷脂酰胆碱(LPC) | PC 17:0/17:0 | [M+H]+ | 184.1 | 31 |
| 第2次 | 溶血磷脂酰乙醇胺(LPE) | PE 17:0/17:0 | [M-H]- | 196.0 | -29 |
| 第2次 | 溶血磷脂酰丝氨酸(LPS) | PS 17:0/17:0 | [M-H]- | NL87 | -22 |
| 第2次 | 溶血磷脂酰甘油(LPG) | PG 17:0/17:0 | [M-H]- | NL228 | -26 |
| 第2次 | 溶血磷脂酰肌醇(LPI) | PI 17:0/17:0 | [M-H]- | NL316 | -40 |
注:LC-MS:液相色谱-质谱联用技术
检测各类甘油磷脂的信号强度,为相对水平,即该化合物色谱峰面积与内参峰面积的比值。
采用http://www.metaboanalyst.ca/网站中的多元统计工具,对不同性别甘油磷脂水平将进行比较。对受试者样本进行偏最小二乘法判别分析(PLS-DA),用变量重要性排序值,载荷权重和相关系数等方法筛选差异代谢物。采用SPSS 19.0软件包进行分析,正态分布的计量资料以 ±s表示,不同性别组间比较进行两独立样本t检验;非正态分布的计量资料用M(Q1,Q3)表示,组间比较采用非参数t检验;构成比的比较采用χ2检验。对分型做出贡献的差异代谢物,进一步用One-way ANOVA和Bonferroni多重比较的方法来验证。代谢物的评价用受试者工作特征(ROC)曲线。以P<0.05为差异有统计学意义。
±s表示,不同性别组间比较进行两独立样本t检验;非正态分布的计量资料用M(Q1,Q3)表示,组间比较采用非参数t检验;构成比的比较采用χ2检验。对分型做出贡献的差异代谢物,进一步用One-way ANOVA和Bonferroni多重比较的方法来验证。代谢物的评价用受试者工作特征(ROC)曲线。以P<0.05为差异有统计学意义。
51例患者中,男17例,女34例,年龄(43.3±14.0)岁;FEV1%预计值(92.3±16.0)%,FEV1/FVC (73.3±10.8)%;不同性别组年龄、体质指数、FEV1%预计值及FEV1/FVC差异均无统计学意义(均P<0.05)(表2)。
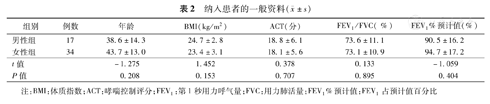
纳入患者的一般资料( ±s)
±s)
纳入患者的一般资料( ±s)
±s)
| 组别 | 例数 | 年龄 | BMI(kg/m2) | ACT(分) | FEV1/FVC( %) | FEV1%预计值(%) |
|---|---|---|---|---|---|---|
| 男性组 | 17 | 38.6±14.3 | 24.7±2.8 | 18.8±6.1 | 73.6±11.1 | 90.5±16.2 |
| 女性组 | 34 | 43.7±13.0 | 23.4±3.1 | 18.1±5.6 | 73.1±10.9 | 94.7±17.2 |
| t值 | -1.275 | 1.452 | 0.378 | 0.133 | -1.059 | |
| P值 | 0.208 | 0.153 | 0.707 | 0.895 | 0.404 |
注:BMI:体质指数;ACT:哮喘控制评分;FEV1:第1秒用力呼气量;FVC:用力肺活量;FEV1%预计值:FEV1占预计值百分比
共检测到14类共129种甘油磷脂,分别为:磷脂酰胆碱(PC 21种)、烷基磷脂酰胆碱[PC(O) 15种]、磷脂酰胆碱缩醛磷脂(PCP 8种)、磷脂酰乙醇胺(PE 12种)、烷基磷脂酰乙醇胺[PE(O) 4种]、磷脂酰乙醇胺缩醛磷脂(PEP 2种)、磷脂酰甘油(PG 2种)、磷脂酰肌醇(PI 11种)、溶血磷脂酰胆碱(LPC 11种)、溶血磷脂酰乙醇胺(LPE 12种)、溶血磷酯酰丝氨酸(LPS 5种)、溶血磷脂酰甘油(LPG 11种)、溶血磷脂酰肌醇(LPI 9种)、溶血烷基磷脂酰胆碱[LPC(O) 6种]。
不同性别患者甘油磷脂代谢谱多元统计分析结果见图1。偏最小二乘-判别分析模型可大致将女性和男性患者在二维平面上区分开。女性患者LPC(包括LPC20:4、LPC20:3、LPC 18:1、LPC 18:2、LPC 18:2、LPC 16:1、LPC22:6、LPC18:3、LPC18:0、LPC 14:0、LPC 16:0、LPC 20:5)、LPS(包括LPS22:6、LPS20:4、LPS18:1)及LPC(O) [包括LPC(O22:1)、LPC(O24:2)、LPC(O20:0)]均显著低于男性患者,而PE(PE36:2)、PCP(PCP32:1)、LPE(LPE18:0)、PEO [PE(O40:7)]均显著高于男性患者(表3)。
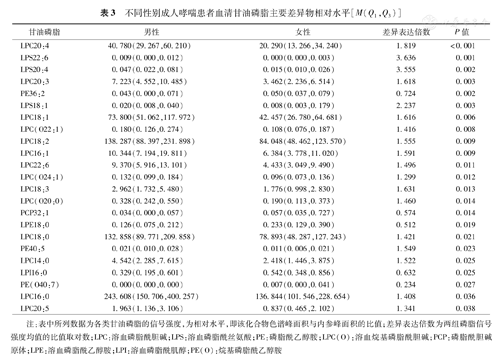
不同性别成人哮喘患者血清甘油磷脂主要差异物相对水平[M(Q1,Q3)]
不同性别成人哮喘患者血清甘油磷脂主要差异物相对水平[M(Q1,Q3)]
| 甘油磷脂 | 男性 | 女性 | 差异表达倍数 | P值 | ||
|---|---|---|---|---|---|---|
| LPC20:4 | 40.780 | (29.267,60.210) | 20.290 | (13.266,34.240) | 1.819 | <0.001 |
| LPS22:6 | 0.009 | (0.000,0.012) | 0.000 | (0.000,0.003) | 3.636 | 0.001 |
| LPS20:4 | 0.047 | (0.022,0.081) | 0.015 | (0.010,0.026) | 3.555 | 0.002 |
| LPC20:3 | 7.223 | (4.552,10.485) | 3.462 | (2.236,6.514) | 1.618 | 0.003 |
| PE36:2 | 0.043 | (0.000,0.071) | 0.050 | (0.037,0.079) | 0.724 | 0.002 |
| LPS18:1 | 0.020 | (0.008,0.040) | 0.008 | (0.003,0.179) | 2.237 | 0.003 |
| LPC18:1 | 73.800 | (51.062,117.972) | 42.457 | (26.780,64.681) | 1.616 | 0.006 |
| LPC(O22:1) | 0.180 | (0.126,0.274) | 0.108 | (0.076,0.187) | 1.416 | 0.008 |
| LPC18:2 | 138.287 | (88.397,231.898) | 84.048 | (48.462,123.570) | 1.555 | 0.009 |
| LPC16:1 | 10.344 | (7.194,19.811) | 6.384 | (3.778,11.020) | 1.591 | 0.009 |
| LPC22:6 | 9.370 | (5.916,13.101) | 4.433 | (3.049,9.490) | 1.496 | 0.011 |
| LPC(O24:1) | 0.132 | (0.099,0.184) | 0.096 | (0.073,0.136) | 1.299 | 0.012 |
| LPC18:3 | 2.962 | (1.732,5.480) | 1.776 | (0.998,2.830) | 1.631 | 0.013 |
| LPC(O20:0) | 0.328 | (0.242,0.550) | 0.190 | (0.113,0.373) | 1.460 | 0.014 |
| PCP32:1 | 0.034 | (0.000,0.057) | 0.057 | (0.035,0.727) | 0.574 | 0.014 |
| LPE18:0 | 0.126 | (0.075,0.212) | 0.233 | (0.129,0.390) | 0.512 | 0.019 |
| LPC18:0 | 132.858 | (89.771,209.858) | 78.893 | (48.287,127.243) | 1.421 | 0.021 |
| PE40:5 | 0.021 | (0.010,0.028) | 0.011 | (0.006,0.021) | 1.549 | 0.023 |
| LPC14:0 | 4.542 | (2.285,7.615) | 2.418 | (1.446,3.875) | 1.522 | 0.025 |
| LPI16:0 | 0.329 | (0.195,0.601) | 0.542 | (0.348,0.856) | 0.632 | 0.025 |
| PE(O40:7) | 0.000 | (0.000,0.000) | 0.007 | (0.000,0.041) | 0.234 | 0.027 |
| LPC16:0 | 243.608 | (150.706,400.257) | 136.844 | (101.546,228.654) | 1.408 | 0.036 |
| LPC20:5 | 1.963 | (1.136,3.106) | 0.837 | (0.465,2.102) | 1.341 | 0.038 |
注:表中所列数据为各类甘油磷脂的信号强度,为相对水平,即该化合物色谱峰面积与内参峰面积的比值;差异表达倍数为两组磷脂信号强度均值的比值取对数;LPC:溶血磷脂酰胆碱;LPS:溶血磷脂酰丝氨酸;PE:磷脂酰乙醇胺;LPC(O):溶血烷基磷脂酰胆碱;PCP:磷脂酰胆碱原体;LPE:溶血磷脂酰乙醇胺;LPI:溶血磷脂酰肌醇;PE(O):烷基磷脂酰乙醇胺
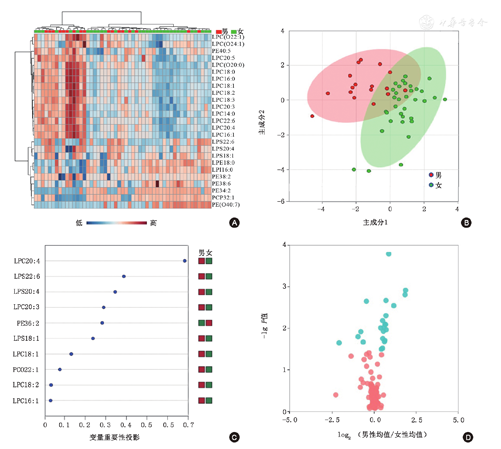

注:A.热图:每个小方格代表一种甘油磷脂,其颜色表示该种脂质的血清含量,含量越高色调越深(棕红色为高表达,蓝色为低表达)。每行表示每种甘油磷脂在不同样本中的血清水平,每列表示每个样本中所有甘油磷脂的血清水平;B.偏最小二乘-判别分析(PLS-DA)得分图:红点代表男性患者组,主要集中在得分图的左上角,表明这些样本中甘油磷脂的血清水平接近,绿点代表女性患者组,本图中红点与绿点间分布在不同区域,代表两组患者的血清甘油磷脂水平差异较大;C. PLS-DA载荷图:横坐标是变量重要性投影(VIP),用于估计每个参数在偏最小二乘判别模型中的重要性,纵坐标显示对性别分组起主要贡献的代谢产物。男女相对水平以不同颜色表示,红色代表血清中甘油磷酸酯高表达,绿色代表低表达。D.火山图:绿色代表不同性别分组间有显著差异的甘油磷脂(P<0.05,且变化倍数>1.2或<0.8),粉色代表无显著差异的甘油磷脂。横坐标为某一磷脂在女性患者与男性患者中的比值取以2为底数的对数,纵坐标表示该磷脂在不同性别分组中P值取以10为底数的对数,并取负值。该图中显著变化的磷脂为LPC20:4、LPS22:6、LPS20:4、LPC20:3、PE 36:2、LPS18:1、LPC 18:1、LPC(O22:1)、LPC 18:2、LPC 16:1、LPC22:6、LPC(O24:1)、LPC18:3、LPC(O20:0)、PCP32:1、LPE18:0、LPC18:0、PE40:5、LPC 14:0、LPI 16:0、PE(O40:7)、LPC 16:0、LPC 20:5
LPS、LPC、LPC(O)的ROC曲线下面积(AUC)>0.700。具体结果:LPS22:6、LPS20:4和LPS18:1的AUC分别为0.760、0.814、0.758;LPC14:0、LPC16:0、LPC16:1、LPC18:0、LPC18:2、LPC 18:3、LPC 20:3、LPC 20:4、LPC20:5、LPC 22:6的AUC分别为0.678、0.676、0.697、0.696、0.730、0.711、0.673、0.737、0.773。LPC(O22:1)、LPC(O24:2)、LPC(O20:0)的AUC分别为0.715、0.645、0.673(图2)。其他磷脂的ROC曲线AUC均<0.700。
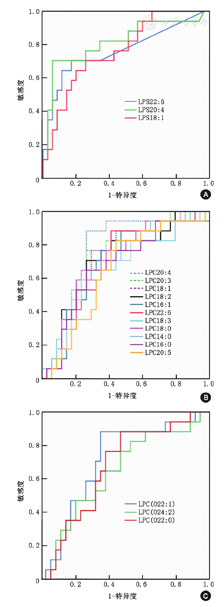

注:A、B、C分别为LPS、LPC、LPC(O)的ROC曲线。LPS:溶血磷脂酰丝氨酸;LPC:溶血磷脂酰胆碱;LPC(O):溶血烷基磷脂酰胆碱
女性患者中,哮喘症状完全控制/部分控制/未控制亚组的LPC14:0、LPC20:4、LPC 22:6相对水平有差异趋势(P=0.900、0.083、0.088);痰嗜酸粒细胞增高组与非增高组、痰中性粒细胞增高组与非增高组的LPS、LPC、LPC(O)相对水平差异均无统计学意义。
男性患者中,哮喘症状完全控制/部分控制/未控制亚组的LPS、LPC、LPC(O)相对水平差异均无统计学意义;痰嗜酸粒细胞增高组的LPC(O24:1)及LPC(O24:2)相对水平均显著高于非嗜酸粒细胞增高组(P=0.014,0.022);LPC(O22:1)有增高趋势(P=0.073);痰中性粒细胞增高组与非增高组的LPS、LPC、LPC(O)相对水平差异均无统计学意义。
本研究用代谢组学分析不同性别成人哮喘患者血清甘油磷脂水平,共检测到14类、129种磷脂,结果显示女性患者LPC、LPC(O)、LPS明显低于男性患者;LPS的AUC>0.80,LPC、LPC(O)的AUC>0.70。这是首次发现溶血磷脂在不同性别哮喘患者中的表达差异。
本研究团队前期工作发现哮喘患者血清LPS水平低于正常对照(数据暂未正式发表),提示LPS可能对哮喘有保护作用。分析其在不同性别哮喘患者中表达差异的原因如下:其一,可能与男女LPS代谢关键酶——磷脂酶水平差异有关。LPS是由磷脂酶水解PS产生,包括对PS特异性的磷脂酶A1(PLA1)及对多数甘油磷脂有水解作用的磷脂酶A2(PLA2)。PLA2在女性哮喘患者血清中的表达显著低于男性患者[13]。其二,LPS的产生需要还原型辅酶Ⅱ氧化酶[14]。男女体内氧化-抗氧化环境不同,可能影响LPS的产生。LPS在胸腺、肺脏、外周淋巴组织、中枢神经系统及结肠中表达丰富,参与免疫应答[15]:(1)LPS通过与GPCR结合,抑制CD4+T淋巴细胞增殖和T调节细胞的分化[15];(2)LPS与GPCR结合后,增加巨噬细胞数量,并促进单个巨噬细胞对凋亡的中性粒细胞的清除能力,有助于清除活化的中性粒细胞炎症[14,16];(3)LPS可作用于树突细胞,诱导分泌白细胞介素-10的调节性T细胞生成[17]。女性重症哮喘发病率高,可能与其LPS水平低有关。
LPC是PLA2水解PC产生[18]。其性别表达差异可能与PLA2表达差异有关[13]。研究显示卵白蛋白致敏的小鼠血清[9]及肺泡灌洗液[19]中的LPC浓度显著低于健康对照,提示LPC对哮喘可能有保护作用。
LPC(O)是脂蛋白PLA2作用于血小板活化因子产生。本研究显示女性患者LPC(O)低于男性患者,男性患者痰嗜酸粒细胞增高组LPC(O)水平高于非增高组。这可能与睾丸激素对哮喘的保护作用有关[2,5,20]。睾丸激素可抑制哮喘固有淋巴样2型细胞炎症[2],睾丸激素-脂质-哮喘免疫的作用通路值得深入研究。
本研究基于代谢组学的理论基础,采用LC-MS技术发现了不同性别哮喘患者血清甘油磷脂代谢谱的显著差异。其中,LPS可能是不同性别哮喘表型差异的重要原因,可能为女性哮喘患者的精准治疗提供靶点。但本研究样本量偏小,下一步拟扩大样本量,进一步分析LPS在不同性别、不同严重程度哮喘患者中的表达差异,并对性激素如何影响PLA2、LPS的表达及参与免疫调节的作用机制进行深入研究。



























