
分析维生素D(VD)摄入不足对精子质量以及男性生育力的具体影响,并讨论影响的机制。
通过喂食VD缺乏饲料与避光饲养建立VD缺乏的小鼠模型,对正常组与VD缺乏组小鼠进行精子活力、形态、超微结构观察、睾丸病理、性激素6项以及生育力分析,探究VD缺乏对雄性小鼠的生殖影响。
相较正常组,VD缺乏组小鼠精子浓度较低[(128±53) ×106/ml比( 58±15) ×106/ml,P<0.05],附睾中精子数量少,睾丸精子成熟稍慢,但不明显;血清睾酮[(328±65) nmol/L比(255±58 )nmol/L]、雌二醇[(60±115 )pmol/L比(384±104 )pmol/L]水平较低,卵泡刺激素[(296±177)ng/L比(219±105) ng/L]与黄体生成素[(393±129) ng/L比(364±108) ng/L]较高,差异有统计学意义(P<0.05),其余检测差异无统计学意义(均P>0.05)。
VD摄入不足对精子质量的影响程度并不突出,VD对男性生殖的具体影响还有待进一步研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
维生素D(VD)作为一类类固醇激素近年来受到越来越多的关注,其经典作用牵涉到调节钙和磷之间的平衡,另外,已经有研究证明VD缺乏可能参与了许多病理过程,如癌症[1]、上呼吸道感染[2]、慢性肾病[3]等。近来,许多研究已经将注意力转移到VD与人类生殖的关系上。VD影响女性生殖系统的功能,并与多囊卵巢综合征、子宫平滑肌瘤、子宫内膜异位症和体外受精(IVF)结局有关[4]。而对于男性,有研究者发现,血清VD水平高的男性,无论是精子质量还是生育力都较缺乏组好[5]。VD与精子质量之间的正相关性在不少回顾性研究中曾有报道[6]。然而,还是有研究者对此存在怀疑[7]。VD的来源有两条途径:大多数通过皮肤暴露于阳光紫外线下而自行合成内源性VD,其余是通过饮食摄入[8]。有研究发现,健康饮食,正常摄入VD会对男性生育有着重要的促进作用,VD含量高的饮食模式与弱精子症风险降低相关[9]。与其他科学研究类似,这个结论也饱受质疑。VD摄入不足对精子质量的影响,以及对男性生殖系统的影响,这些都还是未知数。本研究拟在动物水平,通过VD缺乏饲料与避免光照诱导模型小鼠,探讨VD缺乏的与男性精子质量以及男性生殖的关系。
为避免母乳中VD的影响,将20只雄性C57BL/6J小鼠与10只雌鼠(购于上海斯莱克实验动物有限公司)以2∶1合笼,平分为VD缺乏组和正常对照组,取其雄性子代50只,每组各25只。VD缺乏组以不含VD的纯化饲料,每只每天4 g标准饲养,饲料存于笼中不超过48 h,笼外用遮光布进行紫外线遮蔽处理。VD充足组以普通饲料VD饲养,12 h正常光照。另购20只雌鼠用于后期合笼,以观察两组小鼠生育力。具体分组见图1。
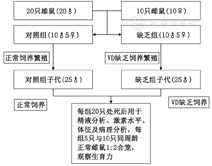

不含VD的纯化饲料(购于南通特洛菲饲料科技有限公司);戊巴比妥(美国Sigma公司);HTF培养液(美国Sage公司)性激素6项及VD ELISA试剂盒(美国R&D公司);Bousin液(福州飞净公司);苏木精-伊红(HE)染色试剂盒(北京索宝来公司);2.5%戊二醛固定液(福州飞净公司);Epon812包埋剂(美国Serva Feinbiochenica公司);醋酸铀(美国Sigma公司);枸橼酸铅(美国Sigma公司)。
取每组各20只小鼠,饲养至8周待性成熟后开始实验,实验前将HTF培养液37 ℃水浴预热,对小鼠采取戊巴比妥腹腔注射麻醉,摘除眼球取血并解剖,取出附睾,置于2 ml HTF培养液中剪碎,对附睾精子进行游离后,用计算机辅助精子分析系统检测小鼠精子的浓度及精子活动力,吸取10 μl游离精子,涂片,巴氏染色后光镜下观察形态,并记录其畸形精子百分率。
游离附睾精子离心,室温下经2.5%戊二醛(2 h)及1%饿酸(1 h)双固定,2%醋酸铀染色,梯度乙醇脱水,丙酮与Epon812包埋剂渗透,包埋剂包埋,半薄切片,光镜定位,超薄切片,醋酸铀和枸橼酸铅染液双重染色,透射电镜观察(TECNAI 10, PHILIPS,阿姆斯特丹,荷兰),加速电压60 kV。
小鼠麻醉后称重,解剖后取出睾丸,对睾丸进行称重,将睾丸、附睾置入装有1 ml Bousin液的eppendof管中固定,石蜡包埋,切片厚度4~5 μm,进行HE染色,光镜下观察两组之间睾丸形态学及精子发育程度的区别。
将剩余10只雄性小鼠分为VD缺乏组和VD充足组各5只(饲养方法同上),在饲养至10周时将两组小鼠分别与同周龄雌鼠进行交配,合笼第2天观察,观察雌鼠阴道栓是否形成,确认交配成功后隔离雄鼠,雌鼠正常喂养,比较雌鼠产仔数。
将上述小鼠摘除眼球所取血液盛于1.5 ml eppendof管中,静置促其凝固,待血液凝固后,1 800 g,离心10 min,小心将上清吸出,得到血清。采用ELISA试剂盒检测血清25(OH)D3(25VD)、1,25(OH)2D3(125VD),以及性激素6项血清水平,性激素6项包括:黄体生成素(LH)、睾酮(T)、雌二醇(E2)、催乳素(PRL)、抗苗勒氏管激素(AMH)以及卵泡刺激素(FSH)。
采用SPSS 19.0统计学软件进行处理。数据以 ±s表示,组间数据差异采用t检验。P<0.05为差异有统计学意义。
±s表示,组间数据差异采用t检验。P<0.05为差异有统计学意义。
VD正常组小鼠与VD缺乏组小鼠总活动精子(PR+NP)百分数差异无统计学意义[(66±7 )%比(63±12)%,P>0.05),其中前向运动精子(PR)百分数差异也并无统计学意义[(38±17 )%比( 23±21) %,P>0.05],但是其精子浓度差异有统计学意义[(128±53) ×106/ml比( 58±15) ×106/ml,P<0.05]。
VD正常组小鼠与VD缺乏组小鼠于外观并无显著差别,个别VD缺乏组个体较小,称重后正常组体重显著高于缺乏组[(23.5±1.9)g比( 20.8±0.7)g,P<0.01],两侧睾丸重量组间差异均无统计学意义[左侧:(0.082±0.008) g比( 0.078±0.012)g;右侧:(0.082±0.008)g比(0.080±0.013)g,均P>0.05],VD缺乏组其他组织并无发育异常。睾丸病理切片染色观察,VD缺乏组附睾精子较VD正常组少,睾丸精子成熟也较正常组稍慢,但不明显(图2)。正常组与VD缺乏组小鼠雌鼠产仔数差异也无统计学意义[(5.0±1.7)比(4.7±1.0),P>0.05]。
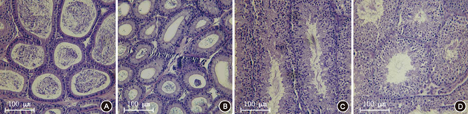

注:A:正常组小鼠附睾;B:VD缺乏组小鼠附睾;C:正常组小鼠睾丸;D:VD缺乏组小鼠睾丸
两组小鼠精子形态光镜观察无明显差异,VD缺乏组并未出现头部与尾部畸形增多的现象,两组之间的精子畸形率差异无统计学意义[(19±3)%比(20±5)%,P>0.05]。而透射电镜观察精子头部的纵切面,两组精子头部染色质均很紧密,没有多余空泡以及形态异常,而尾部横切面显示标准"9+2结构",也无明显差别,VD缺乏组微管结构并未出现紊乱(图3)。
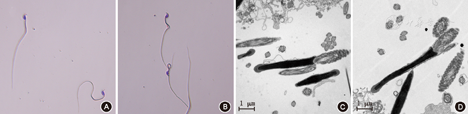

注:A:正常组小鼠精子光镜下形态;B:VD缺乏组小鼠精子光镜下形态;C:正常组小鼠精子超微结构;D: VD缺乏组小鼠精子超微结构
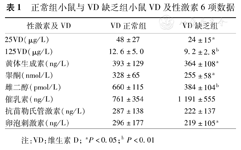
VD正常组小鼠25VD[(48±27)μg/L比(24±15)μg/L,P<0.05]与125VD[(12.6±5.0)μg/L比(9.2±2.8)μg/L,P<0.01]均高于VD缺乏组小鼠,差异均有统计学意义。VD正常组小鼠与VD缺乏组小鼠性激素比较,T、E2、LH、FSH差异均有统计学意义(表1)。
正常组小鼠与VD缺乏组小鼠VD及性激素6项数据
正常组小鼠与VD缺乏组小鼠VD及性激素6项数据
| 性激素及VD | VD正常组 | VD缺乏组 |
|---|---|---|
| 25VD(μg/L) | 48±27 | 24±15a |
| 125VD(μg/L) | 12.6±5.0 | 9.2±2.8b |
| 黄体生成素(ng/L) | 393±129 | 364±108a |
| 睾酮(nmol/L) | 328±65 | 255±58a |
| 雌二醇(pmol/L) | 660±115 | 384±104b |
| 催乳素(ng/L) | 761±354 | 1 191±555 |
| 抗苗勒氏管激素(ng/L) | 287±138 | 222±137 |
| 卵泡刺激素(ng/L) | 296±177 | 219±105a |
注:VD:维生素D; aP<0.05;bP<0.01讨论
随着生活节奏的加快和饮食结构的变化,人们户外活动的时间日趋减少,饮食营养也逐渐失衡,VD缺乏逐渐成为一种高度流行的全球疾病,影响着所有年龄段的人。张巧等[10]对贵阳市男性VD水平进行了统计分析,发现贵阳城区健康成人男性VD缺乏现象普遍,尤其见于青年人、吸烟及高学历者。VD摄入不足已经影响到了很多方面,它不仅是调节钙磷代谢、保持骨骼健康的关键因子,还具有免疫调节、抗增殖、诱导分化和促进凋亡的作用,其在各种疾病的致病机制中的作用已经越来越引起人们的重视[11,12]。
男性不育的病因复杂众多,尽管男性不育的病因学研究已有了很大进展,但仍有约30%的病因不明的特发性不育患者。很多研究结果显示VD是对男性生育力一个潜在的影响因素,其中一个方面就是对精子质量的影响。Yang等[13]对559名男性进行了横断面研究,发现25VD是男性精子活力和形态的独立决定因素,VD缺乏对对精子质量有负面影响。我们的前期研究显示少精子症患者血清VD的水平均显著低于生育组男性,不育患者血清VD水平与前向运动精子率和精子总数呈正相关[14]。本实验中VD缺乏影响了小鼠的血清VD水平,也降低了小鼠的体重,虽然本实验并未对小鼠骨密度进行统计,但作者认为VD对睾丸的影响应该是全身VD缺乏效应的一部分,还并非是特异性的睾丸效应。然而,在本实验中VD缺乏虽然影响了小鼠精子数量,但精子活力以及形态并无显著变化,而精子数量的减少也并没有对小鼠的生育力产生明显的危害,而睾丸形态也并未有影响。我们推测本实验中出现有几种可能,首先,在未来的实验中扩大样本量是有必要的;其次,虽然检测小鼠精子活力常采用附睾精子,但附睾精子与体外精液的精子仍有着细微的区别;小鼠是由家鼠演变而来,喜居于光线较暗的环境,昼伏夜动,也许仅仅通过不摄取VD以及避免光照并不会产生VD受体基因敲除或VD代谢酶敲除那样严重的表型影响。Blomberg等[15]对少精子症患者进行VD补充治疗发现,VD补充并不能提高其精子质量以及活产率。而Ramlau-Hansen等[16]发现血清VD水平高的男性,精子总数与正常形态精子百分数反而更低,关于VD与精子质量的关系仍需要更多研究的证实。
VD对男性生殖的影响不应该仅局限与精子质量检测中,VD对于男性生殖的影响还有一个方面就是影响激素水平,从而影响生殖系统具体功能。VD与睾酮的关系近年来备受关注,睾酮对男性生殖起着至关重要的作用,临床数据统计结果对于睾酮与VD的关系存在争议。Nimptsch等[17]调查了1 362名健康男性血清VD水平和总睾酮的横断面关系,结果发现两者水平呈正相关,而剂量反应曲线的形状表明VD与总睾酮和游离睾酮之间的关系在的VD水平较低(<75 nmol/L)时是线性的。而在动物实验方面,有研究表明,与VD补充组的大鼠相比,VD缺乏组的睾酮循环水平显著降低[18],我们的研究也得到了类似的结果。VD对睾酮的影响机制至今也未彻底明晰,类固醇激素合成急性调节蛋白(StAR)和睾酮合成酶是睾酮生成必不可少的,StAR主要负责将胆固醇运输到线粒体[19]。另一方面,睾酮合成酶对间质细胞睾酮合成起关键作用[20]。Fu等[21]通过动物模型发现VD缺乏组睾丸StAR蛋白水平降低,此外,睾丸3βHSD,CYP11A1、CYP17A1等睾酮合成酶的基因表达也出现下调,这说明VD作为一种调节因子,对睾酮的生成产生着影响。除此之外,我们的实验结果还发现VD缺乏组小鼠的雌二醇水平显著低于对照组。有研究发现VDR敲除小鼠,其睾丸芳香化酶的表达和活性均明显降低,血清雌二醇水平出现减少,提示雌二醇的合成可能是由VD信号的影响[22]。大鼠睾丸支持细胞的体外研究也出现类似结果,发现VD可明显诱导芳香化酶的表达,从而影响雌二醇水平[23]。性激素下降,按照内分泌垂体-性腺轴激素负反馈的基本规律,促性腺激素应该相应有所上升,曾经也有过类似的报道[24],我们此次的观察结果与之类似。
还有一些个体研究认为VD对男性生殖的影响作用体现在对睾丸形态的影响上,Gonçalves等[25]观察VD缺乏可以影响支持细胞膜上的g-谷氨酰转肽酶的活性,进而影响支持细胞的营养供给,导致睾丸内组织细胞不成熟,体积偏小。VD摄入对男性生殖的影响还饱含争议,本研究认为VD缺乏对精子质量的影响并不明显,而其对男性生殖影响具体机制的研究报道还都比较散在,仍有待更多的临床与基础实验的研究。



























