
探讨高风险上尿路尿路上皮癌(UTUC)根治性肾输尿管切除术(RNU)后辅助化疗(ACT)改善患者生存预后的临床意义。
采用前瞻性随机对照研究(RCT)方法,将134例高风险UTUC患者按区组随机化原则,分为单纯RUN治疗组和RUN+ACT治疗组,观察ACT治疗反应,并对比总结两组患者的预后资料,评价ACT在UTUC患者中的应用价值。
RUN组入组61例患者,中位随访时间24(6~36)个月,RUN+ACT组入组73例患者,中位随访时间18(6~36)个月。所有ACT患者均未观察到难以控制的世界卫生组织(WHO)4级化疗毒性反应。尽管ACT有改善高风险UTUC患者RUN术后总体生存率(OS)及肿瘤特异生存率(CSS)的趋势,但在本研究中并未达到统计学差异程度。进一步分析发现,ACT可以改善淋巴结阳性UTUC患者的预后:中位OS延长12.1个月(30.1与18.0个月)、3年OS提高18.4%(49.1%与30.7%,P=0.083),中位CSS延长10.6个月(29.2与18.6个月)、3年CSS提高17.7%(55.9%与38.2%,P=0.047);此外,ACT也可以改善T3/T4期UTUC患者的预后:中位OS延长12.6个月(25.2与12.6个月)、3年OS提高14.1%(41.4%与27.3%,P=0.038),中位CSS延长12.4个月(31.3与18.9个月)、3年CSS提高18.5%(49.2%与30.7%,P=0.044)。
ACT是一项安全有效的治疗措施,对于淋巴结阳性或高分期(T3/T4)的UTUC患者,ACT具有显著改善预后的临床价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高风险上尿路尿路上皮癌(UTUC)占尿路上皮恶性肿瘤的5%~10%,具有恶性度高、进展快、预后差等临床特点,根治手术(RNU)依然是UTUC患者的主要治疗手段。欧洲泌尿外科学会(EAU)2017版指南认为含铂类药物的化疗方案可以使UTUC患者的总体生存率(OS)和无疾病进展生存(DFS)获益,美国国家综合癌症网络(NCCN)2017版指南推荐T2期以上患者及已发生淋巴转移者应接受辅助化疗(ACT)治疗。但是由于缺乏大规模随机对照试验(RCT)研究作为Ⅰ类证据支持,ACT辅助改善RUN术后患者的生存预后,一直缺乏A类治疗推荐。基于此,本研究对高风险UTUC患者随机分组,对比分析单纯RNU手术组及RNU+ACT治疗组患者的生存预后,藉此对ACT改善高风险UTUC生存预后的临床意义做出初步评价,现将结果报道如下。
应用SAS系统按照区组随机化原则编制随机安排表,将2014年1月至2017年10月间我院收治的高风险UTUC患者,随机分为两组:RNU治疗组和RNU+ACT治疗组。其中RNU治疗组患者仅接受根治性手术,RUN+ACT组则于根治术1个月后开始进行3个周期的吉西他滨(Eli Lilly and Company,美国)联合顺铂(齐鲁制药有限公司,中国)3周化疗方案(吉西他滨1 000 mg/m2于第1、8天静脉滴注,顺铂70 mg/m2于第2天、第3天、第4天分次静脉给药)。本研究已通过首都医科大学伦理委员会审查论证,并与受试对象签署知情同意书。
高风险UTUC患者入组标准:术前内镜下活检或根治术病理证实为高级别尿路上皮癌、肿瘤体积超过1 cm、多发病灶、既往接受过膀胱肿瘤电切术或根治性全膀胱切除术,满足任何一条上述标准,均可认定为高风险UTUC患者。
排除标准:低风险的UTUC患者、曾经接受过术前新辅助化疗患者、曾经因膀胱肿瘤接受过GC化疗的患者、罹患过其他病理类型的肿瘤患者、有远处转移的患者、随访中断的患者、术前"健肾"功能显著异常、肾小球滤过率(eGFR)<60 ml·min-1·(1.73 m2)-1的患者,以及合并严重心肺系统疾病的患者,符合任一标准均被排除在本研究之外。
(1)收集所有患者的术前检查资料(胸腹CT、CTU、同位素骨显像、血常规及生化检查);此外,随访期第1年:每3个月复查血常规及生化检查,每6个月复查胸腹CT;随访期第2年起:每年复查胸腹CT和同位素骨显像,以及血常规和生化检查。此外ACT患者,每个化疗周期内均完善世界卫生组织(WHO)化疗毒性反应量表。(2)终点事件:OS和肿瘤特异性生存率(CSS)。(3)对比两组患者的预后差异,总结分析ACT治疗改善高风险患者预后的临床影响,然后对高分期(T3/T4)患者和淋巴结阳性患者分别进一步分层分析,总结ACT改善这两类患者生存预后的临床意义。(4)不良反应:根据WHO化疗毒性反应的评级标准,对患者的不良反应进行随访观察。
应用SPSS 20.0软件进行统计学分析,计量资料用t检验,计数资料用χ2检验。建立Cox比例风险模型,应用Kaplan-Meier算法分析OS和CSS曲线,P<0.05为差异有统计学意义。
本研究共入组了182例高风险UTUC患者,其中134例患者的随访资料齐备,RNU组61例,RNU+ACT组73例,所有患者的背景资料见表1。
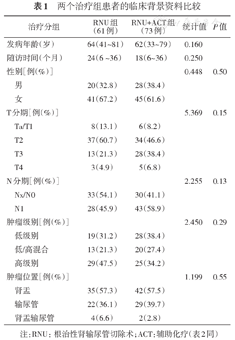
两个治疗组患者的临床背景资料比较
两个治疗组患者的临床背景资料比较
| 治疗分组 | RNU组(61例) | RNU+ACT组(73例) | 统计值P值 | ||
|---|---|---|---|---|---|
| 发病年龄(岁) | 64(41~81) | 62(33~79) | 0.160 | ||
| 随访时间(个月) | 24(6 ~36) | 18(6~36) | 0.250 | ||
| 性别[例(%)] | 0.448 | 0.50 | |||
| 男 | 20(32.8) | 28(38.4) | |||
| 女 | 41(67.2) | 45(61.6) | |||
| T分期[例(%)] | 5.369 | 0.15 | |||
| Ta/T1 | 8(13.1) | 6(8.2) | |||
| T2 | 37(60.7) | 34(46.6) | |||
| T3 | 13(21.3) | 28(38.4) | |||
| T4 | 3(4.9) | 5(6.8) | |||
| N分期[例(%)] | 2.255 | 0.13 | |||
| Nx/N0 | 33(54.1) | 30(41.1) | |||
| N1 | 28(45.9) | 43(58.9) | |||
| 肿瘤级别[例(%)] | 2.450 | 0.29 | |||
| 低级别 | 19(31.2) | 28(38.4) | |||
| 低/高混合 | 13(21.3) | 20(27.4) | |||
| 高级别 | 29(47.5) | 25(34.2) | |||
| 肿瘤位置[例(%)] | 1.199 | 0.55 | |||
| 肾盂 | 35(57.3) | 42(57.5) | |||
| 输尿管 | 22(36.1) | 29(39.7) | |||
| 肾盂输尿管 | 4(6.6) | 2(2.8) | |||
注:RNU:根治性肾输尿管切除术;ACT:辅助化疗(表2同)
如表2所示,RNU+ACT组73例患者在接受辅助化疗的过程中,不良反应以血液系统并发症及消化道反应为主,且多集中于1级和2级水平,无需特殊治疗。仅有2例患者在化疗过程中发生3级血液系统反应,其中1例同时出现粒细胞和白血病严重减少,及时给予集落刺激因子连续治疗3 d后显著好转,另1例出现血红蛋白的严重减少,输血后改善。此外,肾功能损伤的发生率为39.7%,全部集中在1级和2级水平,无需处理,化疗结束后逐渐下降。总体而言,所有接受辅助化疗的患者并未出现严重的肾功能衰竭事件,其他各系统3级以上不良反应的发生率极低,术后辅助化疗是的确是安全可行的。
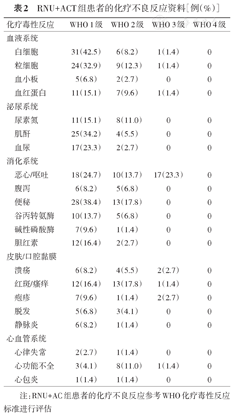
RNU+ACT组患者的化疗不良反应资料[例(%)]
RNU+ACT组患者的化疗不良反应资料[例(%)]
| 化疗毒性反应 | WHO 1级 | WHO 2级 | WHO 3级 | WHO 4级 | |
|---|---|---|---|---|---|
| 血液系统 | |||||
| 白细胞 | 31(42.5) | 6(8.2) | 1(1.4) | 0 | |
| 粒细胞 | 24(32.9) | 9(12.3) | 1(1.4) | 0 | |
| 血小板 | 5(6.8) | 2(2.7) | 0 | 0 | |
| 血红蛋白 | 11(15.1) | 7(9.6) | 1(1.4) | 0 | |
| 泌尿系统 | |||||
| 尿素氮 | 11(15.1) | 8(11.0) | 0 | 0 | |
| 肌酐 | 25(34.2) | 4(5.5) | 0 | 0 | |
| 血尿 | 17(23.3) | 2(2.7) | 0 | 0 | |
| 消化系统 | |||||
| 恶心/呕吐 | 18(24.7) | 10(13.7) | 17(23.3) | 0 | |
| 腹泻 | 6(8.2) | 5(6.8) | 0 | 0 | |
| 便秘 | 28(38.4) | 13(17.8) | 0 | 0 | |
| 谷丙转氨酶 | 10(13.7) | 5(6.8) | 0 | 0 | |
| 碱性磷酸酶 | 7(9.6) | 1(1.4) | 0 | 0 | |
| 胆红素 | 12(16.4) | 2(2.7) | 0 | 0 | |
| 皮肤/口腔黏膜 | |||||
| 溃疡 | 6(8.2) | 4(5.5) | 2(2.7) | 0 | |
| 红斑/瘙痒 | 12(16.4) | 13(17.8) | 1(1.4) | 0 | |
| 疱疹 | 7(9.6) | 1(1.4) | 2(2.7) | 0 | |
| 脱发 | 5(6.8) | 3(4.1) | 0 | 0 | |
| 静脉炎 | 6(8.2) | 1(1.4) | 0 | 0 | |
| 心血管系统 | |||||
| 心律失常 | 2(2.7) | 1(1.4) | 0 | 0 | |
| 心功能不全 | 3(4.1) | 8(11.0) | 1(1.4) | 0 | |
| 心包炎 | 1(1.4) | 1(1.4) | 0 | 0 | |
注:RNU+AC组患者的化疗不良反应参考WHO化疗毒性反应标准进行评估
RNU+ACT组的患者OS曲线略高于RNU组。单纯RNU组患者的中位OS是30.3个月,RNU+ACT组患的中位OS仍在观察中,3年OS提高了10.5%(57.3%与46.8%),但是差异无统计学意义[P=0.65,HR:1.31(0.75~1.82)]。
RNU+ACT组患者的CSS曲线略高于单纯RNU组患者。两组患者的中位CSS时间仍在观察中。尽管随访期内,统计分析未证实两组CSS差异有显著统计学意义[P=0.57,HR:1.18(0.84~1.53)],但是RUN+ACT组患者依然展示了CSS被改善的趋势,3年CSS较单纯RNU治疗组提高了11.2%(63.7%与52.5%)。
RNU+ACT组的OS曲线显著高于RNU组,中位OS分别是30.1个月和18.0个月,中位OS延长了12.1个月,3年OS提高了18.4%(49.1%与30.7%),二者之间差异无统计学意义[P=0.083,HR:1.12(0.71~1.64)]。
RNU+ACT组CSS曲线显著高于RNU组,随访期内两组中位CSS分别是29.2个月和18.6个月,延长了10.6个月,3年CSS提高了17.7%(55.9%与38.2%),二者之间差异有统计学意义[P=0.047,HR:1.05(0.82~1.36)],这意味着,ACT可以使淋巴结阳性患者的肿瘤特异性死亡风险降低1.05倍。
图1A显示,对于T3/T4期的UTUC患者,RNU+ACT组的OS曲线显著高于RNU组。中位OS分别是25.2个月和12.6个月,中位OS延长了12.6个月,3年OS提高了14.1%(41.4%与27.3%),二者之间差异有统计学意义[P=0.038,HR:1.25(0.92~1.58)],这意味着,ACT可以使T3/T4期患者的总体死亡风险降低1.25倍。
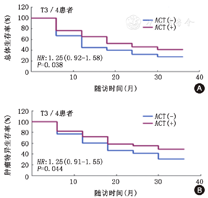

图1B显示,对于T3/T4期的UTUC患者,RNU+ACT组的CSS曲线显著高于RNU组,中位CSS分别是31.3个月和18.9个,中位CSS延长了12.4个月,3年CSS提高了18.5%(49.2%与30.7%),二者之间差异有统计学意义[P=0.044,HR:1.22(0.91~1.55)],这意味着,ACT可以使T3/T4期患者的肿瘤特异性死亡风险降低1.22倍。
尽管UTUC的病理表现与膀胱尿路上皮癌相同,但是两者来自于不同的胚层,细胞的生长特点和基因表型有所不同,大约超过60%的UTUC患者被诊断时已经浸润到了肌层,而膀胱癌患者仅15%~25%初诊时被明确浸润肌层[1]。因此,许多学者认为UTUC是一种与膀胱癌不同的疾病,其临床进展更快、远处转移发生更早,在术后治疗方面,应该不局限于参考膀胱癌的综治措施,ACT应该成为UTUC整体治疗体系中受到更多关注的环节[2]。
国内杜智勇等[3]随访观察了92例高风险UTUC患者后发现,ACT对于患者的OS及CSS无影响,而肿瘤分期和ECOG评分是患者CSS的独立预后因素[3]。Hellenthal等[4]对542例接受过RNU手术的高风险UTUC患者进行回顾性研究,其中121例患者接受了ACT,结果表明OS(HR=1.06,P=0.687)和CSS(HR=1.26,P=0.129)获益同样不明显。Soga等[5]的回顾资料也证实ACT对于改善OS没有明显的效果(95.8%与86.5%,P=0.081)。另外Cohen等[6]回顾分析了3 432例的UTUC患者,其中11.8%的患者接受了RUN+ACT,结果同样发现ACT未能显著改善5年CSS。Kim等[7]回顾总结了65例高风险UTUC患者,其中36例接受了铂类药物化疗,29例患者接受了单纯根治术,随访34个月发现:ACT虽然可以降低患者膀胱内复发率(41.4%与13.9%,P=0.001),然而未能显著改善5年CSS。Lee等[8]回顾总结了27例T3N0M0患者40个月的随访资料,发现ACT并没有显著改善患者的无复发生存率(P=0.794)和疾病特异性生存率(P=0.783)。
但是,最新的大宗回顾资料总结表明:ACT可能使高风险UTUC患者生存获益[9,10]。Lee等[11]回顾分析了344例UTUC患者资料认为,对于淋巴血管侵犯的患者,ACT明显改善了CSS(HR=0.51,P=0.027)和OS(HR=0.50,P=0.025),针对这些淋巴血管受侵的患者,进一步依据病理分期分层分析后发现,T1/T2期合并淋巴血管侵犯时,OS(HR=1.89,P=0.604)及CSS(HR=1.89,P=0.604)没有显著改善,但是T3/T4期合并淋巴血管侵犯的患者,OS(P=0.031)及CSS(P=0.028)均有明显改善[11]。此外,Huang等[12]总结了171例pT3N0M0患者的资料,明确证实ACT能够改善pT3N0M0患者的CSS(80.5%与57.6%,P=0.010)及RFS(74.4%与52.9%,P=0.026)。
基于本研究的结果分析,ACT对于高风险UTUC患者的OS及CSS有一定的改善趋势,尽管暂未达到统计学有意义的程度,而且由于UTUC的辅助化疗目前的推荐尚不统一,所以在选择入组的患者时,可能也存在偏倚。但是随着该项目随访时间的延长、入组病例的增加,可能会得到更有价值的结论。另外,通过对高分期和淋巴结阳性患者的分层分析,我们证实ACT确实能够显著提高T3/T4期患者的CSS,以及淋巴结阳性患者的OS和CSS,因此针对这两类高风险UTUC患者,我们认为ACT具有强烈的临床应用价值。总之,ACT改善UTUC患者生存预后的结论目前依然缺乏大样本试验支持,其临床应用优势尚需依据更多的前瞻性RCT资料进一步评价。
所有作者均声明不存在利益冲突



























