
分析系统性红斑狼疮(SLE)患者20年生存率、死亡原因和影响预后的因素。
回顾性收集2008年6月前于北京大学人民医院初诊的217例SLE患者及其病程中的临床及血清学资料进行了随访,分析生存率、生存现况、死亡原因及预后相关因素。
从诊断时计算SLE患者10、15、20年的累积生存率分别为90.3%、88.1%和79.6%。感染和狼疮脑病是最常见的死亡原因。多因素分析显示初诊时狼疮肾损害、神经精神狼疮、发病年龄是死亡的独立危险因素。
系统性红斑狼疮的预后仍较差,早期诊断、控制脏器损害以及预防感染,对提高患者生存率有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
系统性红斑狼疮(SLE)是一种累及全身多系统和器官的自身免疫病,近年来随着诊治水平的不断提升,SLE患者的预后获得了显著改善,5年生存率从20世纪50年代的50%上升至95%以上,10年生存率则可达90%以上[1]。但国内关于狼疮患者10年及以上生存情况的研究较少。陈盛等[2]研究显示,SLE患者的生存率从发病时开始18年生存率仅为70%。本文在先前5年生存率调查[3]的基础上,对SLE患者20年远期生存情况、死亡原因及预后因素进行总结分析。
收集2008年6月之前在北京大学人民医院初次确诊的SLE患者217例,均符合美国风湿病学会1997年或1982年修订的SLE分类标准。记录整理患者的临床和血清学资料,包括性别、发病年龄、发病时间、首发症状、确诊时间、临床一般表现、心、肾、肺、神经系统及血液系统损害情况、抗核抗体(ANA)、双链DNA抗体(ds-DNA)、补体等,并对其进行电话随访。由于部分患者不能提供确切的治疗方案,仅将患者治疗划分为单用激素治疗和激素加免疫抑制剂联合治疗,免疫抑制剂包括环磷酰胺、硫唑嘌呤、甲氨蝶呤、环孢素A、霉酚酸酯。如果接受免疫抑制剂治疗时间<3个月则不计入统计。
以患者出现首发症状的时间作为发病时间,成人型定义为50岁以下发病的患者,晚发型定义为50岁及50岁以上发病的患者[4,5]。参照文献[6]肾脏损害的标准为:尿蛋白定量(24 h)>0.5 g或定性+++,或管型(红细胞、血红蛋白、颗粒或混合管型)。血液系统损害:溶血性贫血或自细胞减少、淋巴细胞减少、血小板减少。中枢神经系统损害:参照ACR对神经精神狼疮的19条分类定义[7]。肺损害:肺间质病变、弥漫性肺泡出血、肺动脉高压等,并除外其他肺病变原因。心脏损害:心肌炎、心功能不全、心律失常等,除外其他原因心脏病。存活病例的疾病现状用SLICC/ACR SLE损伤指数(SDI评分)和相应的临床分期描述。分期标准[2]:活动期:近1个月内有新发发热、皮疹、关节痛、脱发、脏器受损、炎症指标升高、低补体等表现。控制期:在药物控制下症状消失。稳定期:小剂量激素(泼尼松<15 mg/d)联用或不联用免疫抑制剂无上述症状达6个月以上。缓解期:无狼疮活动表现,停用激素和免疫抑制剂1年以上无复发。低狼疮疾病活动度状态(LLDAS)定义为[8]:(1)SLEDAI-2K≤4,重要器官/系统无活动(肾脏、中枢神经系统、心、肺、血管炎、发热),血液系统和胃肠道无活动性表现。(2)与以前评估相比,没有新的狼疮疾病活动。(3)SELENA-SLEDAI评估≤1。(4)泼尼松龙(或等效激素)剂量≤7.5 mg/d。(5)免疫抑制剂和批准的生物制剂常规剂量维持。
计量资料以 ±s或中位数表示,计数资料以例数和百分比表示。以确诊SLE时间作为观察起点,患者死亡时间为观察终点。Kaplan-Meier分析累积生存率,比例风险模型(Cox参数回归)分析预后因素。以上均用SPSS 13.0软件进行统计处理。
±s或中位数表示,计数资料以例数和百分比表示。以确诊SLE时间作为观察起点,患者死亡时间为观察终点。Kaplan-Meier分析累积生存率,比例风险模型(Cox参数回归)分析预后因素。以上均用SPSS 13.0软件进行统计处理。
217例SLE患者中女202例,男15例,男∶女为1∶13.5。发病年龄(31±12)岁,从发病到确诊时间(26±17)个月。本组患者确诊时以关节炎和(或)关节痛、皮疹和肾损害最为突出,分别为129例(59.4%)、114例(52.5%)和72例(33.2%)。另外出现肺损害的有28例(12.9%),神经系统损害19例(8.8%),心脏损害8例(3.7%)。成人型起病的患者共187例,晚发型起病的患者共30例。
至2018年6月217例患者平均存活时间(14.88±6.10)年,共29例死亡。从发病时起,生存期1个月~40年,中位生存期15年。其中存活0~9年20例,10~14年83例,15~19年78例,20年以上36例。Kaplan-Meier分析10、15及20年总体累积生存率分别为90.3%、88.1%、79.6%。经Log-rank检验,初诊时存在肾损害、神经系统损害、肺损害患者与无相应系统损害患者生存时间差异有统计学意义(P<0.05)。而存在血液系统损害与无血液系统损害患者生存时间差异无统计学意义(P=0.313)。生存曲线见图1。
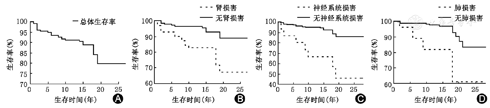

生存的188例患者中SDI评分0~7分,平均1.11±1.23。各器官、系统及相应指标的损伤情况见表1。其中76例(40.4%)患者无器官、系统损伤,1个器官、系统损伤者57例(30.3%),2个器官、系统损伤者34例(18.1%),3个器官、系统损伤者14例(7.4%),4个器官、系统损伤者5例(2.7%),5个器官、系统损伤者2例(1.1%)。存活病例(1.11±1.23)与死亡病例死亡时的SDI(1.76±1.22)相比差异有统计学意义(P=0.007)。病程20年以上患者(1.67±1.35)与病程20年以下(0.93±1.15)SDI相比差异有统计学意义(P=0.004),同时拥有2个及以上脏器损害患者的平均病程(18.55±5.81)年亦长于没有或仅有1个脏器损害(14.38±4.79)年的患者(P=0.017),提示随着病程进展SLE患者的脏器损伤概率逐渐增加。

188例SLE生存患者SLICC/ACR SLE损伤指数
188例SLE生存患者SLICC/ACR SLE损伤指数
| 指标 | 例数(%) | |
|---|---|---|
| 眼睛 | 9(4.8) | |
| 白内障 | 6(3.2) | |
| 视网膜病变或萎缩 | 4(2.1) | |
| 神经精神 | 30(16.0) | |
| 认知障碍 | 14(7.4) | |
| 癫痫,需治疗6个月 | 11(5.9) | |
| 曾有脑血管意外 | 3(1.6) | |
| 脑或周围神经病 | 8(4.3) | |
| 肾脏 | 42(22.3) | |
| 肾小球滤过率<50% | 21(11.2) | |
| 尿蛋白≥3.5 g/24 h | 38(20.2) | |
| 终末肾病 | 14(7.4) | |
| 肺脏 | 38(20.2) | |
| 肺动脉高压 | 11(5.9) | |
| 肺纤维化 | 31(16.5) | |
| 肺梗死 | 1(0.5) | |
| 心血管 | 12(6.4) | |
| 心绞痛或冠状动脉缺血 | 5(2.7) | |
| 曾经心肌梗死 | 1(0.5) | |
| 心肌病 | 9(4.8) | |
| 瓣膜病 | 2(1.1) | |
| 周围血管 | 14(7.4) | |
| 小块组织缺失 | 5(2.7) | |
| 静脉栓塞伴肿胀、溃疡或静脉淤积 | 11(5.9) | |
| 胃肠道 | 4(2.1) | |
| 曾经十二指肠以下肠道、肝脾或胆囊有梗塞或切除史 | 4(2.1) | |
| 慢性腹膜炎 | 1(0.5) | |
| 肌肉骨骼系统 | 41(21.8) | |
| 肌肉萎缩或无力 | 38(20.2) | |
| 变形或侵蚀性关节炎 | 9(4.8) | |
| 骨质疏松伴有骨折或脊椎压缩 | 4(2.1) | |
| 缺血坏死 | 2(1.1) | |
| 糖尿病 | 9(4.8) | |
| 恶性肿瘤 | 2(1.1) | |
生存患者的临床分期见表2。有13例(6.9%)处于临床缓解期,平均停药时间(2.8±1.5)年。稳定期患者97例(51.6%),均服用泼尼松2.5~12.5 mg/d,41例服用羟氯喹,24例服用免疫抑制剂。控制期患者30例(16.0%),均服用泼尼松2.5~20 mg/d,20例服用羟氯喹,26例服用免疫抑制剂。活动期患者48例(25.5%),均服用泼尼松5~50 mg/d,36例服用羟氯喹,43例服用免疫抑制剂。单因素方差分析提示,不同临床分期的患者平均病程间存在明显差异(P=0.01),进一步分析处于缓解期的患者平均病程明显长于处于活动期(P=0.002)、控制期(P=0.002)和稳定期(P=0.027)的患者,而活动期、控制期和稳定期患者平均病程相比差异无统计学意义。存活病例共110例(60.1%)处于低狼疮疾病活动状态(LLDAS)。
SLE生存患者病情活动情况
SLE生存患者病情活动情况
| 分期 | 例数 | SLEDAI评分 | LLDAS | 平均病程(年) | ||
|---|---|---|---|---|---|---|
| 0~4 | 4~9 | >9 | ||||
| 活动期 | 48 | 17 | 28 | 3 | 0 | 15.35 |
| 控制期 | 30 | 30 | 0 | 0 | 17 | 15.56 |
| 稳定期 | 97 | 97 | 0 | 0 | 83 | 16.63 |
| 缓解期 | 13 | 13 | 0 | 0 | 13 | 20.38 |
2008年前就诊的217例中死亡共29例,29例死亡病例中男3例(10.3%),女26例(89.7%),男∶女为1∶8.67,男女患者死亡率差异无统计学意义(P=0.69)。发病年龄15~74(35)岁,晚发型患者的死亡率明显高于成人型起病患者(P=0.016)。死亡年龄18~84(43)岁。死亡患者病程1个月~19年,平均7.72年。死亡原因见表3,本组病例中感染为最常见的死因,共11例,占37.9%,死亡时疾病活动度以轻中度为主(仅1例重度活动)。因狼疮活动死亡患者的死因包括狼疮性脑病(8例)、狼疮性肺损害(2例肺动脉高压,3例狼疮性肺炎)、狼疮性肾炎(1例),共14例,占48.3%,其中13例死亡时处于狼疮重度活动期。另有4例患者,其中1例死于不明原因的呼吸衰竭,1例因血小板减少死于颅内和上消化道出血,1例死于乙肝肝硬化,1例死于抗磷脂综合征。因SLE死亡与感染死亡患者平均生存时间差异无统计学意义(P=0.182)。
29例SLE患者死亡原因分析
29例SLE患者死亡原因分析
| 死亡原因 | 例数(%) | 平均生存时间(年) | |
|---|---|---|---|
| 感染 | 11(37.9) | 6.27 | |
| 肺内感染 | 7(24.1) | 5.14 | |
| 败血症 | 1(3.5) | 15.0 | |
| 颅内感染 | 3(10.3) | 6.0 | |
| 狼疮脑病 | 8(27.6) | 6.25 | |
| 狼疮肺损害 | 5(17.2) | 12.8 | |
| 狼疮肾炎 | 1(3.5) | 19.0 | |
| 其他 | |||
| 抗磷脂综合征 | 1(3.5) | 0.25 | |
| 颅内和上消化道出血 | 1(3.5) | 3.0 | |
| 肝硬化(乙肝相关) | 1(3.5) | 2.0 | |
| 呼吸衰竭(不明) | 1(3.5) | 19.0 | |
SLE患者预后单因素分析发现,发病年龄(发病年龄是否≥50岁)、初诊时存在狼疮肾损害、肺损害、神经系统损害对预后有显著影响(P<0.05),而性别、诊断时血液系统异常、低补体、低白蛋白、抗dsDNA抗体、抗磷脂抗体等因素对生存影响差异无统计学意义,激素是否联合免疫抑制剂治疗对预后的影响差异无统计学意义。进一步多因素分析提示发病年龄、初诊时的狼疮肾损害和神经系统损害为生存率的独立影响因素。
本组SLE患者10年生存率达90.3%,20年生存率79.6%,较国内20世纪80~90年代86%的5年生存率有显著提升[3],亦与近期国内外报道的生存率相近[1,9,10,11,12]。初诊时即存在神经系统、肺脏、肾脏受累的患者生存率均低于无相应系统/脏器受累者。狼疮肾炎10年生存率83%,与Wang等[13]近期荟萃分析中86%的狼疮肾炎生存率相近。神经系统狼疮和狼疮肺损害的长期生存数据较少,本组患者中神经系统狼疮10年生存率67%略低于美国Zirkzee等[14]报道的76%,而与日本Funauchi等[15]报道的69%相近,巧合的是本组患者中狼疮肺损害10年生存率81%,亦与Funauchi研究报道肺损害患者10年生存率84%相近。其中存在神经系统受累的患者生存情况明显差于其他脏器受累的患者,提示尽管SLE总体预后得到了极大改善,在神经系统狼疮方面我们似乎还欠缺有效的治疗手段。但本组狼疮患者中肺损害和神经系统损害的患者数量较少,尚待大样本的前瞻研究以验证。
存活患者中最常见的器官和(或)系统损伤为肾脏,其次为肌肉骨骼系统、肺脏、神经系统,其他器官和(或)系统损伤较少。随着病程延长增加患者器官和(或)系统损伤的概率,生存患者数量明显降低,目前存活患者中绝大部分没有或仅有某一个器官和(或)系统损伤,提示拥有2个及以上系统/脏器损害的狼疮患者可能预后不良。本组患者中的大部分可以通过药物控制达到狼疮的缓解期或稳定期,同时仍有少数病例病情处于活动期,这部分病例大都有近期感染的病史或药物减量的情况,故而预防感染及遵嘱减药在狼疮患者的长期治疗随访中至关重要。LLDAS作为近些年狼疮患者治疗的目标,与患者的长期预后相关[8],本组绝大多数稳定期的患者评估后处于LLDAS状态,亦印证了预防感染及遵嘱减药对改善狼疮预后的积极作用。本研究中处于缓解期的存活患者病程明显长于其他临床分期的患者,而活动期、控制期、稳定期平均病程间无差异,可能因为处于活动期的患者绝大多数均为轻度SLE活动,多为新发皮疹、低热、关节痛等表现,而无重要脏器受累,进而对整体治疗和生存情况无显著影响。
狼疮肾炎、狼疮脑病和感染作为国内SLE的主要死因一直的牢牢占据前3位[16,17,18,19,20],但近年来随着治疗SLE的药物和手段逐渐增多,狼疮患者的死亡原因发生了较大变化。感染逐渐成为国内狼疮患者的第一死因,而狼疮肾炎在死因中的地位则有所下降,有逐渐被肺动脉高压(PAH)所取代的趋势[20],可能由于PAH进展隐匿,早期不易诊断,晚期可逆性差。与此趋势一致,本组病例中主要死因为感染,其次为狼疮脑病和狼疮肺损害,本组病例狼疮肾炎亦不是主要死因,应与近些年治疗药物发展和肾脏替代治疗相关,使狼疮肾炎得到了较好的控制。尽管如此,狼疮肾损害仍是初诊时死亡相关的危险因素之一,这可能与治疗狼疮肾炎时相关药物的远期不良反应以及肾脏替代治疗的并发症有关。与此类似,愈来愈多的国外研究发现,心血管病、恶性肿瘤等老年慢性病逐渐成为欧美狼疮患者的主要死因[11,21,22],而感染则屈居其后,这与国外SLE患者生存时间的大幅延长和激素、免疫抑制剂长期应用所致的慢性损害(如动脉粥样硬化、免疫抑制)不无关系。本研究中暂无因心血管病和恶性肿瘤死亡的病例,应与样本量较少以及患者的死亡年龄较小有关,国内患者在医疗条件、社会经济地位、卫生政策等多方面的差距使他们大多未能达到欧美患者心血管病和恶性肿瘤的好发年龄。尽管如此,伴随越来越多的中国SLE患者存活超过10、20年以上,与治疗狼疮相关的并发症如心血管病、感染、肺动脉高压在狼疮患者生存中逐渐突显的影响应获得更多的重视。
本研究显示,发病年龄、神经系统狼疮、狼疮肾损害是初诊时死亡相关的危险因素,这与近期国内外的研究结果相似[10,16]。分析结果未提示性别、低补体、低白蛋白血症、抗ds-DNA抗体、初诊时血液系统损害对预后的影响差异有统计学意义。结果亦提示不同治疗方法,即单用激素与激素联合免疫抑制剂对预后差异无统计学意义,鉴于不同狼疮患者表现出的高度异质性,这可能提示患者的预后更多取决于自身狼疮在病程中所展现出的特点。针对SLE的预后因素不同研究者报道均不尽相同,应与研究对象的种族、地域、医疗经济条件等不同特点有关。本研究样本量较少,部分数据亦来源于回顾性资料而非定期随访数据,故尚需进一步大样本、多中心前瞻性研究加以验证。
所有作者均声明不存在利益冲突



























